
- •6.Другий закон термодинаміки. Доведення його за допомогою циклу Карно. Ккд
- •4.Теплота і робота. Перший закон термодинаміки та висновки з нього.
- •19. Швидкість хімічної реакції .Рівняння Арреніуса.
- •5.Закон Гесса та висновки з нього.
- •8.Закон Рауля та відхилення від нього.
- •9. Закони коновалова. Розділення сумішей шляхом перегонки.
- •10. Ебуліоскопія
- •11. Кріоскопія
- •12. Явище осмосу. Осмотичний тиск. Біологічна роль.
- •1. Агрегатні стани речовин. Ідеальні та реальні гази. Основні закони ідеальних газів.
- •3. Закон Шарля
- •4. Закон Авогадро.
- •15.Основні поняття:фаза,компонент,ступінь вільності.Правило фаз Гіббса.Однокомпонентні системи.
- •22.Дисперсні системи, основні поняття.Класифікація дисперсних с-м.
- •24.Коагуляція колоїдних розчинів електролітами. Поріг коагуляції. Правило Панета-Фаянса. Механізми коагуляції.
- •25. Молекулярно-кінетичні та оптичні властивості дс.
- •18. Гальванічні елементи
- •16. Застосування правила фаз Гіббса. Двокомпонентні системи. Діаграми стану двокомпонентних систем.
- •20.Каталітичні процеси. Явище каталізу .Види каталізу. Промотори та інгібітори. Їх застосування в промислових процесах.
- •12.Робота різних процесів для одного моля ідеального газу.
- •7.Ентропія.М-ди розрахунку ентропії для різних процесів.Абсолютне значення ентропії.Постулат Планка.
Ф.Х.
6.Другий закон термодинаміки. Доведення його за допомогою циклу Карно. Ккд
Цей закон є постулатом оскільки не може бути виведений з інших законів. Він також належить до загальних законів природи і одержаний емпіричним шляхом. Він має декілька формулювань:
А)Ломоносова.
Теплота не може переходити сама по собі від менш нагрітого тіла до більш нагрітого.
Б)Клаузіуса.
Теплота не може переходити «без компенсації» від менш нагрітого тіла до більш нагрітого.
В)Томсона
Неможливо здійснити процес єдиним результатам якого було перетворення теплоти в роботу.
Г) Освальд
Неможливо створити вічний двигун другого роду. Тобто таку машину, яка б виконувала роботу тільки за рахунок отримання теплоти ззовні без віддачі частини теплоти холодильнику.
- Неможна побудувати машину з коефіцієнтом корисної дії=1
АНАЛІТИЧНИЙ ВИРАЗ ДРУГОГО ЗАК. ТЕРМ.
![]() або
або
![]()
Q-кількість теплоти.
S – ентропія( міра невпорядкованості)
Аналітичний вираз можна довести за допомогою циклу К.
Він являє собою систему яка складається із тепло нагрівача, теплоприймача та робочого тіла.

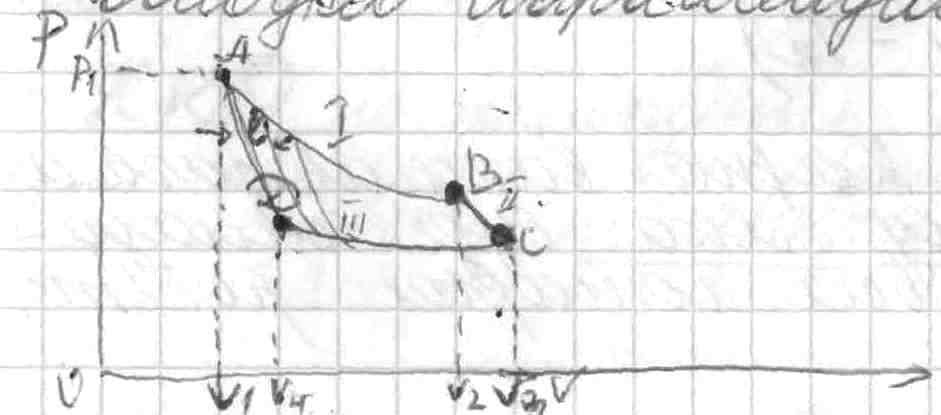
1.етап. Після нагрівання, ідеальний газ ізотермічно розширюється з точки А до точки В. При цьому, виконується корисна робота ізотермічного розширення.
![]() 1
= RT1
ln V2/V1
1
= RT1
ln V2/V1
2 етап. З точки В до точки С газ продовжує адіабатично розширюватися до максимально можливого об’єму. При цьому була виконана робота адіабатичного розширення газу.
A2 = Cv( T1 – T2)
Оскільки це є цикл то можна повернутись у вихідне положення.
3етап. Для повернення у вих.. положення газ необхідно стиснути. Для цього затрачається енергія ззовні, відбувається процес ізотермічного стиснення.
A3 = RT2 ln V4/V3 = - RT2 ln V3/V4 = -Q2
4етап. Для повернення у вихідну точку газ діабатично стискають.
A4 = - Cv( T1 – T2)
В цілому, цикл К. виконав загальну корисну роботу, яка буде складатися із суми всіх чотирьох робіт.
A=A1+A2+A3+A4 = RT1 ln V2/V1 + Cv( T1 – T2) - RT2 ln V3/V4 - Cv( T1 – T2) = RT1 ln V2/V1 - RT2 ln V3/V4
Cv – ізохорна теплоємність.
Так, як V2/V1 = V3/V4 можемо записати: RT1 ln V2/V1 - RT1 ln V2/V1 = Q1 - Q2
Поділимо ліву і праву частину рівняння на вираз:
![]() A/Q1
= RT1
ln
V2/V1
- RT1
ln
V2/V1
⁄ RT1
ln
V2/V1
=1
– T2/T1
= 1 – Q2/Q1
A/Q1
= RT1
ln
V2/V1
- RT1
ln
V2/V1
⁄ RT1
ln
V2/V1
=1
– T2/T1
= 1 – Q2/Q1
Таким чином зробивши перетворення отримаємо:
A/Q1 = T1 – T2/ T 1 = Q1 - Q2/ Q1
Таким чином ми сформулювали ще одне визнач. 2 –гого закону термодин.
ККД не залежить від виду палива, а тільки від різниці вихідної і кінцевої температури.
1 – T2/T1 = 1 – Q2/Q1
T2/T1 = Q2/Q1
Q1/T1= Q2 /T2
Q1/T1
- Q2
/T2
= 0 Якщо Т = const,
то T1
= T2![]() ∆Q/T
= 0
∆Q/T
= 0
Таким чином :
![]()
Ф.Х.
4.Теплота і робота. Перший закон термодинаміки та висновки з нього.
Теплота – (Q) характериз. rількістю енергії, яка переноситься частинками речовини, що рухаються хаотично. В наслідок вдаряння таких частинок в поверхню розділу фаз відбувається підвищення температури поверхні( тобто її розігрівання). В терм один. Всі зміни розглядаються з точки зору термодинамічної системи.
Тому, якщо в результаті термодин. процесу система витрачає певну кількість тепла , то така теплота вважається негативною ( ендотермічний ефект -- Q ).
Якщо навпаки система отримує тепло ззовні то вона вважається додатною (екзотермічний ефект + Q)
Якщо, процес протікає при сталому V , то тепловий ефект буде ізохорним.( Qv).
При сталому Р – ізобарний (Qp)
Величина теплоти не є функцією стану системи оскільки її зміна залежатиме від шляху протікання процесу. Тому вона виражається неповним диференціалом (δQ)
при V= const величина ізохорного теплового ефекту буде = різниці внутрішньої енергії Qv=∆U
при Р = const ; Qp = ∆H(різниця ентальпії термодинамічної системи).
Робота –(А) це кількість енергії яка передається частинками, що рухаються впорядковано.
- Якщо термодинамічна система сама виконує роботу, то її величина вважається додатною (+А).
- Якщо ж робота виконується над системою то вона вважається відємною (- А).
Як і теплота, робота не є функцією стану системи, оскільки її величина теж залежить від шляху протікання процесу . Її зміни виражаються також неповним диференціалом (δА).
Перший закон термодин.
Один із законів природи, який вважається постулатом, оскільки в природі не існує жодних процесів які б суперечили, або не підкорялися йому. Виведений був емпіричним шляхом. Вперше його сформулював Ломоносов. Також над ним працювали Джоуль, Карно, ГЕС…
Теоретично даний закон неможливо вивести за допомогою законів фізики або хімії.
Основні формулювання.
Загальний запас енергії системи є величина стала. Σ Е = const
Якщо в якому небуть процесі, енергія одного виду зникає, то замість неї з'являється енергія іншого виду, в кількості строго еквівалентній першій.
Енергія не зникає і не утворюється із нічого, а тільки перетворюється з одного виду в інший.
Неможливо побудувати вічний двигун першого роду, тобто машину якаб виконувала роботу не одержуючи тепла ззовні.
Зміна внутрішньої енергії = кількості теплоти підведеної до системи зменшеної на величину виконаної системою роботи.
∆U = Q – А математичний або аналітичний вираз 1-го з-ну. Термод.
dU = δQ – δА - в диференціальній формі.
δА – це сума всіх видів роботи які може виконати система.
δА = PdV + σdS + φdε + BdH + Wdh + ..
механ повер- електор магн гравітаційне
нева поле поле поле
де: Р – зовнішній тиск;
V – об’єм ;поверхневий натяг
σ – поверхневий натяг;
S – величина площі поверхні в розділі фаз.- електричний потенціал
φ.- електричний потенціал;
ε – фактор ємності конденсатора;
B – величина індукції магнітного поля.
H – напруженість магнітного поля;
W – сила земного тяжіння;
ВИСНОВКИ
Якщо з усіх видів роботи виконана тільки робота протидії зовнішньому тиску, то 1- й з-н термод. набуває вигляду. ∆U = Q – р∆V
Якщо термодинамічна система здійснює круговий процес, тобто цикл I
 II,
то зміна внутрішньої енергії ∆U
= 0
Q
= А
II,
то зміна внутрішньої енергії ∆U
= 0
Q
= А
Якщо процес протікає при сталому обємі V= const, то . . ∆U = Qv – р∆V; ∆V = 0
∆U = Qv
Якщо процес протікає при Р = const, то ∆H = Qp
Доведення: H = U + pV
∆H = ∆U + ∆(pV) = ∆U + р∆V + V∆p = Qp - р∆V + р∆V + V∆p = Qp + V∆p
Так, як при Р = const ∆H= Qp
Ф.Х.
