
- •6.Другий закон термодинаміки. Доведення його за допомогою циклу Карно. Ккд
- •4.Теплота і робота. Перший закон термодинаміки та висновки з нього.
- •19. Швидкість хімічної реакції .Рівняння Арреніуса.
- •5.Закон Гесса та висновки з нього.
- •8.Закон Рауля та відхилення від нього.
- •9. Закони коновалова. Розділення сумішей шляхом перегонки.
- •10. Ебуліоскопія
- •11. Кріоскопія
- •12. Явище осмосу. Осмотичний тиск. Біологічна роль.
- •1. Агрегатні стани речовин. Ідеальні та реальні гази. Основні закони ідеальних газів.
- •3. Закон Шарля
- •4. Закон Авогадро.
- •15.Основні поняття:фаза,компонент,ступінь вільності.Правило фаз Гіббса.Однокомпонентні системи.
- •22.Дисперсні системи, основні поняття.Класифікація дисперсних с-м.
- •24.Коагуляція колоїдних розчинів електролітами. Поріг коагуляції. Правило Панета-Фаянса. Механізми коагуляції.
- •25. Молекулярно-кінетичні та оптичні властивості дс.
- •18. Гальванічні елементи
- •16. Застосування правила фаз Гіббса. Двокомпонентні системи. Діаграми стану двокомпонентних систем.
- •20.Каталітичні процеси. Явище каталізу .Види каталізу. Промотори та інгібітори. Їх застосування в промислових процесах.
- •12.Робота різних процесів для одного моля ідеального газу.
- •7.Ентропія.М-ди розрахунку ентропії для різних процесів.Абсолютне значення ентропії.Постулат Планка.
8.Закон Рауля та відхилення від нього.
А) Нехай у першій посудині міститься чистий рідкий розчинник.
P![]() пара
Н2О
рід. Н2О
пара
Н2О
рід. Н2О
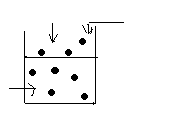
Р0А – тиск насиченої пари чистого розчинника на власну поверхню рідкої фази.
Б) Чиста розчинена речовина
Р![]() пара розчин. Речов.
пара розчин. Речов.
Рідка фаза розч.
Реч.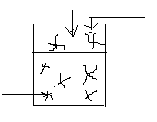
РВ° - тиск насиченої пари розчиненої речовини на власну поверхню рідини
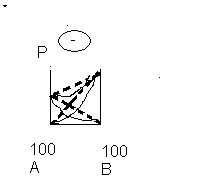
В) Розчин
. РА розчин А+В
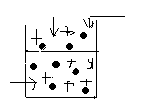
РА – тиск насиченої пари чистого розчинника на поверхню розчину .
РВ – тиск насиченої пари розчиненої речовини над розчином.
1-й закон Рауля
Тиск насиченої пари даного компоненту над розчином буде прямо пропорційним його мольній частці в розчині.
РА = Р А 0 * nA
РВ = Р0В * nВ
Р А 0 − РА – зниження тиску насиченої пари розчинника над розчином.
Р А 0 − РА ⁄ Р А 0 - знижен ня тиску відносне насиченої пари розчинника над розчином.
2 – й закон Рауля
Відносне зниження тиску насиченої пари компонента над розчином буде = мольній частці другого компонента в розчині.
Р А 0 − РА ⁄ Р А 0 = nВ
Р В 0 − РВ ⁄ Р В 0 = nA
Відхилення від з-ну Рауля.
Вони спостерігаються для реальних розчинів.
А) Р сумарне( експерем)> Р сумарне (теоретичне).
Це явище назив. Позитивнее відхилення від з-ну Р.
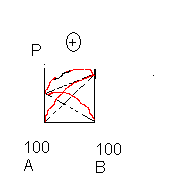
Сюди належеть системи: спирти-вуглеводи
Властивості:
Змолекулярно- кінетичної точки зору сили міжмолекулярної взаємодії між неодноріднимимолекулами будуть менші ніж сили взаємодії між однорідними молекулами.
∆V>0; V суміші> VА + VВ
Qp<0; (Qv=0) – в термохімії
Процес утворення розчинів є ендотермічним(затрата тепла ззовні).
Висновок: Оскільки сили притягання між різнорідними молекулами послаблюються в розчині, то в наслідок процесу випаровування в пароподібну фазу переходить більша кількість молекул, так як розрив у рідкій фазі полегшується. Тому тиск насиченої пари над даним реальним розчином буде більшим ніж над ідеальним розчином.
Б) Негативне відхилення.
Н: система ацетон-хлороформ.
Властивості:
Змолекулярно- кінетичної точки зору сили міжмолекулярної взаємодії між різнорідними молекулами будуть більші ніж сили взаємодії між однорідними молекулами.
Утворення таких розчинів супроводжується зменшенням об’єму розчину:
∆V<0; V суміші<VА + VВ
Утворення таких розчинів супроводжується екзотермічним ефектом: Qp>0; (Qv>0).
Ф.Х.
9. Закони коновалова. Розділення сумішей шляхом перегонки.
Досліджуючи склад рідкої і пароподібної фаз у момент рівноваги, Коновалов встановив, що вони відрізняються між собою.
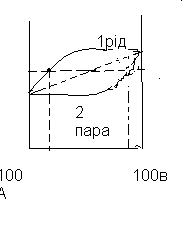
1 – буде відповідати залежності тиску насиченої пари, від складу розчину.
2 – залежність ТНП від складу рідини.
1- й закон Коновалова
Насичена пара бінарної суміші завжди буде збагачена, тим компонентом, додавання якого до рідкої фази буде збільшувати тиск насиченої пари, або знижувати температуру кипіння розчину.
Насичена пара бінарної суміші завжди буде збагачена більш летким компонентом.
Залежність температури кипіння від складу.
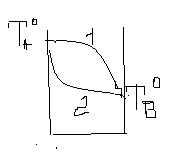
1 –пара 2 –рідина
2 –й закон Коновалова стосується розчинів, які характеризуються відхиленням від з-ну Рауля.
- При додатному відхиленні від з-ну Рауля.
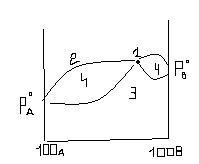
1 – max
2 – рідина; 3 – пара; 4 –пара + рідина;
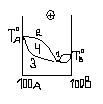
1 – min
2 –пара; 3 – рідина; 4 – пара + рідина;
- При негативному відхиленні від закону Рауля.
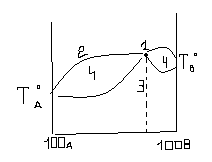
1 – max
2 –пара; 3 – рідина; 4 – пара + рідина
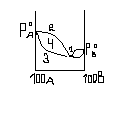
1 - min 2 – рідина; 3 – пара; 4 –пара + рідина
2 – й закон Коновалова
В точках екстремуму[ (max та min) залежностей тиску нас. пари, та (max та min) залежностей температури кипіння від складу] склад пари і рідкої фази є однаковим.
Суміші які відповідають екстрим. точкам назив. азеотропними. Це означає, що жодним фізико – хімічним методом, в тому числі і шляхом перегонки, неможливо розділити компоненти між собою. Н: 20,2% НСІ 68% Н NО3
Розділення сумішей шляхом перегонки.
Явище різного складу пароподібної та рідкої фаз лежить в основі теорії перегонки.
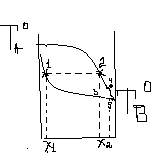
Рідина зникає тоді, коли тиск її насиченої пари буде = зовнішньому атмосферному тиску.
Нагріваючи рідкий розчин вмістом Х1 (1), ми перетворюємо його у пароподібну фазу в наслідок кипіння до т. (2), сконденсувавши її до т. (3) ми одержуємо рідку фазу збагачену більш летким компонентом Х2 . Почергово здійснюючи багаторазово процеси випаровування та конденсації в кінцевому результаті ми отримуємо леткий компонент В а у вихідній колбі важко леткий компонент А.
Ф.Х.
