
- •6.Другий закон термодинаміки. Доведення його за допомогою циклу Карно. Ккд
- •4.Теплота і робота. Перший закон термодинаміки та висновки з нього.
- •19. Швидкість хімічної реакції .Рівняння Арреніуса.
- •5.Закон Гесса та висновки з нього.
- •8.Закон Рауля та відхилення від нього.
- •9. Закони коновалова. Розділення сумішей шляхом перегонки.
- •10. Ебуліоскопія
- •11. Кріоскопія
- •12. Явище осмосу. Осмотичний тиск. Біологічна роль.
- •1. Агрегатні стани речовин. Ідеальні та реальні гази. Основні закони ідеальних газів.
- •3. Закон Шарля
- •4. Закон Авогадро.
- •15.Основні поняття:фаза,компонент,ступінь вільності.Правило фаз Гіббса.Однокомпонентні системи.
- •22.Дисперсні системи, основні поняття.Класифікація дисперсних с-м.
- •24.Коагуляція колоїдних розчинів електролітами. Поріг коагуляції. Правило Панета-Фаянса. Механізми коагуляції.
- •25. Молекулярно-кінетичні та оптичні властивості дс.
- •18. Гальванічні елементи
- •16. Застосування правила фаз Гіббса. Двокомпонентні системи. Діаграми стану двокомпонентних систем.
- •20.Каталітичні процеси. Явище каталізу .Види каталізу. Промотори та інгібітори. Їх застосування в промислових процесах.
- •12.Робота різних процесів для одного моля ідеального газу.
- •7.Ентропія.М-ди розрахунку ентропії для різних процесів.Абсолютне значення ентропії.Постулат Планка.
10. Ебуліоскопія
Рідина закипає тоді коли тиск її насиченої пари = зовнішньому атмосферному тиску.
Залежність тиску насиченої пари від температури має вигл.
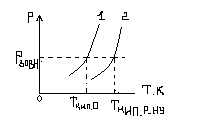
1 – залежність тиску насиченої пари чистого розчинника від температури.
2 – зал. Тиску насиченої пари над розчином від температури.
Т кипіння р-ну − Т кип. 0 = ∆ Т кип. – підвищення темп.кип. р-ну.
∆ Т кип залежить від:
Від концентрації розчину – прямо пропорційно.
Від природи розчинника.
Не залежить від природи розчиненої речовини.
Така властивість величина якої не залежить від природи розчиненої речовини, а залежить від кількості її частинок називається колігативною.( ∆ Т кип., ∆ Тзамерзання, зниження тиску насиченої пари над розчином, осмотичний тиск розчинів).
Щоб порівняти вплив природи розчинника на температуру кипіння розчину вводять поняття ебуліоскопічної сталої Е.
Ебуліоскопічна стала Е. – це величина, яка показує на скільки підвищується Т кип. Чистого розчинника, якщо в 1000г його розчинити 1 моль будь – якого неелектроліту
Для теоретичного розрахунку величини підвищення Т кип. Вант – Гоф вивів форм. ∆ Т кип = RT02 кип/1000L *m
m – моляльність розчину
RT0 кип – температура кипіння чистого розчинника
L – питома прихована теплота випаровування.
L = λ ⁄ m
λ –мольна прихована теплота випар.
Якщо m = 1, то ∆ Т кип = RT02 кип/1000L = Е – фізичн. Зміст ебуліоскопічної сталої, тобто це є таке підвищення
Т кип р-ну коли моляльність = 1.
∆ Т кип = Е * m
Група методів дослідження фізико - хімічних властивостей на основі вимірювання Т кип. Розчину назив. Ебуліоскопією( ебуліо від лат – кипить)
М = 1000 * g * Е / G * ∆Ткип
- ф-ла для знах молекулярної маси розчиненої речовини.
і = 1 + α ( ν – 1 ) – ф-ла для теоретичного розрахунку вел. Ізотонічного коеф.
α – ступінь дисоціації електроліту.
( ν – сумарна кількість іонів, що утворюються в результаті дисоціації однієї молекули електроліту.
∆ Т кип (експерем ) >∆ Т кип( теоретик)
∆ Т кип (експерем ) ⁄ ∆ Т кип( теоретик) = і
Для розчинів сильних електролітів використовуються фсі попередні ф-ли із врахуванням ізотонічного коефіцієнту.
- ∆ Т кип = RT02 кип/1000L *m * і
∆ Т кип = Е * m * і
Величину ебуліоскопічної сталої беруть із довідника.
- М = 1000 * g * Е / G * ∆Ткип} * і
Ф.Х.
11. Кріоскопія
«Кріо» - замерзання
Рідина замерзає тоді коли тиск її насиченої пари = тиску насиченої пари над утвореною твердою фазою.
Залежність тиску насиченої пари від температури має вигл.
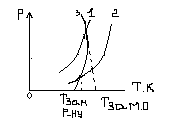 1
– залежність тиску насиченої пари над
рідким розчинником.
1
– залежність тиску насиченої пари над
рідким розчинником.
2 – зал. Тиску насиченої пари над рідким розчином
3 – зал. Тиску насиченої пари над твердою фазою.
Отже розчини замерзають при нижчих температурах ніж чистий розчинник.
Т замер 0. − Т замер р-ну = ∆ Т замерзання – зниження темп.замерзання. р-ну.
∆ Т замер. залежить від:
А)Від концентрації розчину – прямопропорційно.
В)Від природи розчинника.
Б)Не залежить від природи розчиненої речовини.
Щоб порівняти вплив природи розчинника на температуру замерзання розчину вводять поняття кріоскопічної сталої К.
Кріоскопічна стала К. – це величина, яка показує на скільки знижується Т зам.. чистого розчинника, якщо в 1000г його розчинити 1 моль будь – якого неелектроліту
Для теоретичного розрахунку величини Т зам. Вант – Гоф вивів форм. ∆ Т зам = RT02 зам/1000L *m - фізичний зміст кріоскопічної сталої
m – моляльність розчину
RT0 кип – температура кипіння чистого розчинника
L – питома прихована теплота випаровування.
L = λ ⁄ m
λ –мольна прихована теплота пл..
Якщо m = 1, то ∆ Т кип = RT02 кип/1000L = К.
∆ Т зам = Е * m
Група методів дослідження фізико - хімічних властивостей на основі вимірювання Т зам. Розчину назив. Кріоскопією
М = 1000 * g * К / G * ∆Тзам
- ф-ла для знах молекулярної маси розчиненої речовини.
і = 1 + α ( ν – 1 ) – ф-ла для теоретичного розрахунку вел. Ізотонічного коеф.
α – ступінь дисоціації електроліту.
( ν – сумарна кількість іонів, що утворюються в результаті дисоціації однієї молекули електроліту.
∆ Т зам(експерем ) >∆ Т зам( теоретик)
∆ Т зам (експерем ) ⁄ ∆ Т зам( теоретик) = і
Для розчинів сильних електролітів використовуються фсі попередні ф-ли із врахуванням ізотонічного коефіцієнту.
- ∆ Т зам = RT02 кип/1000L *m * і
∆ Т зам = Е * m * і
Величину ебуліоскопічної сталої беруть із довідника.
- М = 1000 * g * Е / G * ∆ Т зам} * і
Кріоскопічні методи характеризуються більшою точністю вимірювань і тому викор. частіше.
Ф.Х.
