
- •Квантовая механика, состояние микрочастицы
- •2. Операторы
- •3. Измерения. Соотношения неопределенности
- •4. Собственные значения и собственные функции операторов
- •5. Уравнение шредингера. Изменение состояния со временем
- •6. Вырождение
- •7. Матричная форма уравнений
- •8. Атом водорода
- •9. Теория возмущений
- •10. Квантовая химия. Общие понятия
- •11. Метод хартри
- •12. Метод хартри-фока
- •13. Приближение хюккеля
- •14. Метод мо лкбф. Метод рутана
- •15. Теория двухъядерных молекул
- •17. Гибридизация атомных орбиталей
- •18. Индексы реакционной способности
- •300. Определите в -электронном приближении заряд на атоме, порядок связи, индекс свободной валентности. Как эти ирс используются в теории реакционной способности ?
- •19. Строение вещества. Общие вопросы.
- •20. Эквивалентность одинаковых частиц
- •21. Геометрические свойства молекул
- •Возможные распределения электронов и ядер в трёхъядерных,
- •22. Электрические свойства молекул. Дипольный момент. Поляризуемость
- •Таким образом поляризуемость атома действительно пропорциональна объёму атома.
- •23. Электронные, колебательные и вращательные состояния молекул и спектры
22. Электрические свойства молекул. Дипольный момент. Поляризуемость
355. Для чего химия изучает и измеряет дипольные моменты моле-
кул? Назовите основные области применения дипольных моментов в химии.
356. Почему дипольный момент имеет смысл только для нейтральной
системы зарядов?
357. Покажите, что дипольный момент молекулы инвариантен относи-
тельно выбора начала системы координат.
358. Покажите, что дипольный момент молекулы инвариантен относи-
тельно поворотов системы координат.
359. Согласно векторной модели Томсона дипольный момент молекулы
определяется следующим выражением:
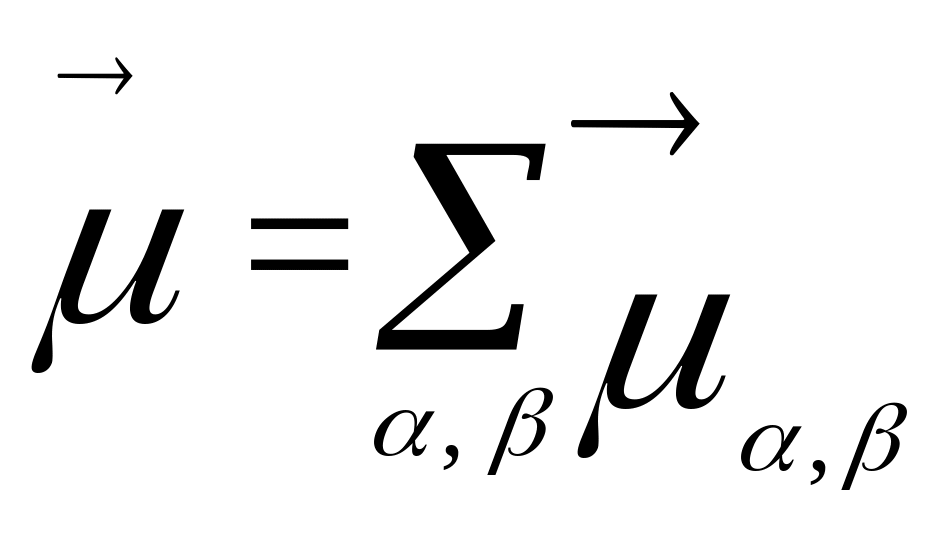 ,
,
где индексы α и β нумеруют атомы молекулы, образующие химические
связи,
а
![]() -
векторы дипольных моментов соответствующих
связей.
-
векторы дипольных моментов соответствующих
связей.
Почему, строго говоря, векторная модель Томсона некорректна? В каких
случаях можно ожидать, что расчёты дипольных моментов молекул с
использованием этой модели будут приводить к результатам, близким к
экспериментальным.
360. Получите выражение для среднего значения дипольного момента
молекулы по методу МО ЛКАО в приближении нулевого дифференци-
ального перекрывания АО.
Решение: Оператор дипольного момента молекулы запишем в виде:
 ,
(360.1)
,
(360.1)
где индекс α нумерует ядра, индекс ν – электроны. Заряд протона e=1.
Волновую функцию выберем в виде детерминанта Слэтера основного
состояния молекулы, и, учтя, что в каждом столбце этого детерми-
нанта стоят спин-орбитали электрона, соответствующего номеру
столбца, разложим детерминант по элементам первого столбца:
![]() (360.2)
(360.2)
Подставив (1) и (2) в выражение для среднего значения дипольного мо- мента, учтя ортонормированность детерминантов Слэтера и независимость среднего значения оператора дипольного момента от номера
электрона, получим:
![]() ,
(360.3)
,
(360.3)
где в последнем интеграле подразумевается интегрирование по всем
объёмам электронов с номерами 2,3,…,N и всем проекциям спинов, кро-
ме dσz1. Учитывая ортонормированность спин-орбиталей и спиновых
функций, переходя к молекулярным орбиталям ψk(1), и замечая, что по-
следний интеграл в правой части (3) равен (N-1)!, получаем
![]() (360.4)
(360.4)
Представляя молекулярные орбитали в виде ЛКАО,
![]()
и подставляя их в (4), после преобразований с учётом принципа НДП,
получаем:
 ,
(360.5)
,
(360.5)
где Qαост –остаточный электронный заряд атома с номером α, а qα –
полный электронный заряд того же атома.
361. У молекулы PCl5 дипольный момент равен нулю, а у молекулы
BrF5 дипольный момент μ = 1,51 D. Дайте объяснение этим фактам,
представив геометрические структуры каждой из молекул. Объясните,
почему изучение изотопного обмена показывает, что три из атомов Сl
в PCl5 хорошо обмениваются с изотопами Cl*, а два – хуже.
362. Какой из трёх изомеров ди-хлорбензола синтезирован, если ди-
польный момент хлорбензола и полученного изомера известен?
363. Установите расположение NO2-группы и атома Cl в молекуле
Cl,NO2-бензола, зная что дипольный момент молекулы μ=3,41 D, а дипольные моменты полярных связей таковы: μCар-Cl=1,59D; μCар-NO2=4,01D.
У хинолина дипольный момент μ=2,15D. У 5-Cl-хинолина
μ=0,64D. У какого Cl-хинолина дипольный момент равен μ= 3,55D?
Дипольный момент азулена μ= 1D. В каком положении азулена
находится Cl, если дипольный момент Cl-азулена μ=2,69D? μС-Сl=1,6D.
Почему у молекулы п-дихлорбензола μ = 0, а у п-гидрохинона
μ= 5,48*10-30Кл*м ?
Может ли молекула, состоящая из одинаковых атомов быть по-
лярной?
Может ли молекула, состоящая из двух разных атомов быть не-
полярной ?
369.
В какой
последовательности изменяются дипольные
моменты галогеноводородов
HF![]() HCl
HBr
HJ
?
HCl
HBr
HJ
?
Решение: Рассмотрим особенности химической связи в молекулах галогеноводородов. На рис.2 изображена диаграмма энергетических уровней молекулярных орбиталей молекул HF и HC.
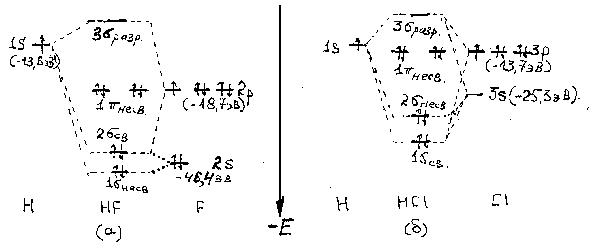
Рис.2.Схема молекулярных орбиталей HF (a), HCl (б). Ось z проходит через центры атомов водорода и галогена.
Распределение электронной плотности может быть рассчитано или определено экспериментально и представлено в виде сечения молекулы HF некоторой плоскостью (рис.3). Точки с одинаковой электронной плотностью представлены линиями. Распределение электронной плотности не симметрично. Большая электронная плотность сосредоточена вблизи ядра фтора. Тем не менее, часть электронной плотности распределена между атомами фтора и водорода, и это соответствует ковалентной связи. Распределение электронной плотности может быть рассчитано или определено экспериментально и представлено в виде сечения молекулы HF некоторой

Рис.3. Контурная диаграмма распределения электронной плотности в молекуле HF.
2px
- и
2py
-орбитали
атома фтора по условиям симметрии
способны участвовать в образовании
![]() -связей,
но у атома водорода доступных по энергии
р-орбиталей
нет. Поэтому 1
-орбитали
(рис.4а) остаются несвязывающими. Два из
восьми электронов (один от атома водорода,
семь от атома фтора) размещаются на 1
-связей,
но у атома водорода доступных по энергии
р-орбиталей
нет. Поэтому 1
-орбитали
(рис.4а) остаются несвязывающими. Два из
восьми электронов (один от атома водорода,
семь от атома фтора) размещаются на 1![]() св-орбитали
и обуславливают связь между атомами
водорода и фтора. Оставшиеся шесть
электронов занимают 2
несв-
и 1
несв-орбитали.
Они ослабляют связь водорода со фтором,
так как принимают участие в межэлектронном
отталкивании. Таким образом, электронная
конфигурация молекулы НF
запишется в виде
св-орбитали
и обуславливают связь между атомами
водорода и фтора. Оставшиеся шесть
электронов занимают 2
несв-
и 1
несв-орбитали.
Они ослабляют связь водорода со фтором,
так как принимают участие в межэлектронном
отталкивании. Таким образом, электронная
конфигурация молекулы НF
запишется в виде
![]() .
.
Диаграмма молекулярных орбиталей при переходе от HF к HCl несколько изменяется, что связано с изменением энергии и размеров атомных орбиталей галогена. Энергии 3s- и 3р-орбиталей атома хлора увеличиваются и приближаются (особенно энергия 3р-орбиталей) к энергии 1s-орбитали атома водорода. Уменьшается и разность энергий 3s- и 3р-орбиталей. Все это приводит к тому, что в образовании молекулярных орбиталей HCl участвуют как 1s-орбитали водорода, так и обе 3s- и 3р-орбитали атома хлора. Взаимодействие (перекрывание) 1s-, 3s- и 3р-атомных орбиталей приводит к образованию 1 связ-, 2 несв- и 3 разр-молекулярных орбиталей, причем 2 несв-орбиталь по энергии оказывается близкой к энергии 3s-орбитали хлора и носит, в основном, несвязывающий характер. Как и в молекуле HF, 1 -орбиталь остается несвязывающей. Участие 1s-орбитали атома водорода в образовании 1 связ-орбитали уменьшает смещение электронной плотности к атому хлора и тем самым понижает полярность молекулы HCl по сравнению с HF.
В целом, по мере увеличения энергии ns- и np-орбиталей, уменьшения их разности, а также увеличения размера атома галогена в ряду HF-HCl-HBr-HI энергия молекулярных орбиталей увеличивается, а локализация электронов на орбиталях атома галогена и полярность молекул HХ уменьшаются.
Молекулы HХ полярны. Полярность количественно характеризуется величиной дипольного момента. С точки зрения МО ЛКАО полярность определяется различием энергий взаимодействующих 1s-атомной орбитали водорода и ns-, np-орбиталей атома галогена. Как отмечалось, в ряду F-Cl-Br-I эта разница, а также степень локализации электронов на атомах галогена и полярность молекул НХ уменьшаются. Поэтому дипольные моменты убывают в ряду HF-HI. См.таблицу
Таблица . Свойства галогеноводородов
Молекула |
Модель |
Межатомное
расстояние
rе
( |
Есвязи кДж/моль |
|
Дипольный момент, D |
Тпл,оС |
HF |
|
0.92 |
565 |
-271 |
1.91 |
-83.4 |
HCl |
|
1.28 |
431 |
-92 |
1.03 |
-114.3 |
HBr |
|
1.41 |
364 |
-36 |
0.79 |
-86.9 |
HI |
|
1.60 |
297 |
+27 |
0.42 |
-50.9 |
370. Почему внешнее электрическое поле индуцирует в молекуле ди-
польный момент, направление которого не обязательно лежит вдоль направления этого поля?
Какие свойства молекул, важные для химии, зависят от
поляризуемости?
ПОЛЯРИЗУЕМОСТЬ играет определяющую роль в оптический активности и некоторых др. оптический свойствах веществ. Она является основные понятием в теории дальнодействующих сил притяжения (дисперсионных и индукционных) между нейтральными атомами и молекулами (см. Дисперсионное взаимодействие).
ПОЛЯРИЗУЕМОСТЬ определяет величины дипольных моментов, индуцируемых на связях внутримол. электрич. полями, которые создаются совокупностью зарядов молекулы. Во многие случаях влияние заместителей на химический и физических свойства молекул также обусловлены прежде всего ПОЛЯРИЗУЕМОСТЬ В частности, вклад Е в изменение энергии молекулы при введении заместителя определяется взаимодействие заряда или дипольного момента, связанного с реакционное центром, с дипольным моментом, индуцируемым заместителем (см. Индуктивный эффект). Наиб. существенны эти вклады для малополярных углеводородных заместителей. Так, поляризационное взаимодействие обеспечивает более 80% изменения рКа при переходе от уксусной кислоты к пропионовой. Проявление эффектов, связанных с ПОЛЯРИЗУЕМОСТЬ заместителей, особенно алкильных радикалов, отмечено в закономерностях изменения констант скорости и констант равновесия химический реакций, физических свойств веществ.
Литература; Верещагин А. Н., Поляризуемость молекул, М., 1980

Из книги Реутов, Курт, Бутин Органич Химия с.74, 1999, ч.1 Изд.МГУ
372. Найдите размерность поляризуемости молекулы. Объясните, по-
чему
поляризуемость атомов или молекул
зависит от их размеров? Используя
волновую функцию атома водорода в
1s-состоянии
(см. задачу 266), покажите, что в слабом
внешнем электрическом поле
![]() поляризуемость атома водорода
определяется формулой α=3πa03,
где a0-радиус
поляризуемость атома водорода
определяется формулой α=3πa03,
где a0-радиус
первой боровской орбиты .
Решение: Под действием внешнего поля в атоме водорода возникает дипольный момент
μ=ed, (1)
где
d-
расстояние между центром симметрии
электронного облака и ядром. В состоянии
равновесия напряжённости внешнего поля
и поля
![]() ,
создаваемого между деформированным
электронным облаком и ядром, равны.
,
создаваемого между деформированным
электронным облаком и ядром, равны.
= . (2)
Напряжённость определяем с помощью теоремы Остроградского-Гаусса:
 .
(3)
.
(3)
Выбрав в качестве замкнутой поверхности сферу радиусом d с центром на ядре, преобразуем (3) к виду
4πd2Eвн
=![]() . (4)
. (4)
Из (4) находим Евн :
Eвн
=
![]() .
.
С помощью (2) и (1) находим дипольный момент:
μ=
![]() .
.
Отсюда
α = 3πa03 .



