
- •Содержание
- •Введение
- •Диссоциация электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Ионное произведение воды
- •Расчет рН сильных кислот и оснований
- •Расчет рН слабых бинарных кислот и оснований
- •Влияние сильных электролитов и одноименных ионов на ионные равновесия в слабых электролитах
- •Буферные растворы
- •Гидролиз солей
- •Вопросы и задачи для самостоятельного решения
- •Тест для самоконтроля «Ионные равновесия в гомогенных системах»
- •Равновесия в гетерогенных системах
- •Произведение растворимости
- •Задачи на применение условия выпадения осадка
- •Расчет растворимости осадков в присутствии одноименных ионов
- •Расчет растворимости осадка в присутствии разноименных ионов (солевой эффект)
- •Дробное осаждение
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное равновесие
- •Расчет констант равновесия окислительно-восстановительных реакций
- •Расчет окислительно-восстановительного потенциала
- •Вопросы и задачи для самостоятельного решения
- •Равновесия в растворах комплексных соединений
- •Вопросы и задачи для самостоятельного решения
- •Тест для самоконтроля «Ионные равновесия в реакциях осаждения, комплексообразования и окисления-восстановления»
- •Качественный анализ
- •Вопросы и задачи для самостоятельной работы
- •Гравиметрический анализ
- •Расчет количества осадителя
- •Рассчитаем массу 4 %-ного раствора Na2hpo4:
- •Расчет потерь осадка при промывании
- •Выбор оптимального интервала значений рН
- •Расчёт результатов гравиметрического определения
- •0,0623 Г Ag содержится в 125 мл раствора;
- •Вопросы и задачи для самостоятельного решения
- •Титриметрические методы анализа
- •Способы выражения концентраций растворов
- •Определение фактора эквивалентности
- •Пример 2. Какой объем 0,1 н. Раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. Раствора?
- •Способы титрования
- •Кислотно-основное титрование
- •Выбор индикатора
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное титрование
- •Оксидиметрические индикаторы
- •Вопросы и задачи для самостоятельного решения
- •Комплексонометрическое титрование
- •Выбор индикатора и условий проведения анализа
- •Вопросы и задачи для самостоятельного решения
- •Примеры построения кривых титрования
- •Титрование сильных кислот и оснований
- •Титрование слабой кислоты сильным основанием
- •0,40 Моль/л раствором koh.
- •Вопросы и задачи для самостоятельного решения
- •Окислительно-восстановительное титрование
- •Вопросы и задачи для самостоятельного решения
- •Физико-химические методы анализа
- •Потенциометрия и потенциометрическое титрование.
- •Вольтамперометрия
- •Кулонометрия.
- •Вопросы и задачи для самостоятельного решения
- •Спектроскопические методы анализа
- •Фотометрические методы анализа.
- •Вопросы и задачи для самостоятельного решения
- •Атомно-абсорбционная спектроскопия
- •Вопросы и задачи для самостоятельного решения
- •Эмиссионный спектральный анализ
- •Вопросы и задачи для самостоятельного решения
- •Люминесцентный анализ
- •Вопросы и задачи для самостоятельного решения
- •Хроматографические методы анализа
- •Ионообменная хроматография.
- •100,0 ∙ 0,09567 Ммоль NaOh.
- •17,80 ∙ 0,09051 Ммоль щелочи,
- •Газовая хроматография.
- •Вопросы и задачи для самостоятельного решения
- •Метрологические характеристики методов анализа
- •Вопросы и задачи для самостоятельного решения
- •Справочные материалы
- •Коэффициенты активности ионов
- •Коэффициенты активности при высоких значениях ионной силы
- •Относительные атомные массы элементов
- •Растворимость неорганических и некоторых органических соединений в воде
- •Плотности водных растворов некоторых веществ при 20оС
- •Произведения растворимости важнейших малорастворимых веществ
- •Значения рН осаждения гидроксидов металлов
- •Гравиметрические факторы
- •Константы ионизации кислот
- •Константы ионизации оснований
- •Интервал рН перехода важнейших индикаторов
- •Некоторые смешанные индикаторы
- •Стандартные электродные потенциалы (е°) при 25°с
- •Окислительно-восстановительные индикаторы
- •Логарифмы суммарных констант устойчивости комплексных соединений
- •Логарифмы констант устойчивости комплексонатов металлов
- •Литература
Окислительно-восстановительное равновесие
Реакции окисления-восстановления используют в аналитической химии для обнаружения ионов, их разделения, растворения металлов, сплавов, малорастворимых соединений, для количественного определения веществ. Расчет равновесий в реакциях окисления-восстановления позволяет выбрать нужный реактив и условия его применения в анализе.
Для обратимой окислительно-восстановительной полуреакции
Ox + nē Red
зависимость окислительно-восстановительного потенциала Е от активностей окисленной (Ох) и восстановленной (Red) форм выражается уравнением Нернста:
![]() ,
,
где
![]() –
стандартный окислительно-восстановительный
потенциал. При 25оС
уравнение имеет следующий вид:
–
стандартный окислительно-восстановительный
потенциал. При 25оС
уравнение имеет следующий вид:
![]() .
.
Если в окислительно-восстановительной полуреакции участвуют ионы водорода или OH–, то в уравнение Нернста входят их концентрации в соответствующей степени:
![]() ,
,
или
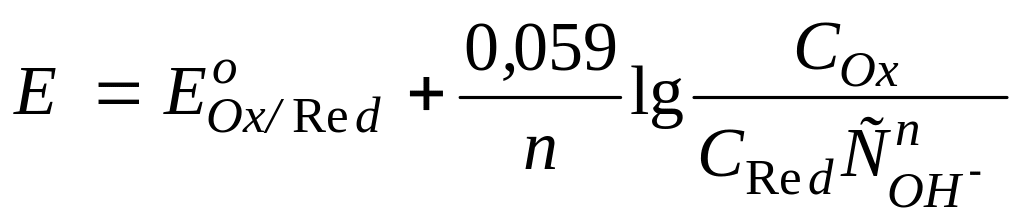 .
.
Окислительно-восстановительная реакция является сочетанием двух полуреакций. Глубина протекания реакции определяется константой равновесия, которая может быть рассчитана по формуле
![]() .
.
Где n – число электронов, участвующих в реакции окисления – восстановления.
Расчет констант равновесия окислительно-восстановительных реакций
Пример1. Вычислить константу равновесия окислительно-восстановительной реакции MnO4– + SO32– + H+ = Mn2+ + SO42– + H2O
и сделать вывод о ее направлении.
Решение.
Запишем уравнения полуреакций:
2 5 |
SO32– + H2O – 2ē = SO42– + 2H+
Запишем суммарное уравнение:
2 MnO4– + 5 SO32– + 16H+ = 2Mn2+ +5SO42– + 8H2O
Находим
по таблице стандартные
окислительно–восстановительные
потенциалы:
![]() =
+1,51 В,
=
+1,51 В,
![]() =
+ 0,17 В.
=
+ 0,17 В.
Число электронов, участвующих в реакции, n = 2 ∙ 5 =10.
Рассчитаем константу равновесия:
lg K = ΔE◦ ∙ n/0,059 = (1,51 – 0,17) ∙ 10 / 0,059 = 231,0,
K = 10231>> 1.
Следовательно, реакция будет протекать в прямом направлении.
Расчет окислительно-восстановительного потенциала
Пример 2. Вычислить окислительно-восстановительный потенциал, если к 15,0 мл 0,20 М раствора KMnO4 добавили 50,0 мл 0,10 М раствора Na2SO3 при рН = 1.
Решение. При смешении растворов протекает реакция
MnO4– + SO32– + H+ = Mn2+ + SO42– + H2O
MnO4– + 8H+ + 5ē = Mn2+ + 4H2O
SO32– + H2O – 2ē = SO42– + 2H+
Потенциал раствора после смешения будет определяться веществом, которое находится в избытке. Рассчитаем количество вещества (моль-экв) в обоих растворах:
n(1/5KMnO4) = 15,0 ∙ 10–3∙ 0,20 ∙ 5= 15,0 ∙ 10–3 моль-экв;
n(1/2Na2SO3) = 50,0 ∙ 10–3 ∙ 0,10 ∙ 2 = 10,0 ∙ 10–3 моль-экв.
В избытке находится KMnO4. После протекания реакции в растворе будет содержаться
n(1/5 MnO4–) = 15,0 ∙ 10–3 – 10,0 ∙ 10–3 = 5,0 ∙ 10–3моль-экв,
следовательно n(MnO4–) = 1,0 ∙ 10–3 моль;
n(1/5 Mn2+) = 10,0 ∙ 10–3 моль-экв,
следовательно n(Mn2+) =2,0 ∙ 10–3моль.
Объем раствора после смешения составит 15,0 + 50,0 = 65,0 мл = 65 ∙ 10–3 л.
Рассчитаем концентрации ионов:
С(MnO4–) =1,0 ∙ 10–3/65 ∙ 10–3 = 0,0154 моль/л;
С(Mn2+) =2,0 ∙ 10–3/65 ∙ 10–3 = 0,0308 моль/л;
C(H+) = 10–pH = 10–1 = 0,1 моль/л.
Рассчитаем окислительно–восстановительный потенциал раствора:
E
=![]() +
0,059/5 ∙ lg
(
+
0,059/5 ∙ lg
(![]() )
=
)
=![]()
= 1,51 + 0,059/5 ∙ lg(0,0154 ∙ (0,1)8/ 0,0308) = 1,49 В.
