
- •Определение отношения методом звуковых стоячих волн
- •Краткие сведения из теории
- •Описание экспериментальной установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Определение отношения теплоемкости газа при постоянном давлении к его теплоемкости при постоянном объеме по адиабатному расширению газа
- •Краткие сведения из теории
- •Описание экспериментальной установки и вывод рабочей формулы
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы и задания
- •Определение отношения молярных теплоемкостей газа
- •Краткие сведения из теории
- •Описание экспериментальной установки и вывод рабочей формулы
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы и задания
- •Определение коэффициента вязкости жидкости
- •Краткие сведения из теории
- •Порядок выполнения работы
- •Определение размеров шариков
- •Определение установившейся скорости движения и коэффициента вязкости
- •Обработка результатов измерения
- •Контрольные вопросы и задания
- •Определение теплопроводности воздуха
- •Описание экспериментальной установки и метода изучения процесса
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Определение коэффициента взаимной диффузии воздуха и водяного пара
- •Описание установки и метода изучения процесса
- •Описание экспериментальной установки
- •Конкретные задания
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Определение коэффициента вязкости воздуха капиллярным методом
- •Краткие сведения из теории
- •Описание экспериментальной установки
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы и задания
- •Определение молекулярной газовой постоянной методом откачки
- •Краткие сведения из теории
- •Описание установки и метода изучения процесса
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Приложение
- •Литература
- •Механика и молекулярная физика
- •190005, Санкт-Петербург, 1-я Красноармейская ул., д. 1
Описание экспериментальной установки и вывод рабочей формулы
Для определения величины γ = Cp/CV в работе применяется метод Клемана и Дезорма. Измерительная установка (рис.11.2) состоит из баллона 1 с воздухом, открытого жидкостного манометра 2, ручного нагнетательного насоса 3. Баллон закрыт пробкой 4, сквозь которую проходит трубка 5 с двумя отводами. Один отвод соединяет баллон с манометром, другой - через кран 6 с насосом. Трубка 5 закрыта пробкой 7.
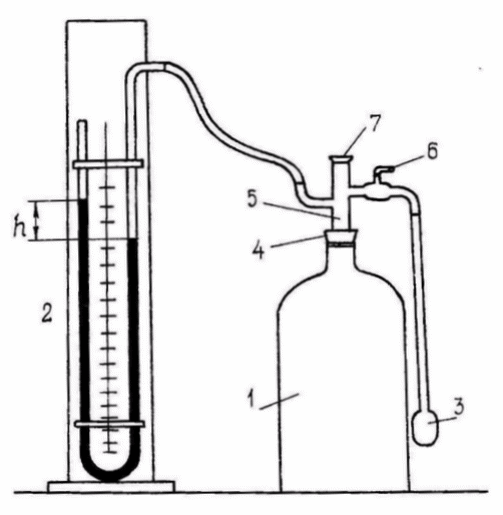
Рис. 11.2.
Метод измерения заключается в следующем. В сосуд, закрытый пробкой, но при открытом кране нагнетается насосом некоторое количество воздуха. Вследствие этого давление в сосуде повышается до величины p1, а избыток его над атмосферным измеряется с помощью манометра. Воздух в сосуде примет температуру окружающей среды (комнатную) Т1. Далее, на короткое время открываем сосуд путём извлечения пробки. Практически сразу давление в сосуде станет равным атмосферному p2, так как отверстие, соединяющее баллон с атмосферой, имеет большой размер. Процесс происходит быстро, воздух имеет малую теплопроводность, поэтому процесс расширения можно считать адиабатным. Температура газа Т2 оказывается несколько ниже комнатной температуры Т1, так как работа расширения при адиабатном процессе совершается за счёт внутренней энергии газа.
Адиабатический переход газа из первого состояния во второе подчинён уравнению
(P1/P2)γ-1=(T1/T2)γ. (11.11)
Э
Рис. 11.2
.2
Рис.20.2
Процесс выравнивания температуры при закрытой пробке подчиняется закону Гей – Люссака:
p2/T2 = p3/T3 = p3/T1 или T1/T2 = p3/ p2 . (11.12)
Заменив в формуле (11.11) отношение температур отношением давлений из формулы (11.12), найдём
(p3 /p2)γ = (p1 /p2)γ-1 .
Логарифмируя последнее выражение, находим
γ
=
![]()
![]() (11.13)
(11.13)
Обозначим разность уровней жидкости в манометре в первом состоянии через h1, во втором состоянии – через h2, тогда p1= p2+ρgh1, p3= p2+ρgh2 (ρ – плотность жидкости в манометре).
Подставим эти выражения в (11.13):
![]() (11.14)
(11.14)
В нашем случае давления p1 и p3 мало отличаются от атмосферного давления p2, т.е. ρgh1 << p2, ρgh2 << p2. Разложим логарифмы в ряд, пренебрегая членами второго порядка малости:
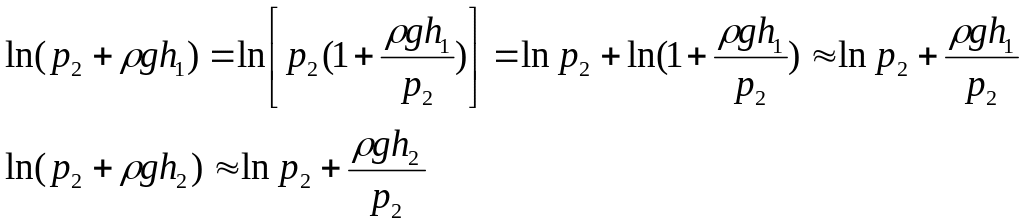
Подставив эти соотношения в формулу (11.14), получим расчётную формулу для нашего опыта
γ = Cp/CV = h1/(h1 –h2). (11.15)
Следует подчеркнуть, что обе величины должны измеряться в состоянии термодинамического равновесия, т.е. после прекращения теплообмена.
