
- •Лекции по физической химии
- •2 Лекция: Законы идеального газа.
- •Энергия. Теплота. Работа.
- •Первый закон термодинамики.
- •Первый принцип термодинамики
- •Теплоёмкость.
- •3 Лекция: Понятие внутренней энергии и энтальпии чистого вещества
- •Термохимия. Энтальпия химических реакций. Закон Гесса
- •Закон Гесса
- •Закон Киркхгоффа
- •Схемы зависимости энтальпий реакций от температуры
- •2Ой Закон термодинамики. Энтропия
- •4 Лекция: 2 закон термодинамики.
- •Постулат Томпсона.
- •Формулировка Оствальда.
- •5 Лекция:
- •Направление процессов открытых многокомпонентных
- •6 Лекция: Фазовое равновесие
- •7 Лекция:
- •8 Лекция:
- •Химическое равновесие
- •Критерий направленности и равновесия в химических реакциях
- •Критерий направленности
- •9 Лекция:
- •10 Лекция: Растворы неэлектролитов. Общие понятия и определения.
- •Межчастичные взаимодействия в растворах.
- •Экспериментальные методы определения парциально – мольных величин.
- •Графический метод.
- •11 Лекция:Основные классы растворов и их термодинамические свойства
- •Совершенные растворы
- •Бесконечно разбавленные растворы
- •Термодинамические свойства бесконечно разбавленного раствора
- •Неидеальные (реальные) растворы
- •Термодинамические условия образования реального раствора
- •1)Равновесие совершенный раствор (пар) Закон Рауля.
- •14 Лекция: Кинетика сложных реакций
Химическое равновесие
Химическое равновесие- это подвижное состояние, когда скорость прямой реакции равна скорости обратной. В этот момент в системе не происходит изменение чисел моль участников реакции, т.е. устанавливается постоянство состава. Состав, который устанавливается при равновесии- равновесный. Он определяется: природой реакции, количеством моль реагентов и продуктов в начальный момент времени и внешними параметрами.
Данный установившийся равновесный состав при данной реакции- это максимальный возможный выход продуктов реакции в данных условиях.
Критерий направленности и равновесия в химических реакциях
По Гиббсу, общим критерием направленности и равновесия произвольных процессов при постоянных температуре и давлении является уравнение
dG=∑μi dni≤0
Применим это уравнение к химической реакции
ν1А1+ ν2А2= ν1’А1’+ ν2’А2’
Данная реакция будет протекать самопроизвольно
Если dG=μA1*dnA1+μA2*dnA2+μA1’*dnA1’+μA2’*dnA2’<0, если =0,то система в равновесии.
nA1◦,nA2◦- число моль реагентов в начальный момент времени.
n'A1◦,n’A2◦-число моль продуктов в начальный момент времени.
nA1,nA2-число моль реагентов в данный момент.
n'A1,n’A2- число моль продуктов в данный момент времени.
(nA1◦- nA1)-количество прореагировавшего реагента.
(n'A1- n'A1◦)- количество образовавшегося продукта.
Степень протекания реакции
ξ=(nA1◦- nA1)/ ν1=(nA2◦- nA)/ ν2=(n'A1- n'A1◦)/ ν1’=(n'A2- n'A2◦)/ ν2’
0≤ξ≤1- реагенты полностью превратились в продукты
Критерий направленности
(ϭG/ϭ ξ)T,P=∑μi’ νi’-∑μi νi≤0
d ξ≥0
∑μi νi>∑μi’ νi’
Т.е. реакция протекает самопроизвольно, если сумма произведений стехиометрических коэффициентов на химический потенциал исходных веществ больше такой же суммы для продуктов.
9 Лекция:
Общее уравнение химического равновесия. Смещение равновесия
Пусть при параметрах T,P,ni система находится в равновесии. Сначала в реакции начинается изменение параметров di, dP, dni .
Реакция будет идти до нового состояния равновесия в котором d(ΔG)=0
ΔG (изменение функции) при переходе из первого равновесия во второе.
d(ΔG)=-SdT + ΔVdP + Д(ΔG)=0
Д – оператор учитывающий изменение ΔG только по составу.
Заменим
ΔS=![]()
-![]() ΔVdP
+ Д(ΔG)=0
- общее уравнение химического равновесия
учитывающее равновесие всех параметров.
При протекании реакции происходит
изменение параметров T,P,ni
на элементарную величину δT,
δP, δni .
ΔVdP
+ Д(ΔG)=0
- общее уравнение химического равновесия
учитывающее равновесие всех параметров.
При протекании реакции происходит
изменение параметров T,P,ni
на элементарную величину δT,
δP, δni .
-![]() δT
+ ΔVδP
+ Д(ΔG)<0
- Условие самопроизвольного протекания
реакции.
δT
+ ΔVδP
+ Д(ΔG)<0
- Условие самопроизвольного протекания
реакции.
Рассмотрим:
Влияние температуры.
P,n = const.
δPД = 0.
- δT<0
ΔHδT>0, то и T>0
а) δT>0, то ΔH>0
Это значит, что при повышении температуры в системе будет протекать процесс, идущий с поглощением тепла.
б) Если δT<0, то ΔH<0, то при повышении температуры протекает экзотермическая реакция.
2) Влияние давления.
T,n = const.
δT=0, Д=0.
ΔVδP<0
а) δP<0, ΔV<0, т.е при повышении давления будет протекать процесс, идущий с уменьшением объема.(Для газов уменьшение числа моль)
б) δP<0 , ΔV<0
т.е. при понижении давления протекает процесс с увеличением объема.
3) Влияние состава
T,P=const.
δT=0, δP=0, Д≠0.
Причем изменяется количество молей только одного i-того компонента т.е. изменяется химический потенциал i-того элемента.
Д(ΔG)=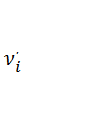 Д
Д![]() <0
<0
а) I – компонент( исходное вещество)
-<0
Это
условие соблюдается, когда ![]() увеличивается, т.е. i-тое
вещество расходуется.
увеличивается, т.е. i-тое
вещество расходуется.
б) I – пр
![]() Д
Д![]() <0
<0
Это уравнение соблюдается, когда химический потенциал уменьшается, количество продукта увеличивается.
При изменении химического потенциала только одного компонента пойдет реакция, которая будет поглощать этот компонент при повышении его химического потенциала, и наоборот, выделять компонент при снижении его химического потенциала.
Все рассмотренные случаи равновесия обобщены принципом Ле-Шателье.
Если на систему, находящуюся в равновесии оказывать внешнее воздействие(изм. Т,Р,), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет оказываемое воздействие.
![]()
T - повышается, то идет обратная реакция, то выход продуктов снижается
P – повышается, то идет прямая реакция и выход продуктов растет
Влияние сродства повышается, то идет прямая реакция
Критерий направленности и равновесия в гомогенных идеально газовых реакциях
![]()
![]()
![]() =
=![]() , тогда Δ
, тогда Δ![]()
Изменение функции Гиббса в стандартной реакции при Т=const и давлении 1атм.
Стандартные реакции – это гипотетический процесс, в котором чистые реагенты, взятые при Т и Р=1атм. находятся в изолированном друг от друга состоянии. Превращения при этих же условиях:
Тогда критерий направленности запишется:
![]() =<0
=<0
Т.е самопроизвольная реакция возможна когда левая часть неравенства <0.
Следовательно, чтобы определить
протекания реакции нужно знать ![]() .
.
при
Т=const и Р=1 атм. ![]()
Тогда и правая часть равенства будет постоянной. По этой причине, отношение под знаком логарифма постоянная и называется константой химического равновесия.
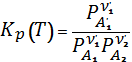
![]() - изотерма химической реакции(Вант-Гоффа)
- изотерма химической реакции(Вант-Гоффа)
Уравнение изотермы химической реакции позволяет рассчитать максимальный выход продуктов при данных условиях.
- большая отрицательная величина, то
 большая положительная, т.е.выход реакции
большой
большая положительная, т.е.выход реакции
большой
- большое положительное, то - “-” ,
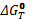 ~0
=1
, ~0.5
~0
=1
, ~0.5
- безразмерная величина, но ее численное значение зависит от выбора единиц измерения давления и от записи стехиометрического уравнения реакции.
формы выражения
Через мольную долю

![]()
Через число молей


Через молярную концентрацию
 =
=
Зависимость констант химической реакции от Т.
P,T=const
Продифференцируем по Т и с использованием уравнения Гиббса-Гельмгольца получим:
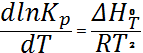 - изобара
- изобара
2) P,V=const
![]()
![]() – изохора Ван-Гоффа
– изохора Ван-Гоффа
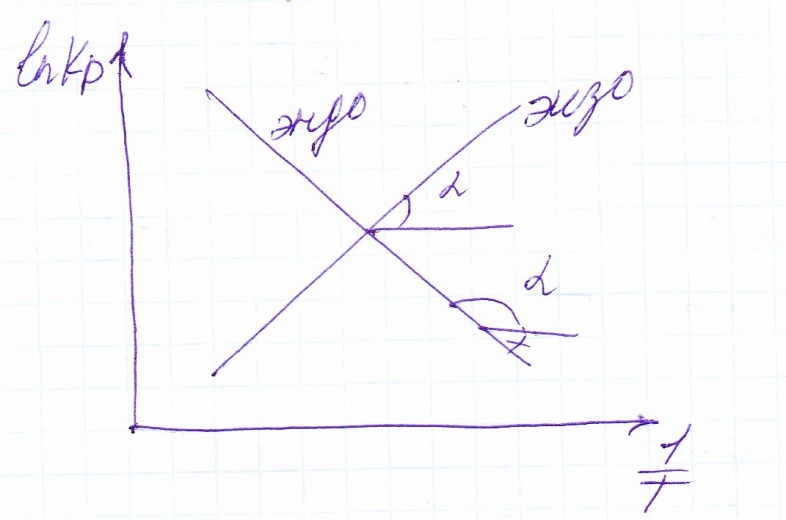
Δ![]()
Зная
зависимость ![]() от
температуры можно вычислить графически
тепловой коэффициент реакции.А если
ΔН<0, то с ростом температуры уменьшается.
от
температуры можно вычислить графически
тепловой коэффициент реакции.А если
ΔН<0, то с ростом температуры уменьшается.
