
- •Лекции по физической химии
- •2 Лекция: Законы идеального газа.
- •Энергия. Теплота. Работа.
- •Первый закон термодинамики.
- •Первый принцип термодинамики
- •Теплоёмкость.
- •3 Лекция: Понятие внутренней энергии и энтальпии чистого вещества
- •Термохимия. Энтальпия химических реакций. Закон Гесса
- •Закон Гесса
- •Закон Киркхгоффа
- •Схемы зависимости энтальпий реакций от температуры
- •2Ой Закон термодинамики. Энтропия
- •4 Лекция: 2 закон термодинамики.
- •Постулат Томпсона.
- •Формулировка Оствальда.
- •5 Лекция:
- •Направление процессов открытых многокомпонентных
- •6 Лекция: Фазовое равновесие
- •7 Лекция:
- •8 Лекция:
- •Химическое равновесие
- •Критерий направленности и равновесия в химических реакциях
- •Критерий направленности
- •9 Лекция:
- •10 Лекция: Растворы неэлектролитов. Общие понятия и определения.
- •Межчастичные взаимодействия в растворах.
- •Экспериментальные методы определения парциально – мольных величин.
- •Графический метод.
- •11 Лекция:Основные классы растворов и их термодинамические свойства
- •Совершенные растворы
- •Бесконечно разбавленные растворы
- •Термодинамические свойства бесконечно разбавленного раствора
- •Неидеальные (реальные) растворы
- •Термодинамические условия образования реального раствора
- •1)Равновесие совершенный раствор (пар) Закон Рауля.
- •14 Лекция: Кинетика сложных реакций
5 Лекция:
Вычисление изменения термодинамических функций.
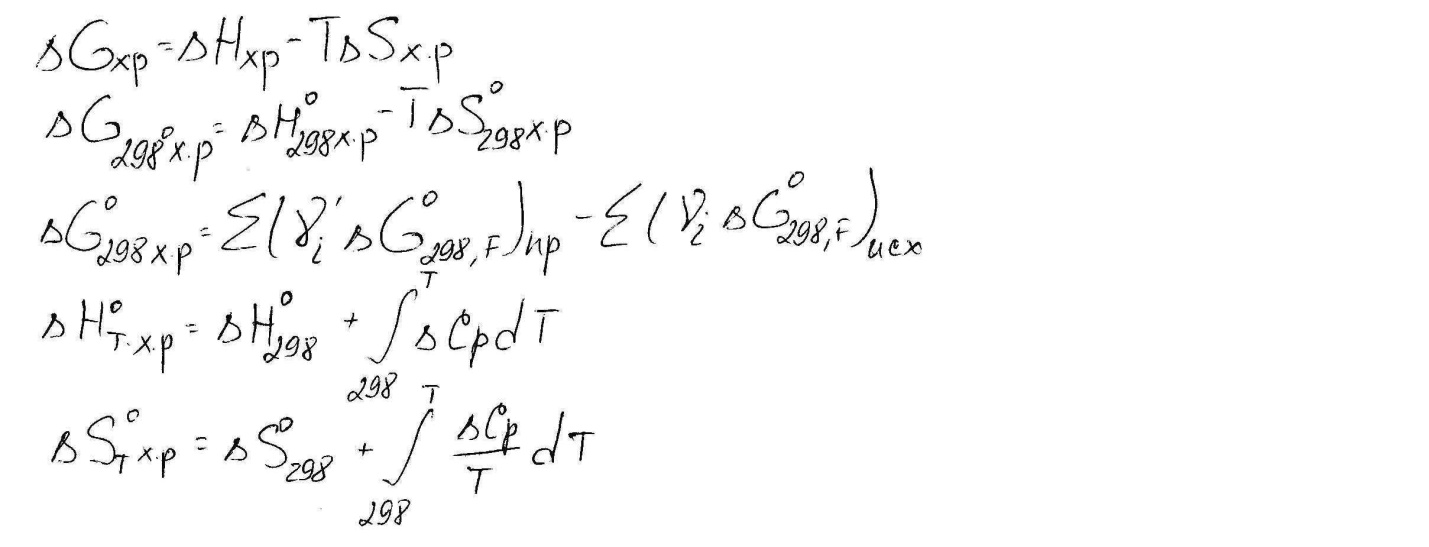
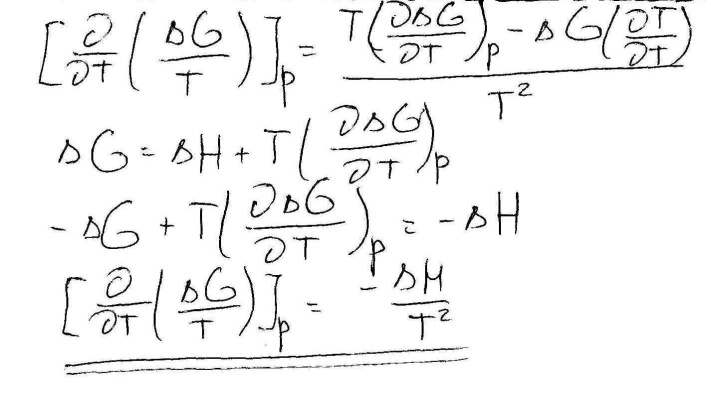
Постулат Планка.
3-й принцип термодинамики.
Т,Р-const.
Разделим переменные и проинтегрируем:
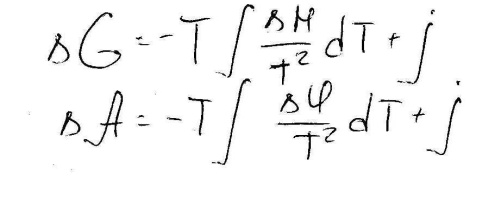
Эйнштейн в теории теплоёмкости твердых тел впервые допустил, что теплоёмкость стремится к нулю.
Нернст выдвинул постулат, из которого следует что кривые в координатах ∆G-T и ∆H-Tдля любого процесса, для системы, состоящей из кристаллических в-в при 0˚ приближается друг другу.
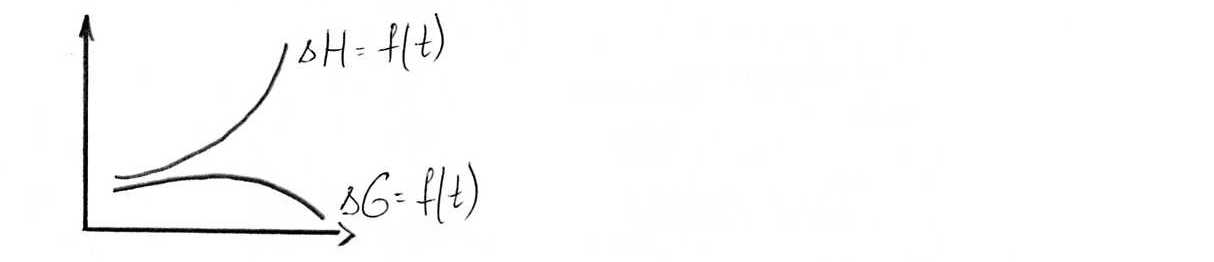
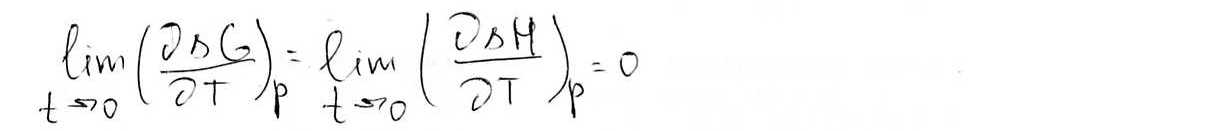
Планк вывел следствие о свойстве энтропии вблизи собственного “0”
∆G=∆H-T∆S
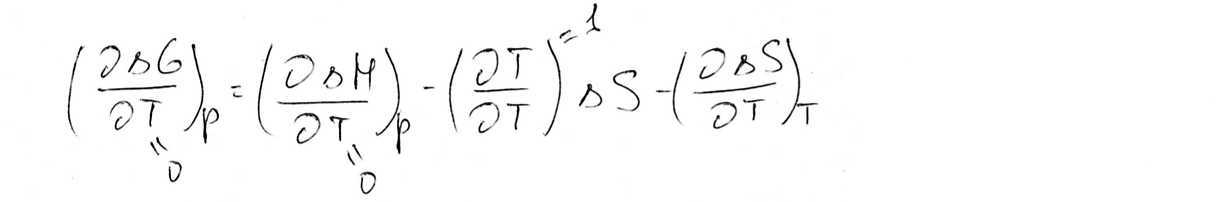
Учитывая тепловую
теорему Нернста и переходя к пределам,
получаем ![]() =0
=0
∆S=S2-S1=0 S2=S1=S0=const.
Планк постулировал, что энтропия при достижении абсолютного нуля обращается в “0”
S0=0 – 3-й закон термодинамики
3-й закон термодинамики:
При температуре абсолютного нуля энтропия правильно образованного твердого кристалла любого твердого вещества равна “0”.
Направление процессов открытых многокомпонентных
в системах.
Химический потенциал.
Выведенное уравнение для закрытых систем:
σW’=0
dU =TdS – pdV
dH =TdS+VdP
dA= - SdT – pdV
dG= - SdT + Vdp
Эти выражения не дают полной характеристики закрытых систем. Они справедливы в случае однокомпонентных систем. А для полного описания многокомпонентных систем вводится переменная число моль вещества.
U=f(S, V, n1, n2…ni)
H=f(S, P, n1, n2…ni)
A=T, V
G=(T, P, n1, n2…ni)
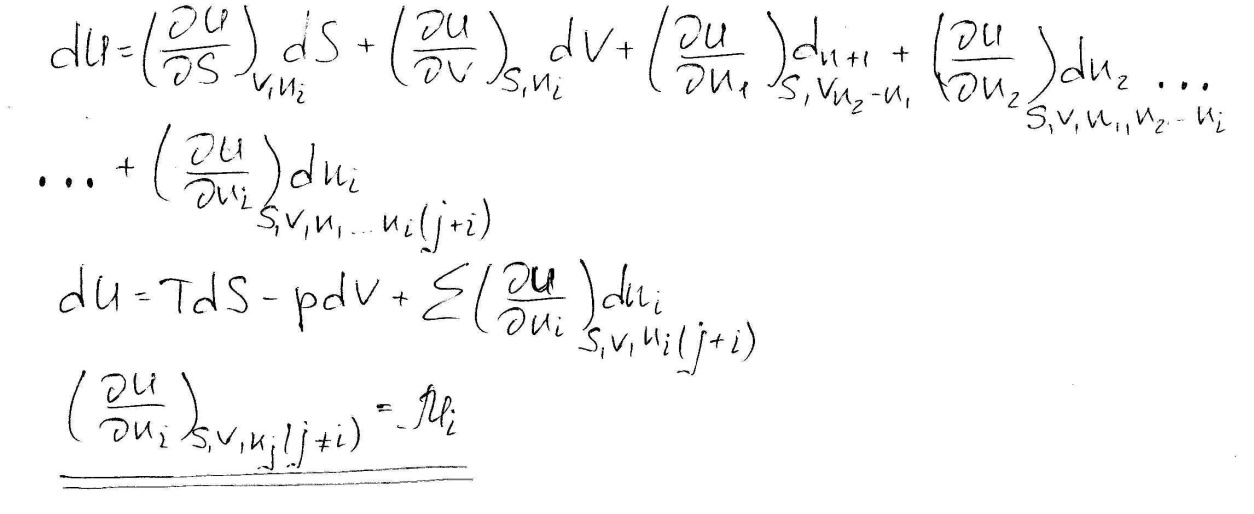
Химический потенциал i-го компонента в данной системе равен изменению числа моль i–го компонента на 1 при условии постоянства S, Vи чисел моль всех остальных компонентов.
Физический смысл-скорость изменения внутренней энергии с изменением числа моль.
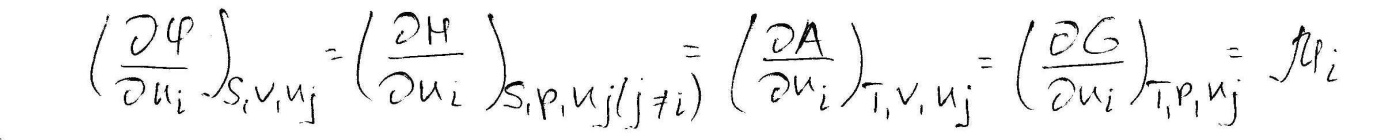
Химический потенциал i-го компонента данной системы равен частной производной от любой характеристической функции по числу моль i-го компонента, при условии постоянства соответствующих параметров системы.

Химический потенциал равен мольному произведению функции Гиббса в смеси при добавлении к ней i-го компонента.
dU
=TdS-pdV+![]()
dH =TdS+Vsp+
dA = - SdT-pdV+
dG = - SdT+Vdp+
Критерии направления и равноправия в открытых системах:
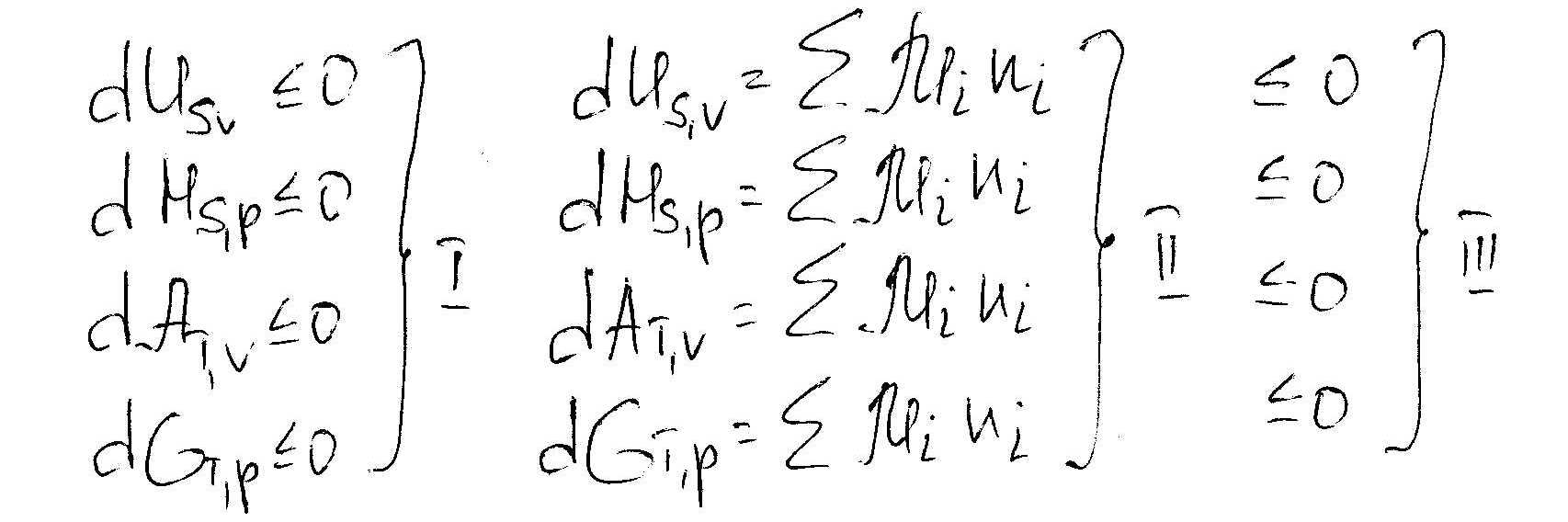
Но законы термодинамики применимы только к закрытым системам, поэтому чтобы стало возможным сочетание 1 и 2 необходимо ввести дополнительное условие, а именно то, что обязательным ограничением для использования законов термодинамики является условие сохранения постоянства общей массы системы. Гиббс предложил рассматривать в целом закрытую систему, как совокупность открытых подсистем, считая, что в целом масса систем остается постоянной, а происходит её перераспределение между её открытыми подсистемами.
Основные свойства химического потенциала.
1)Химический потенциал компонентов системы является интенсивным свойством, не зависит от общей массы системы, зависит только от свойства.
2)Химический потенциал является критерием направления и равновесия в самопроизвольных процессах.
Рассмотрим
гетерогенную систему, состоящую из i
компонентов расположенных между ![]() фазами, температура в каждой фазе
одинакова.
фазами, температура в каждой фазе
одинакова.
Процесс в системе
состоит из перехода х моль i-го
компонента из фазы ![]() .
.

Самопроизвольное протекание процесса в сторону уменьшения химического потенциала и при растворе наступает равновесие.
3)Химический потенциал компонентов связан между собой уравнениями Гиббса - Дигамма
G=![]() (1)
(1)
Показывает, что ∆G раствора определяется количеством моль и химическими потенциалами отдельных компонентов
dG =
+![]()
dG =Mi+dni
=0 (2)
n1dMi-n2dM2=0
Химический потенциал чистого вещества.
G=
Gi˚=Mi˚*ni˚
Gi˚![]() ni˚=gi˚
(мольная энергия Гиббса)
ni˚=gi˚
(мольная энергия Гиббса)
Т.е. мольная функция Гиббса чистого вещества при Т, Р= const. равна его химическому потенциалу.
Зависимость химического потенциала от температуры.
Mi = f (T, P, n)
P, n = const.
Mi = f (Т)
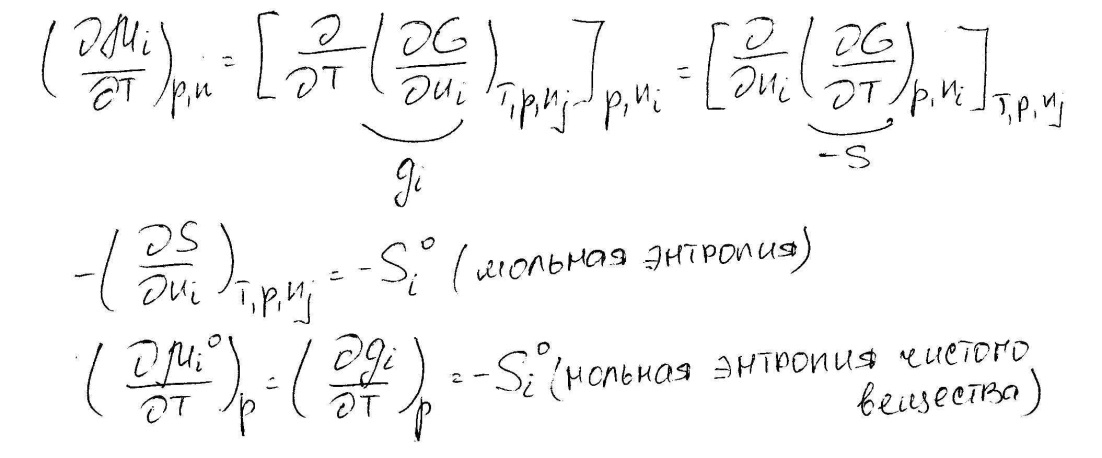
Химический потенциал с ростом температуры уменьшается, т.к. энтропия по физическому смыслу не может быть отрицательной величиной.
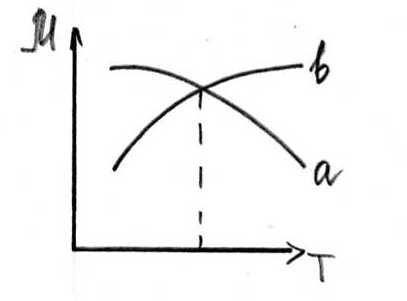
Химический потенциал уменьшается с температурой быстрее, чем химический потенциал конденс. фазы
Зависимость химического потенциала от давления:
Mi= f (T, P, n)
T, n=const
Mi=f(P)

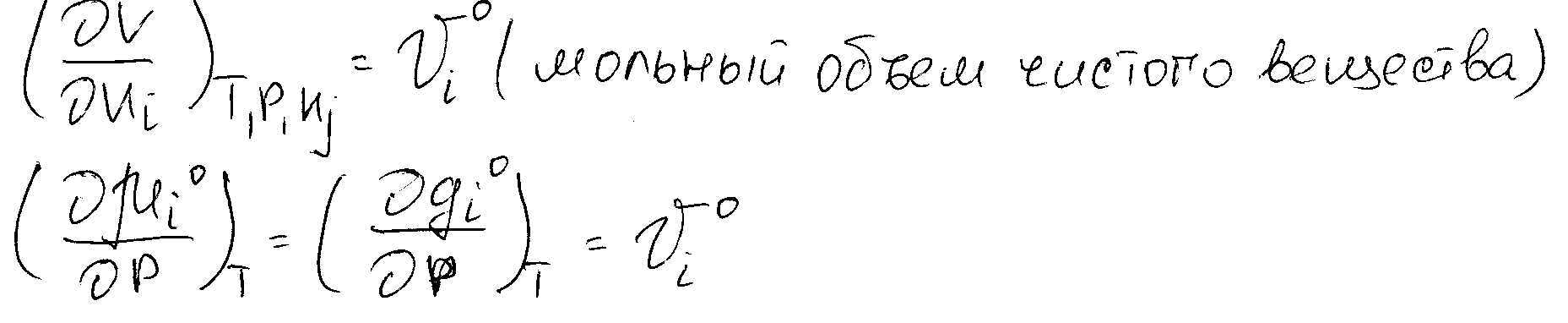
Растет давление – химический потенциал тоже растет
![]()
Стандартный химический потенциал
![]()
