
- •Лекции по физической химии
- •2 Лекция: Законы идеального газа.
- •Энергия. Теплота. Работа.
- •Первый закон термодинамики.
- •Первый принцип термодинамики
- •Теплоёмкость.
- •3 Лекция: Понятие внутренней энергии и энтальпии чистого вещества
- •Термохимия. Энтальпия химических реакций. Закон Гесса
- •Закон Гесса
- •Закон Киркхгоффа
- •Схемы зависимости энтальпий реакций от температуры
- •2Ой Закон термодинамики. Энтропия
- •4 Лекция: 2 закон термодинамики.
- •Постулат Томпсона.
- •Формулировка Оствальда.
- •5 Лекция:
- •Направление процессов открытых многокомпонентных
- •6 Лекция: Фазовое равновесие
- •7 Лекция:
- •8 Лекция:
- •Химическое равновесие
- •Критерий направленности и равновесия в химических реакциях
- •Критерий направленности
- •9 Лекция:
- •10 Лекция: Растворы неэлектролитов. Общие понятия и определения.
- •Межчастичные взаимодействия в растворах.
- •Экспериментальные методы определения парциально – мольных величин.
- •Графический метод.
- •11 Лекция:Основные классы растворов и их термодинамические свойства
- •Совершенные растворы
- •Бесконечно разбавленные растворы
- •Термодинамические свойства бесконечно разбавленного раствора
- •Неидеальные (реальные) растворы
- •Термодинамические условия образования реального раствора
- •1)Равновесие совершенный раствор (пар) Закон Рауля.
- •14 Лекция: Кинетика сложных реакций
Бесконечно разбавленные растворы
Формально бесконечно разбавленный раствор характеризуется тем что мольная доля растворителя в нем стремиться к единице, а мольная доля растворенного вещества к нулю. Бесконечно разбавленный раствор нельзя воспринимать ка чистый растворитель. Его получают растворениемd моль вещества в бесконечно большом количестве растворителя. Из за большого разбавления в нем отсутствуют взаимодействия между частицами растворенного вещества,но существуют взаимодействия между частицами растворителя и частицами растворителя и растворенного вещества
Выражение для химического потенциала в бинарном бесконечно разбавленном растворителе.
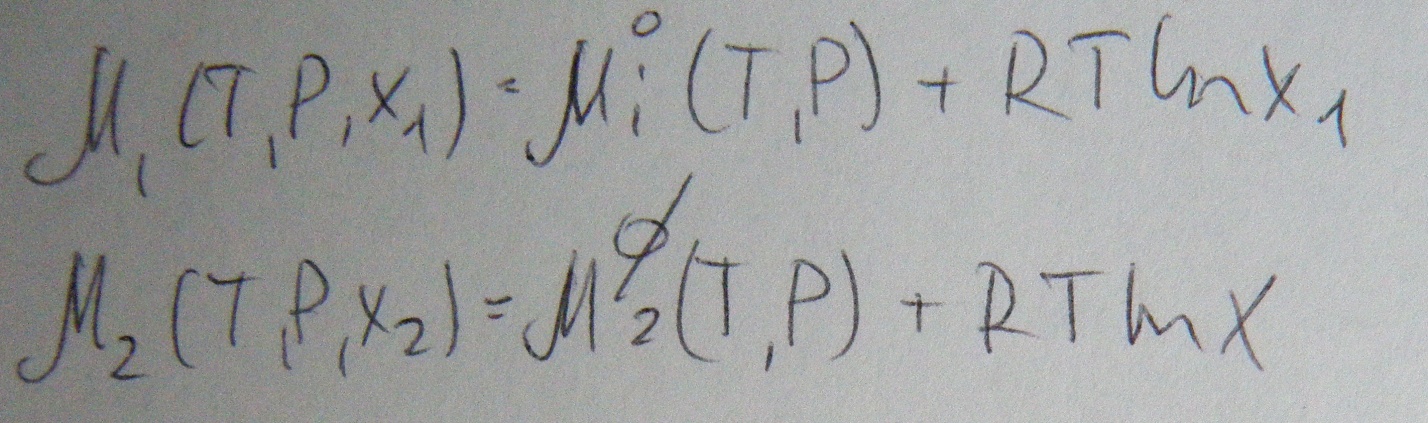
Величина ![]() зависит
от природы растворителя. Экспериментально
ее определить невозможно, поэтому в
расчетах пользуются следующим уравнением:
зависит
от природы растворителя. Экспериментально
ее определить невозможно, поэтому в
расчетах пользуются следующим уравнением:
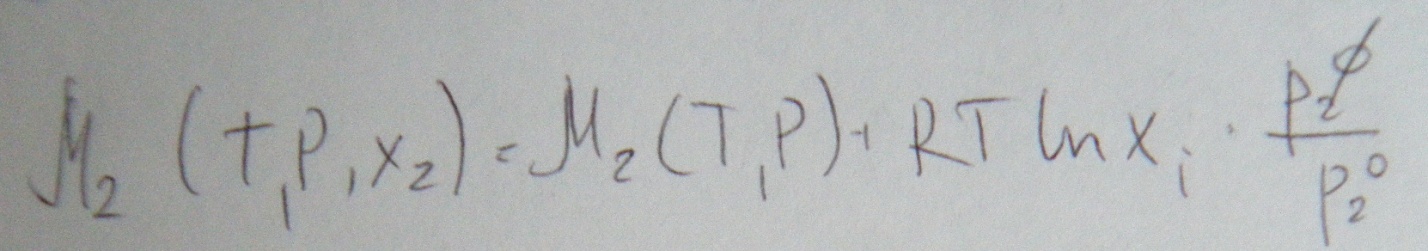
Термодинамические свойства бесконечно разбавленного раствора
Образование бесконечно разбавленного раствора сопровождается изменением обьема
Образование бесконечно разбавленного раствора сопровождается тепловым эффектом который равен
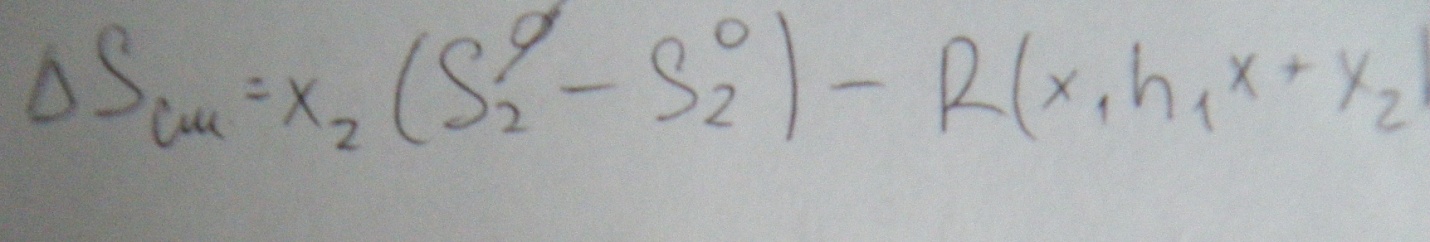
Неидеальные (реальные) растворы
В реальных растворах
характер межмолекулярного взаимодействия
более сложный, чем предполагалось в
идеальных. Он зависит от состава
растворов, поэтому выражение зависимости
химического потенциала от мольной доли
для реального раствора непригодна.
Льюис предложил ввести новую величину
![]() -
активность. Через активность просто
выражаются все термодинамические
свойства растворов. Для идеальных
растворов
совпадает с концентрацией. Активность-
величина подставив которую в уравнения
для идеальных растворов они будут
работать и для реальных
-
активность. Через активность просто
выражаются все термодинамические
свойства растворов. Для идеальных
растворов
совпадает с концентрацией. Активность-
величина подставив которую в уравнения
для идеальных растворов они будут
работать и для реальных
Тогда

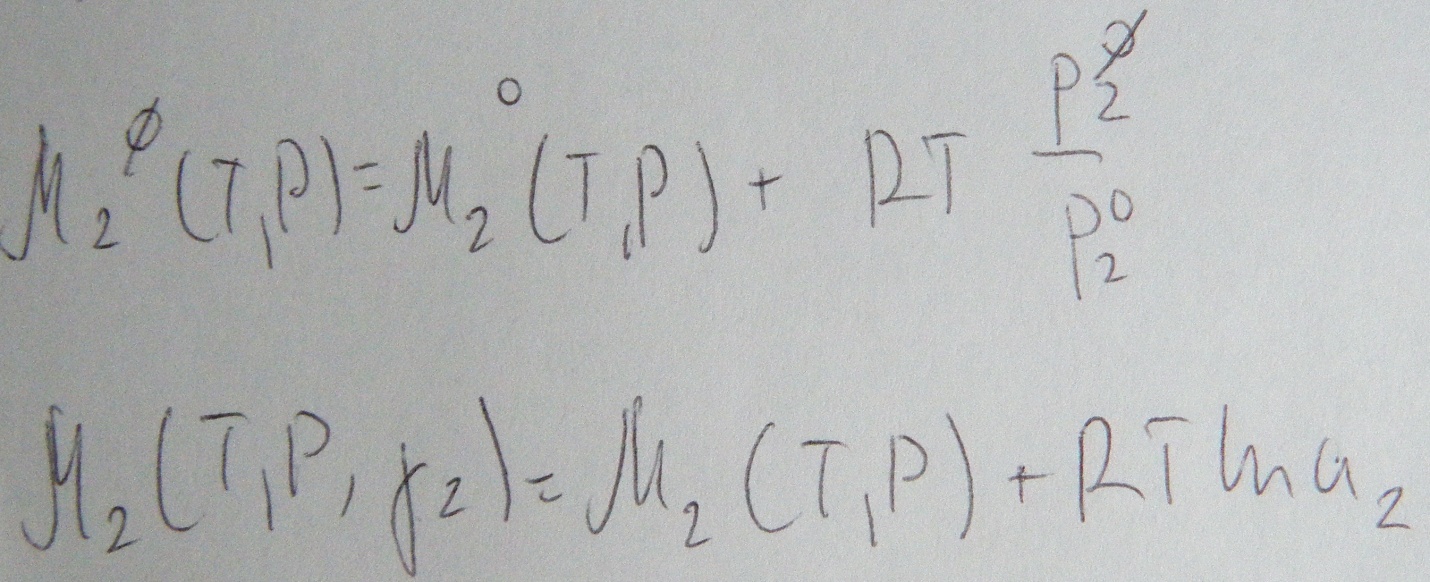
Подставляя (4) в (2) и сравнивая полученное с 3
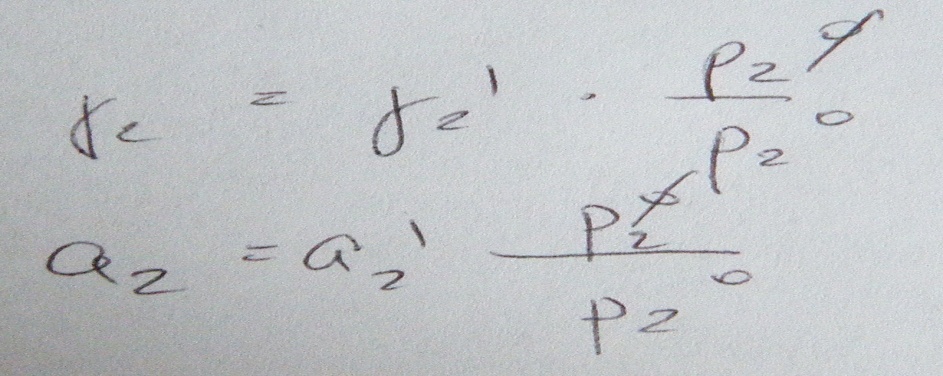
Физический смысл
![]() :
:
является мерой отклонения свойств реальных растворов от идеальности
Термодинамические условия образования реального раствора
Из второго принципа
термодинамики следует что самопроизвольно
процесс будет протекать если![]()
Тогда при образовании бинарного раствора

Исходя из всего этого получаем
Условие самопроизвольного образования реального раствора
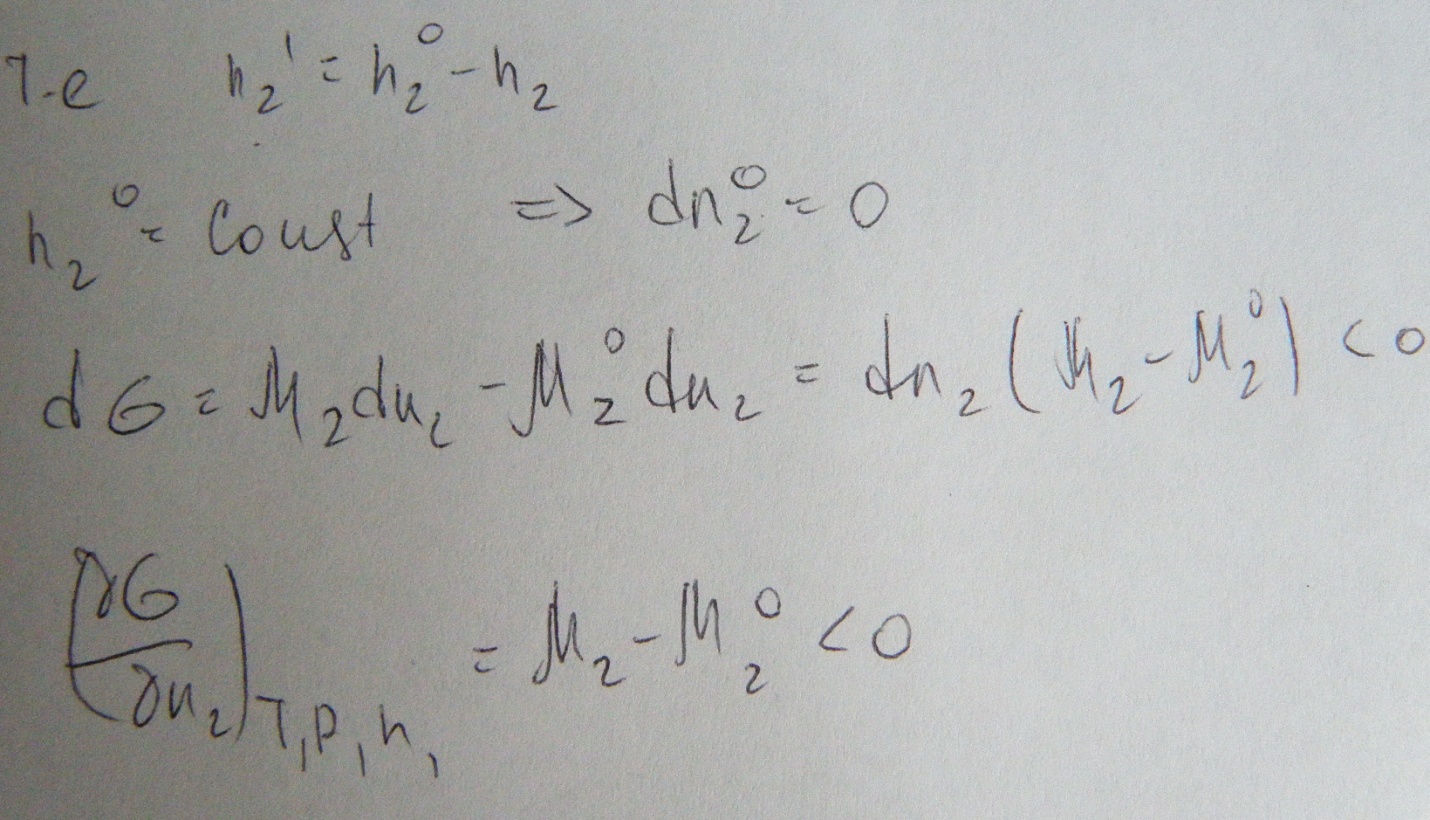
При дальнейшем добавлении растворенного вещества к раствору возможны два варианта:
Если растворенное вещество твердое,то образуется новая фаза – осадок, т.е. чистое вещество
Если растворимое вещество-жидкость или газ то образуется новая фаза вещества первого во втором
Если
не достигается состояние равновесия и
условие ![]()
Выполняется на всем промежутке существования раствора то вещества называются неограниченно растворимыми друг в друге.
12 лекция: Распределение вещества между двумя несмешивающимися жидкостями.
Закон распределения.
При введении в систему состоящую из двух несмешивающихся жидкостей А и В третьего компонента D, который растворим в обеих жидкостях. Процесс растворения будет протекать, пока не наступит равновесие.
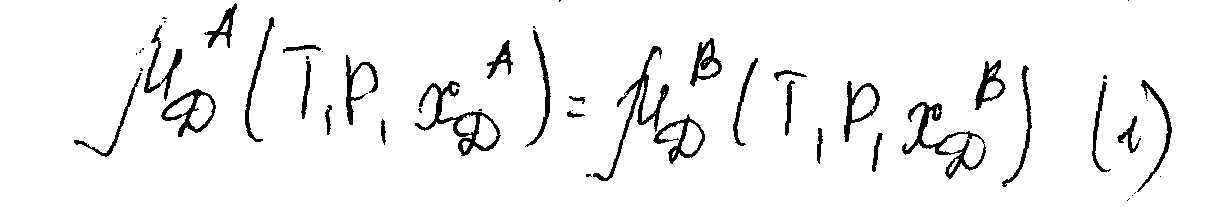
1)Если растворы вещества D в фазах А и В являются идеальным, бесконечно разбавленным.

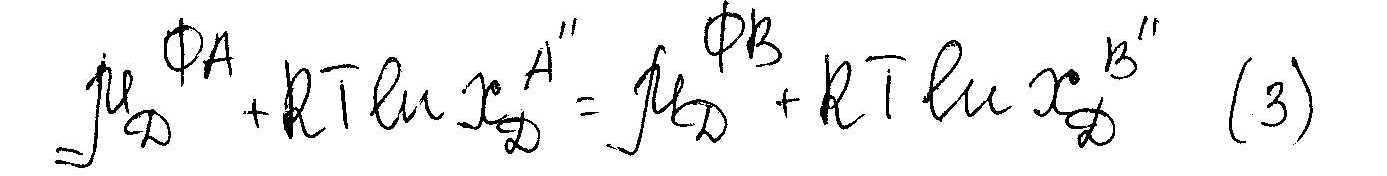
Подставляя 2 и 3 в 1, преобразуем и получим
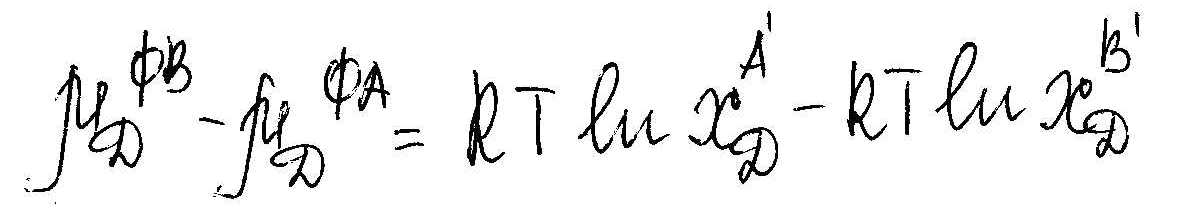
Зависит только от Т и Р
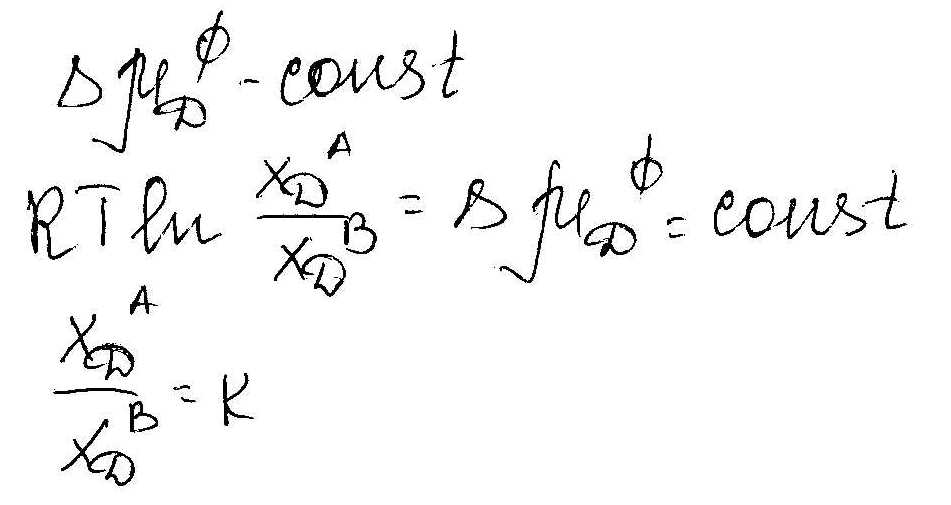
Закон распределения. К – коэффициент распределения вещества между двумя несмешивающимися жидкостями.
Формулировка : Отношение концентраций вещества D в соприкасающихся фазах А и В не зависит от его общего количества введенного в систему. А при данных Т и Р является величиной постоянной. Это постоянство означает, что введение в систему дополнительного количества вещества D вызывает пропорциональное изменение его концентрации в фазах А и В.
2)Если растворенное вещество D с фазами А и В образуют совершенные растворы, тогда условие равновесия запишется так:
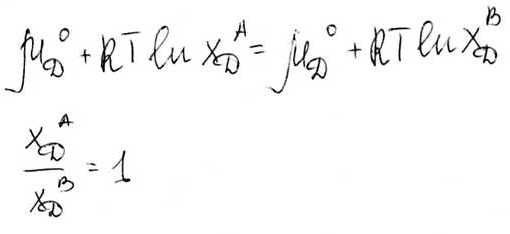
Вещество D
равномерно распределено между А и В
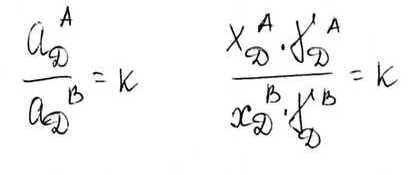
Для реальных растворов
Закон распределения имеет большое практическое значение. Он широко применяется для расчетов экстракционных процессов.
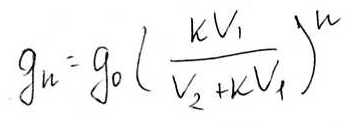
V1- объем экстрагированных зон
К - коэффициент растворения
V2 – объем экстрагента
g0 - начальное количество экстрагируемого вещества
gn – количество вещества оставшегося в растворе после экстракции
n – количество экстракций
Растворимость газов в жидкости.
Закон Генри.
Рассмотрим равновесие жидкостей и газа, когда жидкий растворитель летуч
Общее давление над раствором:
Р=Р1+Р2
Р1- парциальное давление растворителя над раствором
Р2- парциальное давление растворенного вещества над раствором
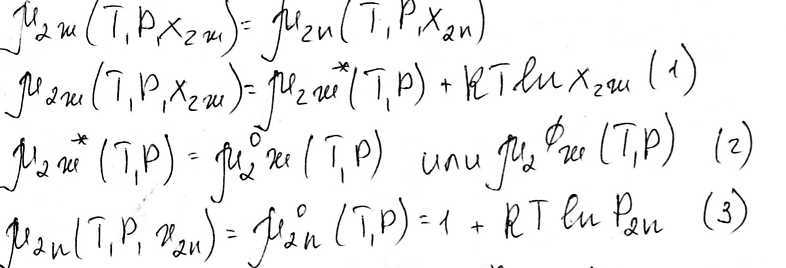
Подставим 2, 3 в 1, преобразуем и получим

К2- const Генри
Закон Генри: Растворимость (х2) в жидкости пропорциональна давлению этого газа над раствором.
Х2ж=К2*Р2
К2- определено экспериментально
Равновесие жидкость – пар в двойных системах.
