
- •Лекции по физической химии
- •2 Лекция: Законы идеального газа.
- •Энергия. Теплота. Работа.
- •Первый закон термодинамики.
- •Первый принцип термодинамики
- •Теплоёмкость.
- •3 Лекция: Понятие внутренней энергии и энтальпии чистого вещества
- •Термохимия. Энтальпия химических реакций. Закон Гесса
- •Закон Гесса
- •Закон Киркхгоффа
- •Схемы зависимости энтальпий реакций от температуры
- •2Ой Закон термодинамики. Энтропия
- •4 Лекция: 2 закон термодинамики.
- •Постулат Томпсона.
- •Формулировка Оствальда.
- •5 Лекция:
- •Направление процессов открытых многокомпонентных
- •6 Лекция: Фазовое равновесие
- •7 Лекция:
- •8 Лекция:
- •Химическое равновесие
- •Критерий направленности и равновесия в химических реакциях
- •Критерий направленности
- •9 Лекция:
- •10 Лекция: Растворы неэлектролитов. Общие понятия и определения.
- •Межчастичные взаимодействия в растворах.
- •Экспериментальные методы определения парциально – мольных величин.
- •Графический метод.
- •11 Лекция:Основные классы растворов и их термодинамические свойства
- •Совершенные растворы
- •Бесконечно разбавленные растворы
- •Термодинамические свойства бесконечно разбавленного раствора
- •Неидеальные (реальные) растворы
- •Термодинамические условия образования реального раствора
- •1)Равновесие совершенный раствор (пар) Закон Рауля.
- •14 Лекция: Кинетика сложных реакций
14 Лекция: Кинетика сложных реакций
Обратимые реакции-это реакции, протекающие одновременно в двух противоположных направлениях. В момент равновесия в реакционной смеси находятся сравнимые количества исходных веществ и продуктов.
Рассмотрим реакцию 1-го порядка
к1
А↔В
к2
СА0, СВ0, х
СА= СА0 -х
СВ= СВ0-х
dCA/dt= -k1CA+k2CB
dCB/dt= k1CA- k2CB
k1+k2=1/t*ln(L/L-x)
L=(k1CA0-k2CB0)/ (k1+k2)= (KCA0-CB0)/(K+1)
K=k1/k2= (СВ0+х)/(СА0 –х)
Кинетическое уравнение: ln(х равн/х равн-х)=(к1-к2)t
tgα=
к1-к2
к1/k2=k равн.
2.Параллельные реакции-это реакции, в которых исходные вежества одновременно реагируют в двух или более направлениях.
k1 k1
1)А→В 2)А+С: →В
к2 к2
А →Д →Д
Запишем кинетическое уравнение для реакции 1-го порядка
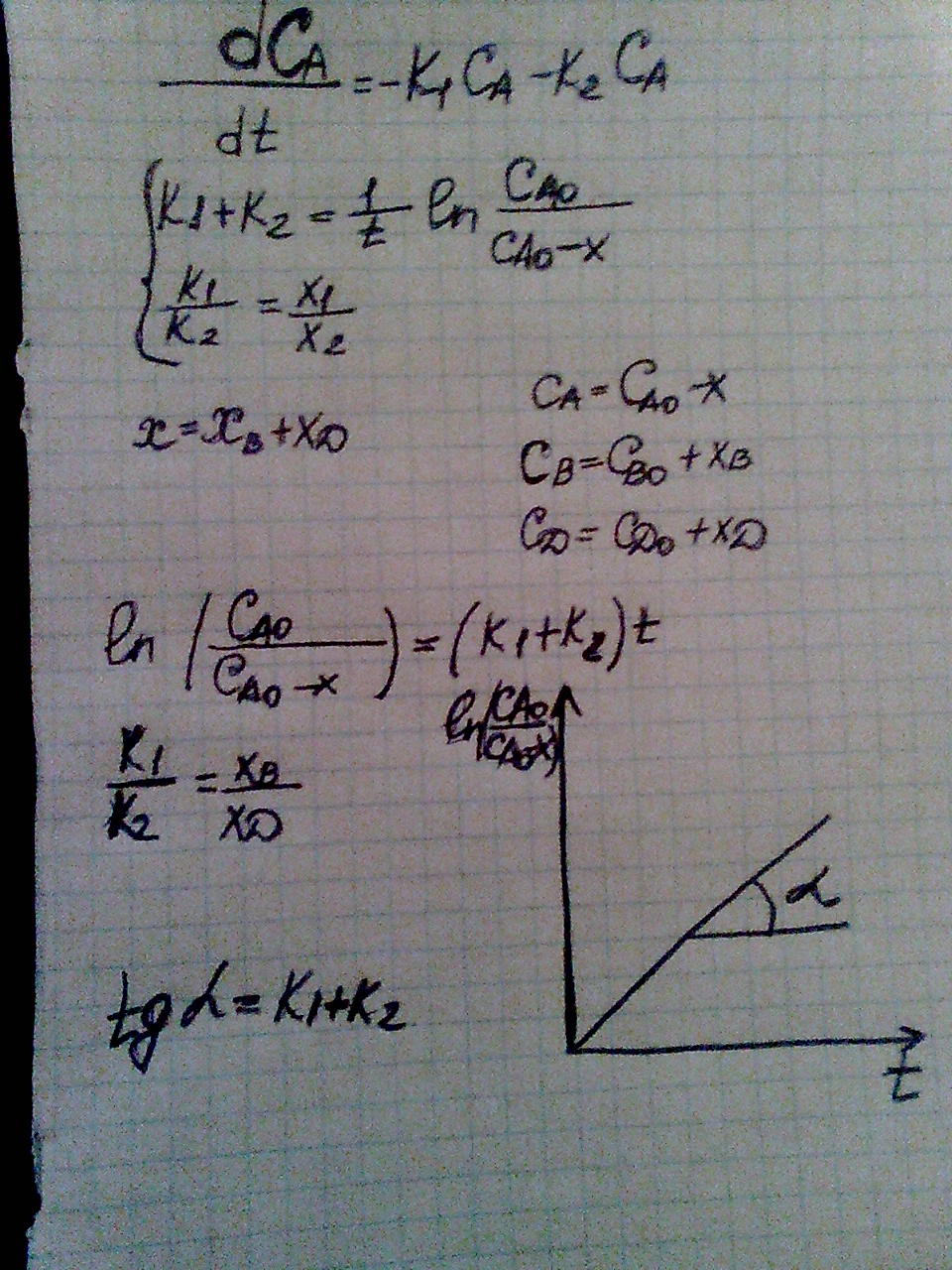
3) Последовательные реакции- это реакции,в которых образующийся продукт для одной стадии является исходным реагентом, а для другой –продуктом. Такими веществами могут быть: молекулы, которые вступают в дальнейшее взаимодействие: атомы и свободные радикалы, обладающие повышенной реактивной способностью.
Кинетические расчеты таких уравнений сложны.
к1-к2 и к1/k2 не определяются.
Рассмотрим реакцию 1-го порядка:
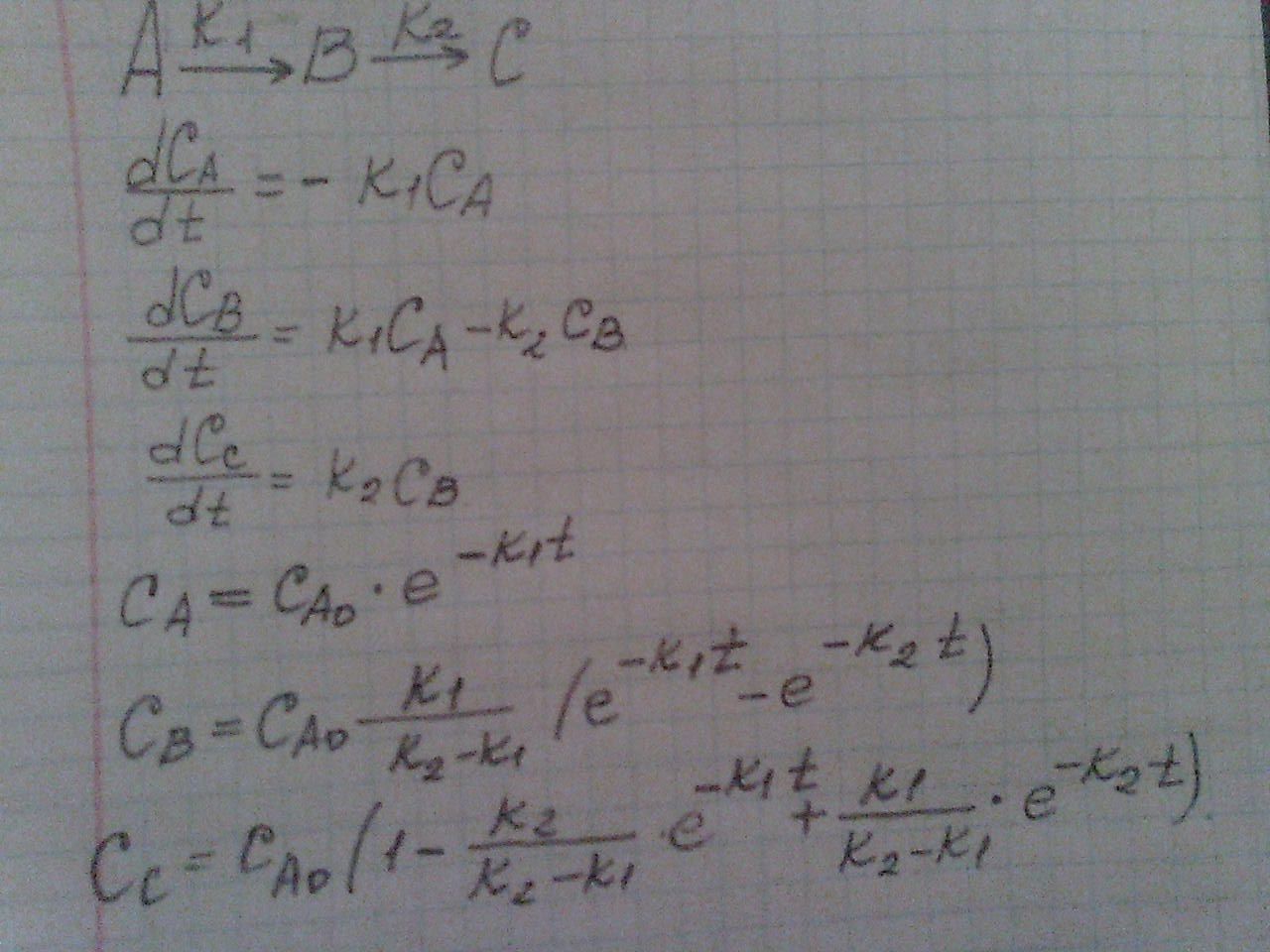
Метод квазистационарных концентраций или метод Боденштейна.
Применяется для описания кинетики сложных химических рекций.
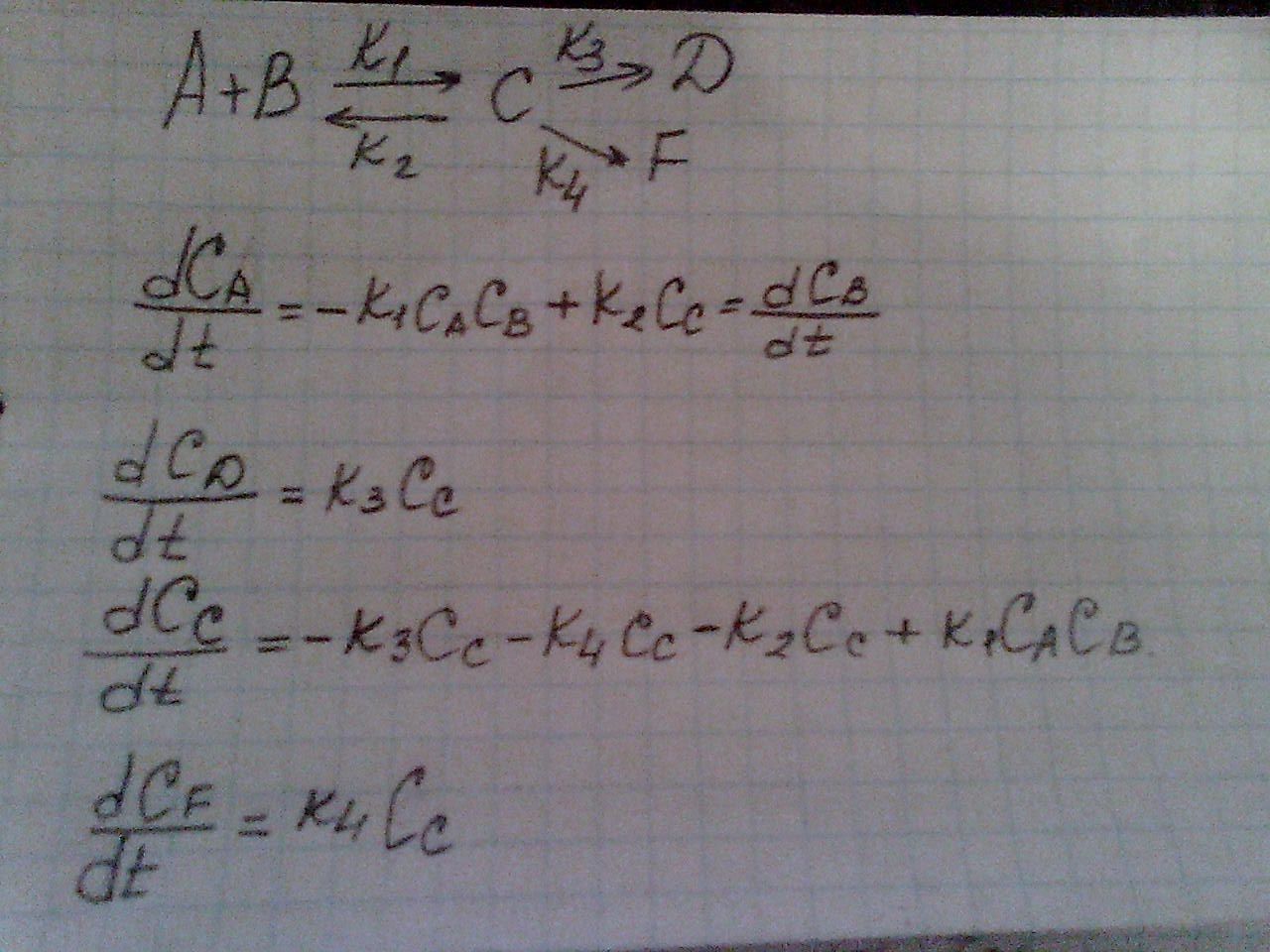
Для описания кинетики, предложенной сложной реакции надо решить систему дифференциальных уравнений, поэтому при изучении таких реакций используют приближения. Один из них- метод Боденштейна. Он применяется при изучении цепных, последовательных, параллельных, каталитических реакций, т.е. реакций, в которых образуются короткоживущие частицы.
Рассмотрим применение этого метода на примере последовательной реакции 1-го порядка.
к1 к2
А→В→Д к1 > к2
В- малоустойчивое соединение
С самого начала реакции выполняется условие : скорость образующегося вещества В равна скорости его расхода. Это является физической основой метода Боденштейна.
Wобр.В=WрасхВ
dCв/dt=k1Cа-k2Св=0
Св=const
Замена дифференциальных уравнений на алгебраические, из которых можно найти Св является математической основой метода Боденштейна.
k1 k2
А+В↔С→Д
к3
dCд/dt=k3Cc, Cc-? ее нужно заменить на концентрацию исходных веществ или продуктов, которые легко определяются. Для этого воспользуемся методом Боденштейна:
dCc/dt=k1CaCв-k2Cc-k3Cc=0
k1CaCв-Cc(k2+k3)=0
Cc=(k1/ k2+k3)*CaCв
dCд/dt=k3(k1* CaCв/ k2+k3)=kэксперим.* CaCв
