
- •Лекции по физической химии
- •2 Лекция: Законы идеального газа.
- •Энергия. Теплота. Работа.
- •Первый закон термодинамики.
- •Первый принцип термодинамики
- •Теплоёмкость.
- •3 Лекция: Понятие внутренней энергии и энтальпии чистого вещества
- •Термохимия. Энтальпия химических реакций. Закон Гесса
- •Закон Гесса
- •Закон Киркхгоффа
- •Схемы зависимости энтальпий реакций от температуры
- •2Ой Закон термодинамики. Энтропия
- •4 Лекция: 2 закон термодинамики.
- •Постулат Томпсона.
- •Формулировка Оствальда.
- •5 Лекция:
- •Направление процессов открытых многокомпонентных
- •6 Лекция: Фазовое равновесие
- •7 Лекция:
- •8 Лекция:
- •Химическое равновесие
- •Критерий направленности и равновесия в химических реакциях
- •Критерий направленности
- •9 Лекция:
- •10 Лекция: Растворы неэлектролитов. Общие понятия и определения.
- •Межчастичные взаимодействия в растворах.
- •Экспериментальные методы определения парциально – мольных величин.
- •Графический метод.
- •11 Лекция:Основные классы растворов и их термодинамические свойства
- •Совершенные растворы
- •Бесконечно разбавленные растворы
- •Термодинамические свойства бесконечно разбавленного раствора
- •Неидеальные (реальные) растворы
- •Термодинамические условия образования реального раствора
- •1)Равновесие совершенный раствор (пар) Закон Рауля.
- •14 Лекция: Кинетика сложных реакций
Лекции по физической химии
1 лекция :Физическая химия – наука, которая устанавливает связь между химическими и физическими явлениями и на этой основе формирует общие закономерности химических превращений.
Химическая термодинамика
Основные понятия и определения:
Термодинамика – наука об энергии, о принимаемых ею формах, теплоте и работе, взаимных превращениях. Термодинамика позволяет определить принципиальную возможность или невозможность процессов. Позволяет только указать направление процесса, но не его механизм и скорость. Объектом термодинамического исследования является система.
Термодинамическая система – ограниченная каким-либо образом часть материального мира, которое является предметом исследования. То, что не входит в систему – окружающая среда.
Классификация Термодинамических систем
Изолированная(не обменивается с окружающей средой ни веществом ни энергией.) V=const.
Закрытая(не обменивается с окружающей средой только энергией.) V≠const.
Открытая(обменивается с окружающей средой и веществом и энергией) Объем не постоянен.
Законы термодинамики применимы к закрытым системам.
Адиабатическая система – закрытая система, которая не может обмениваться с окружающей средой теплотой.
Окружающая среда на нее влияет за счет совершения над ней работы. Все системы делятся на гомогенные и гетерогенные.
Гомогенная система – внутри нет поверхности раздела, отделяющей друг от друга различные по свойствам части системы.
Гетерогенная система - это система гомогенные части которой отделены друг от друга поверхностью раздела.
Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и свойствам и отделенных от других частей системы поверхностью раздела.
Термодинамические параметры состояния системы
Каждая система характеризуется целым рядом физических величин P,V,T,μ,ρ. Эти величины которые однозначно определяют состояние системы называются термодинамическими параметрами. Для характеристики термодинамической системы выбирают независимые параметры, т.е. такие, через которые можно вычислить другие. Для чистого вещества выбирают P,V,T.
T –характеризует тепловую составляющую системы;
P –характеризует взаимодействие с окружающей средой и определяющий отношение силы равномерного распределения к площади поверхности;
V – характеризует микроскопическую составляющую системы.
Все параметры подразделяются на экстенсивные и интенсивные.
Экстенсивные
зависят от массы системы и подчиняются
закону аддитивности. E,V,S.
Экстенсивность определяют для всей
системы. Интенсивные не зависят от
общей массы системы и не подчиняются
закону аддитивности. P,T,ρ,![]() .
.
В термодинамике рассматривается не любое состояние системы, а только равновесное. Оно характеризуется тем, что для всей системы в целом все интенсивные параметры принимают одинаковые значения. И не изменяются во времени. Оно существует до тех пор пока окружающая среда не окажет влияния на систему. Это состояние Планк назвал наиболее вероятным и стабильным.
Термодинамические процессы изменяют состояние системы как результат изменения термодинамических параметров. Если система в результате процесса вернулась к первоначальным параметрам, то она совершила круговой процесс.
Равновесный процесс. Обратимость равновесного процесса.
Равновесный процесс – это процесс состоящий из непрерывных последовательных состояний истинного равновесия.
Рассмотрим неравновесное расширение газа с поршнем:
Поршень нагружен гирьками. После снятия гирек давление и объем изменяются скачкообразно.

Работа равна площади под ломанной. В данном неравновесном процессе в исходное состояние возвращается только система. Остаются определенные изменения – компенсация за неравновесность процесса. Это необратимый процесс.
Теперь проверяем равновесное расширение газа.
Будем изменять вес груза микроскопическими порциями, бесконечно малыми пищинками. В пределе, когда вес пищинок стремится к нулю, а их число к бесконечности, то разгружая, получим бесконечно медленный равновесный процесс, состоящий из бесконечных состояний.
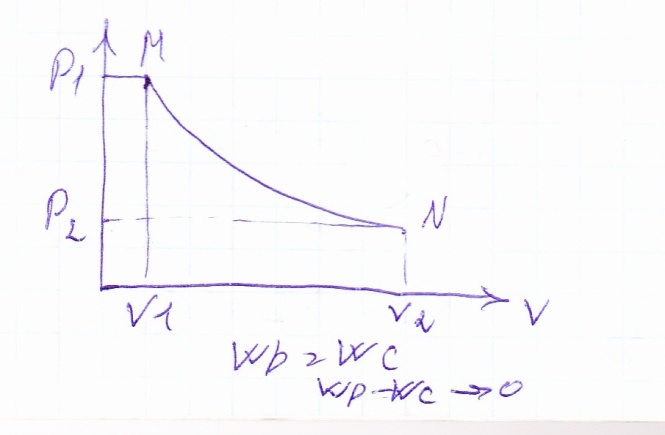
В равновесном процессе движущие силы и физические величины равны между собой. Именно при равенстве внутренних сил и внешней среды система находится в равновесии.
Равновесный
процесс при котором соблюдается ![]() является термодинамически обратимым.
является термодинамически обратимым.
![]() δ
δ![]()
Уравнение состояния
Уравнение которое связывает между собой термодинамические параметры в термодинамическом равновесии называются уравнением состояния.
f(x,y,z)=0
f(P,V,T)=0
Термодинамические законы можно применять только для системы у которой известны уравнения состояния. Для реальных газов существует более 150 уравнений состояний.
Уравнение
Вандер-Ваальса: (P+![]() )(V-b)=RT
)(V-b)=RT
a - притяжение
b – столкновение
(P+![]() )(V-nb)=nRT
)(V-nb)=nRT
Функции состояния и функции процесса.
Если изменение данного параметра определено только разностью значений этой величины в конечном и начальном состояниях и не зависит от пути процесса, то такая величина называется свойством системы.
Рассмотрим
систему с первоначальными параметрами
![]() .
.
Газ
нагревается расширяется и охлаждается,
а затем переходит в первоначальное
состояние. Опыт показывает как только
выставляется температура ![]() ,
то восстанавливается и
,
то восстанавливается и ![]() ,значит
суммарное давление равно 0.(ΔP=0)
ΔP не зависит от того какие
значения были в ходе процесса. Давление
есть свойство системы которое определяет
T,V . Это
круговой процесс. Для некругового
процесса начальные
,
конечные
,значит
суммарное давление равно 0.(ΔP=0)
ΔP не зависит от того какие
значения были в ходе процесса. Давление
есть свойство системы которое определяет
T,V . Это
круговой процесс. Для некругового
процесса начальные
,
конечные ![]() .
.
ΔP=![]()
ΔV=![]()
ΔT=![]()
Свойства системы есть функции нескольких переменных, в качестве которых выступают термодинамические параметры, поэтому функция системы называются функцией состояния.
Независимость изменения свойств от пути процесса означает что бесконечно малое изменение свойств системы является полным дифференциалом.
P=f(V,T)
dP=(![]() dV
+ (
dV
+ (![]()
Полное
изменение свойства определяется суммой
бесконечно малых изменений на бесконечно
малых отрезках ![]() .
.
ΔP=![]()
Наряду с функциями состояния есть функции процесса, т.е. величины изменение которых зависит от пути процесса. Бесконечно малое изменение функции процесса есть неполный дифференциал δ.
