
- •Лекции по физической химии
- •2 Лекция: Законы идеального газа.
- •Энергия. Теплота. Работа.
- •Первый закон термодинамики.
- •Первый принцип термодинамики
- •Теплоёмкость.
- •3 Лекция: Понятие внутренней энергии и энтальпии чистого вещества
- •Термохимия. Энтальпия химических реакций. Закон Гесса
- •Закон Гесса
- •Закон Киркхгоффа
- •Схемы зависимости энтальпий реакций от температуры
- •2Ой Закон термодинамики. Энтропия
- •4 Лекция: 2 закон термодинамики.
- •Постулат Томпсона.
- •Формулировка Оствальда.
- •5 Лекция:
- •Направление процессов открытых многокомпонентных
- •6 Лекция: Фазовое равновесие
- •7 Лекция:
- •8 Лекция:
- •Химическое равновесие
- •Критерий направленности и равновесия в химических реакциях
- •Критерий направленности
- •9 Лекция:
- •10 Лекция: Растворы неэлектролитов. Общие понятия и определения.
- •Межчастичные взаимодействия в растворах.
- •Экспериментальные методы определения парциально – мольных величин.
- •Графический метод.
- •11 Лекция:Основные классы растворов и их термодинамические свойства
- •Совершенные растворы
- •Бесконечно разбавленные растворы
- •Термодинамические свойства бесконечно разбавленного раствора
- •Неидеальные (реальные) растворы
- •Термодинамические условия образования реального раствора
- •1)Равновесие совершенный раствор (пар) Закон Рауля.
- •14 Лекция: Кинетика сложных реакций
10 Лекция: Растворы неэлектролитов. Общие понятия и определения.
Раствор – это гомогенная смесь, состоящая из двух или более веществ, однофазовая система (нет поверхности раздела).
В растворе в каждой точке его объема физическая величина имеет одно и то же значение. Растворы бывают: твердые, жидкие (неэлектролиты, электролиты).
Составляющие раствор вещества компоненты делятся на растворитель и растворённое вещество.
Растворитель – вещество, концентрация которого намного больше концентрации остальных веществ.
Наибольшая концентрация растворимого вещества, при которой устанавливается равновесие, называется растворимостью.
Раствор, находящийся в равновесии с избытком растворимого вещества, называется насыщенным.
Межчастичные взаимодействия в растворах.
В процессе образования раствора вещества теряют свою индивидуальность.
Физические и термодинамические свойства раствора определяются: природой частиц присутствующих в растворе, характером взаимодействия между ними.
В растворе могут взаимодействовать, как молекулы так и более сложные образования – комплексы.
В растворах неэлектролитов преобладает межмолекулярное взаимодействие, которое можно разделить на две группы:
1) Взаимодействие обусловленное ориентационными, индукционными и дисперсионными силами.
Ориентационные – взаимодействие между молекулами имеет постоянный дипольный момент.
Индукционные – взаимодействие между молекулой с постоянным диполем и молекулой с наведенным диполем.
Дисперсионные – имеют сложную природу- в каждый данный момент электроны в молекуле находятся в движение на некотором расстояние от ядра, т.е. в молекуле есть всегда мгновенная ассиметрия электрического заряда, а значит мгновенный диполь.
Который индуцирует дипольный момент другой молекулы.
2)Взаимодействие вызываемое образованием сольватов и различных донорно-акцепторных комплексов.
Термодинамический параметр состояния растворов.
Для описания термодинамического состояния раствора можно использовать следующие параметры T,P,V,состав.
Состав удобнее всего выражать, через число молей ni или мольную долю.
![]()
![]()
Как показывает опыт для полного описания состава раствора достаточно 3-х величин T,P,ni.
Парциальные мольные величины.
П.м.в. i-го компонента, это частная производная от любого экстенсивного свойства раствора по числу молей i – го компонента при условии постоянства T,P и числа молей остальных компонентов.
Ψ-(U,H,S,A,V)
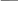
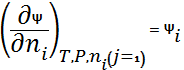
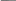
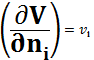
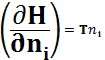

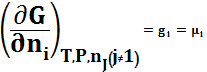
Парциальная мольная энергия Гиббса есть химический потенциал.
Физический смысл.
Если к раствору большему по массе компонентов при T,P=const добавить 1 моль i – го компонента, то полученные изменения экстенсивного свойства вкладом i- го компонента в изменение общего экстенсивного свойства системы.
Основные свойства п.м.в.
1.Не зависят от мольной массы раствора, а зависит только от его состава т.е. при наращивании массы раствора и постоянстве соотношения между числами молей компонентов п.м.в. остаются постоянными.
2.П.м.в. связаны между собой двумя уравнениями:
1) ψ
Оно показывает, что любое экстенсивное свойство раствора может быть найдено путем аддитивного сложения произведений п.м.в. на состав.

2) ![]()
Для п.м.в. компонентов раствора можно применить все термодинамические формулы выведенные для чистых веществ, заменив в них экстенсивные величины но соответствующие парциально – мольные.
![]()


![]()
![]()
