
- •Лекции по физической химии
- •2 Лекция: Законы идеального газа.
- •Энергия. Теплота. Работа.
- •Первый закон термодинамики.
- •Первый принцип термодинамики
- •Теплоёмкость.
- •3 Лекция: Понятие внутренней энергии и энтальпии чистого вещества
- •Термохимия. Энтальпия химических реакций. Закон Гесса
- •Закон Гесса
- •Закон Киркхгоффа
- •Схемы зависимости энтальпий реакций от температуры
- •2Ой Закон термодинамики. Энтропия
- •4 Лекция: 2 закон термодинамики.
- •Постулат Томпсона.
- •Формулировка Оствальда.
- •5 Лекция:
- •Направление процессов открытых многокомпонентных
- •6 Лекция: Фазовое равновесие
- •7 Лекция:
- •8 Лекция:
- •Химическое равновесие
- •Критерий направленности и равновесия в химических реакциях
- •Критерий направленности
- •9 Лекция:
- •10 Лекция: Растворы неэлектролитов. Общие понятия и определения.
- •Межчастичные взаимодействия в растворах.
- •Экспериментальные методы определения парциально – мольных величин.
- •Графический метод.
- •11 Лекция:Основные классы растворов и их термодинамические свойства
- •Совершенные растворы
- •Бесконечно разбавленные растворы
- •Термодинамические свойства бесконечно разбавленного раствора
- •Неидеальные (реальные) растворы
- •Термодинамические условия образования реального раствора
- •1)Равновесие совершенный раствор (пар) Закон Рауля.
- •14 Лекция: Кинетика сложных реакций
6 Лекция: Фазовое равновесие
В результате протекания физико-химических процессов перехода веществ из одной фазы системы в другие при определенных условиях устанавливаются равновесия – фазовые.
Фазовые равновесия могут существовать сколько угодно долго при T,P = const и в каждой фазе концентрация не изменяется. При изменении внешних условий наступает новое состояние равновесия. Возможность изменения числа фаз устанавливается правилом Гиббса.
Правило Гиббса.
Компонент – это химически однородное вещ-во, которое может быть выделено из системы и существовать вне ее сколько угодно долго.
Число независимых компонентов равно числу всех индивидуальных веществ, если в системе не протекает химическая реакция. Если протекает хим реакция, то число независимых компонентов Кн=К-Х К – число всех независимых компонентов, Х – число возможных связей между ними.
СаСО3=СаО+СО2
К=3 Х=1 Кн=2
Фаза – это однородная часть системы, отделенная от других частей поверхностью раздела.
Число степеней свободы или вариантность системы – это число независимых параметров, которые можно в определенных пределах изменять без изменения числа и вида фаз
С=Кн-Ф+2
N=2 – число внешних факторов (температура+давление)
С – число степеней свободы
Ф – число фаз
Условно-вариантная система
Сусл=Кн-Ф+1 T,P = const
С=0 – безвариантная система
Уравнение Клапейрона-Клаузеуса
Оно выражает зависимость давления от температуры при фазовых переходах для одно- двух-фазной системы
µ0(1)i= µ0(2)i
dµ0(1)i= dµ0(2)i
µi0=gi0=-SiodT+VidP
-Sio(1)dT+ Vi0(1)dP=-Sio(2)dT+Vi0(2)dP
Sio(2)dT-Sio(1)dT= Vi0(2)dP- Vi0(1)dP
dP/dT=ΔSi0ф.п./ ΔVi0ф.п=ΔHi0ф.п./Tф.п.*ΔVi0ф.п - уравнение Клапейрона-Клаузеуса в дифференциальной форме.
Применение правила фаз Гиббса и уравнение Клапейрона-Клаузеуса к однокомпонентной системе.
Диаграмма состояния системы – это диаграмма выражающая зависимость состояния системы и фазовых превращений в ней от внешних условий или состава системы. Для однокомпонентной системы Кн=1. Тогда:
С=3-Ф (правило фаз Гиббса для однокомпонентной системы)
Фmin = 1 Cmax=2
Фmax=2 Cmin=1
В однокомпонентной системе возможно следующее равновесие:
тв=жидк (плавление, кристаллизация)
жид=пар (испарение, конденсация)
тв=пар (возгон, сублимация)
Диаграмма состояния чистого вещества
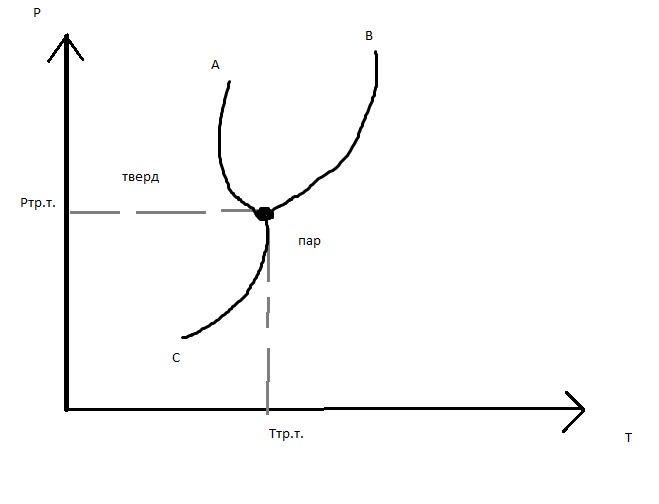
Тр.т. – точка пересечения трех равновесных кривых
0: Ф=3, С=0
1: Ф=2, С=1
2: Ф=1, С=2
Каждая из трех равновесных кривых описывается уравнением Клапейрона-Клаузеуса
(1) ОА: (dP/dT)пл=ΔHi0пл/Тпл(Vi0ж- Vi0тв)
(2) ОВ: (dP/dT)исп= ΔHi0исп /Ткип(Vi0п- Vi0ж)
(3) ОС: (dP/dT)возг=ΔHi0возг/Твозг(Vi0п- Vi0тв)
Все такие фазовые переходы 1го рода (т.е. без изменения состава) можно разделить на 2 группы:
когда мольные объемы сосуществующих фаз мало отличаются друг от друга тв=жид
Hi0пл>0
а) (Vi0ж- Vi0тв)>0 выполняется для большинства в-в
(dP/dT)пл>0
б) (Vi0ж- Vi0тв)<0 выполняется для H2O, Bi, Ga
(dP/dT)пл<0
когда мольные объемы сосущесвтующих фаз несоизмеримы (т.е. когда имеется паровая фаза)
рассмотрим жид=пар
на Ур-ие (2) наклад 2 ограничения:
1) Viп0>>Viж0
2) паровую фазу считать идеальным газом, отсюда Viп=RT/P
(dlnP/dT)исп= ΔHi0кип/RT2
(dP/dT)>0
Начинается в тр.т. и заканчивается в критической
В критической точкн св-ва пара и жидкости становятся неразличимыми:
Кривая возгонки должна начинаться в точке 0: Р=0, Т=0 (экспериментально недостижимо), а заканчиваться – в тр.т.
ΔHi0возг= ΔHi0пл+ ΔHi0кип
Все эти величины >0
Интегрирование уравнения Клапейрона-Клаузеуса (для испарения)
(dP/dT)исп= ΔHi0/Ткип* ΔVi0исп
lnP=- ΔHi0исп /RTкип+const
const= ΔHi0исп /RTкип
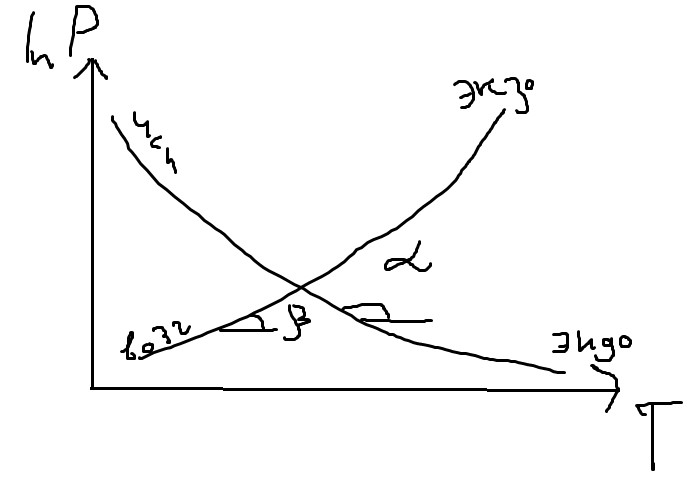
ΔHi0исп=-Rtgα
ΔHi0возг=-Rtgβ
lnP2/P1=ΔHi0исп/R(1/T1-1/T2)
hi0исп,т2= hi0исп,т1+∫t1t2ΔСpdT
hip=- ΔHi0исп/RTкип+∫((∫t1t2ΔСpdT)/RT2кип)+const
Фазовые равновесия в двухкомпонентных системах, содержащих твердую фазу.
В системах, содержащих конденсированные фазы, давление очень мало влияет на состояние равновесия и его не учитывают в формуле правила фаз Гиббса.
Диаграммы плавкости с неограниченной растворимостью компонентов, как в жидком, так и в твердом состоянии.
Такой тип диаграмм обычно образуется близкими по своей природе компонентами.
NaCl-NaBr
Ag-Au
Fe-Ni
Bi-Sb
FeO-MnO и др
Они называются изоморфными вещ-вами
При охлаждении таких систем образуется твердый раствор, т.е. когда атомы одного элемента чередуются с атомами другого в одной кристаллической решетке.
Для изоморфных 2-х компонентных систем диаграмма плавкости имеет следующий вид
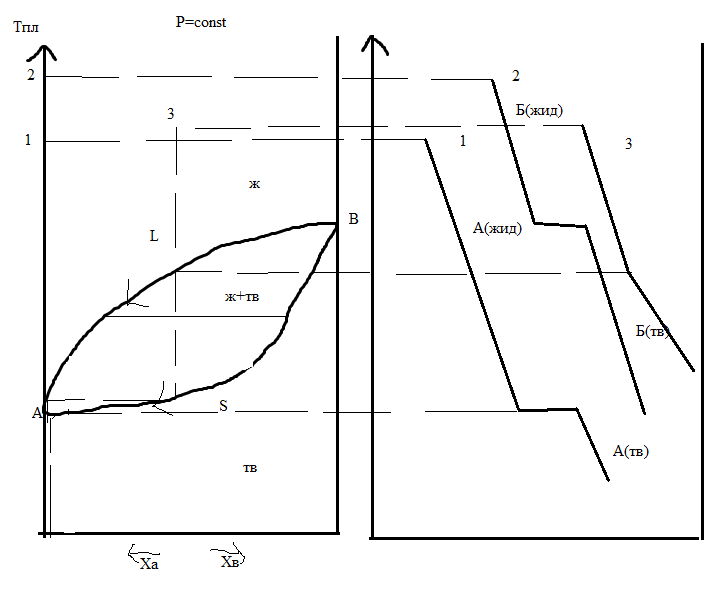
Диаграмма имеет 2 линии, которые делят ее на 3 области. Верхняя линия соответствует началу кристаллизации и называется точкой ликвидуса, нижняя – соответствует концу кристаллизации и называется точкой солидуса.
Берем чистое вещество А и расплавляем до Т1 и начинаем медленно охлаждать до точки А соответственно. Т0пл А. При Т0пл чистое вещ-во, если его медленно охлаждать, будет кристаллизоваться при постоянной температуре. На кривой охлаждения появляется площадка. Температура будет оставаться постоянной пока не исчезнет последняя капля жидкости, а затем будет охлаждаться твердое в-во А.
Сусл(А)=К-Ф+1=1-2+1=0
Рассмотрим в-во В. Протекать будет аналогично.
Возьмем точку 3 при Т’. При T1’ появляются первые кристаллы твердого раствора состава
Определим этот состав.
Надо из точки 1 провести ногу, т.е. прямую, параллельную оси абсциссы, соединяющую составы равновесных фаз. При кристаллизации, как только она началась, выделяется теплота кристаллизации и кривая охлаждения пойдет более полого.
Определим число степеней свободы в точке 1 Сусл(1)=2-2+1=1
Далее состав жидкой фазы меняется по линии ликвидуса, а состав твердой фазы – по линии солидуса. Эти составы будут меняться до тех пор, пока не исчезнет последняя капля жидкости. Температура кристаллизации раствора состава . Т.е. когда состав твердого раствора m совпадет с совпадет с составом взятого для охлаждения расплава l. Соотношение между массами тв и жид фаз для системы в точке 3 при ее охлаждении до температуры T’’ определяется правилом рычага m жид/m тв = Bжидк/Bтв
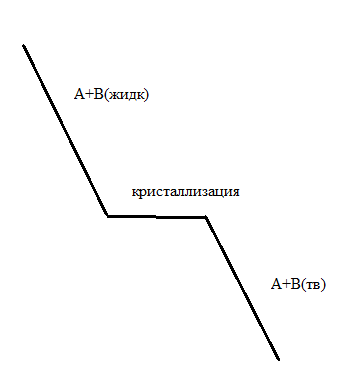
Определение масс равновесных сосуществующих фаз обратно пропорционально отрезкам, на которые делит ноду точка b.
Диаграмма плавкости двухкомпанентной системы с неограниченной растворимостью компонентов в жидком состоянии и полной нерастворимостью в твердом.
Диаграмма плавкости с простой эфтэктикой. Такой тип диаграммы образуют компоненты с сильно отличающейся структурой металлов, неизоморфные в-ва.
KCl-LiCl
NaNO3-KNO3
Pb-Bi
Sn-Bi
Au-Bi
Cd-Bi
CaO-MgO
Главная особенность неизолированных смесей в том, что они в твердом состоянии неоднородны, т.е. состоят из 2х твердых фаз: кристалл в-ва А и кристалл в-ва В. В жидком состоянии они полностью взаиморастворимы.
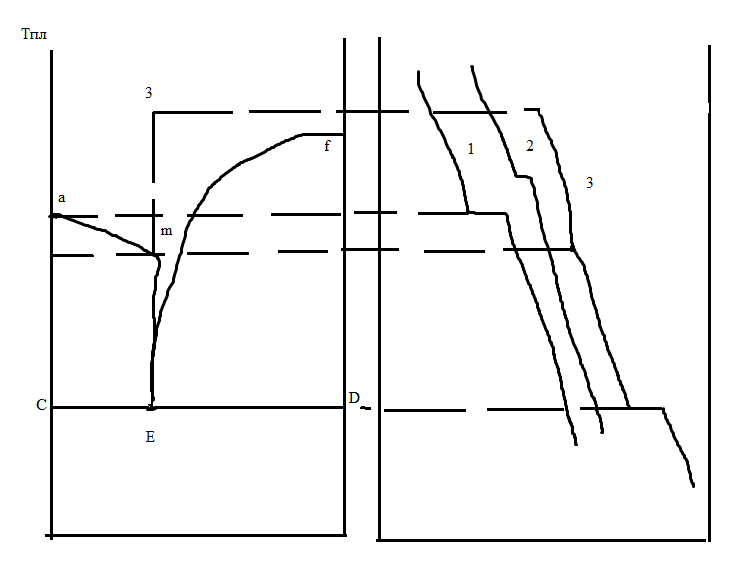
Линия ликвидуса состоит из двух ветвей: , которые сходятся в точке Е. Через точку Е проходит линия солидуса СD. Вся плоскость диаграммы разделена на 4 области: выше линии ликвидуса – жидкий расплав; область aCE – жидкий расплав + кристаллы тв в-ва А; EfD – жидкий расплав + кристаллы тв в-ва B; и ниже линии солидуса – Атв+Втв.
Рассмотрим смесь состава 3.
При медленном охлаждении до точки m мы будем находиться в жидкой фазе; В точке m при начинают выпадать кристаллы чистого вещ-ва А, т.к. смесь состава 3 насыщена больше компонентами А. При выпадении кристаллов А расплав обогащается компонентом В и состав жидкого расплава становится насыщенным компонентом В (меняется по кривой mE). При температуре жидкий расплав становится насыщенным в-вом B и начинают выпадать кристаллы обоих компонентов. Эта температура называется эвтектической, а точка Е – точка эвтектики. При этой температуре в равновесии находятся 3 фазы: жидкий расплав, кристаллы А и кристаллы В. В точке Е – система безвариантна (Сусл(Е)=2-3+1=0, Сусл(3)=2-1+1=2, Сусл(М)=2-2+1=1)
Диаграмма состояния равновесия жидкость/пар в двухкомпонентной системе. Закон Коновалова.
Состав двухкомпонентной смеси определяется T,P и содержанием обоих вещ-в в каждой фазе. На практике такие системы изучаются при T=const или P=const и различают 2 варианта состояния:
при T=const (давление, состав)
при P=const (температура, состав)
Диаграмма имеет следующий вид:

Х2-мольная доля р-ного в-ва
1 – растворитель
2 – растворенное в-во
Р1 – давление чистого растворителя
Р2 – давление чистого растворенного в-ва
Жидк: Р=f(x2, ж)
Прямолинейная зависимость
Пар: Р=f(x2, п)
Криволинейная зависимость
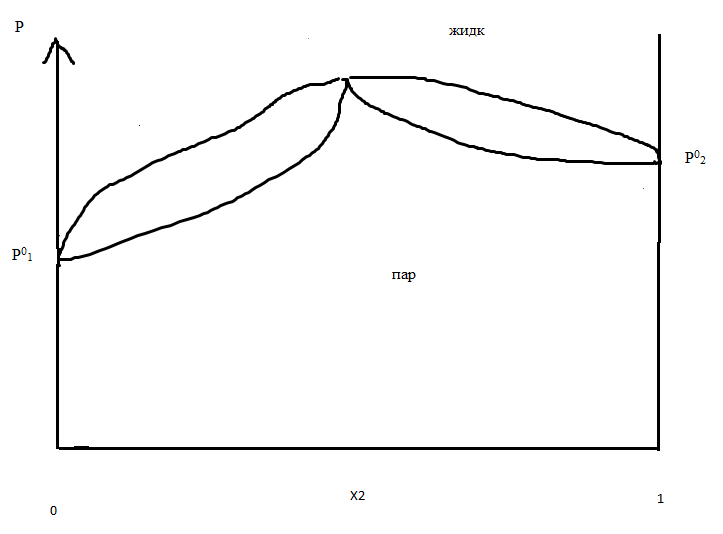
Для реальных растворов существуют диаграммы 3х типов:
I – образуют реальные растворы с незначительным отклонением от идеальности
II и III – образуют реальные растворы со значительным отклонением от идеальности
I тип

II тип

III тип

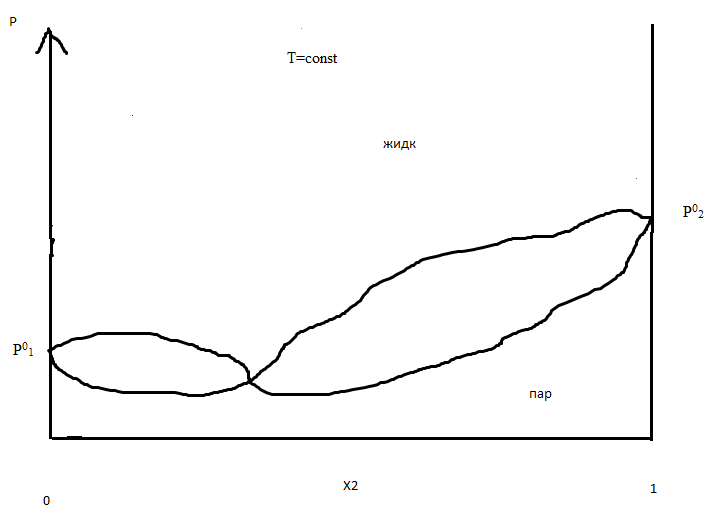
Х2 – мольная доля более легколетучего компонента.
Р01 и Р02 - давление насыщенных паров чистых компонентов 1 и 2 при T=const.
Т01 и Т02 - температура кипения чистых веществ 1 и 2 при p=const
Изобаристические (p=const) диаграммы Tкип, состав чаще всего используются на практике и внешне очень похожи на обратные диаграммы P, состав (T=const)
