
- •Часть III
- •1. Введение
- •1. Введение
- •1.1. Строение кислорода
- •1.2. Химические связи кислорода
- •2. Гидроксисоединения
- •2.1. Спирты
- •2.1.1. Классификация спиртов
- •2.1.2. Номенклатура спиртов
- •2.1.3. Изомерия спиртов
- •2.2. Фенолы
- •2.3. Строение гидроксильной группы
- •Мезомерный эффект он-группы в феноле
- •2.4. Водородные связи и физические свойства
- •2.5. Химические свойства гидроксисоединений
- •2.5.1. Реакции по связи о–н
- •2.5.1.1. Кислотные свойства гидроксисоединений
- •2.5.1.2. Образование сложных эфиров
- •2.5.1.3. Окисление
- •2.5.2. Реакции по связи с–о
- •2.5.2.1. Реакции замещения он-группы
- •2.5.2.2. Реакции дегидратации спиртов
- •2.5.3. Простые эфиры
- •2.5.4. Реакции фенола по бензольному кольцу
- •2.6. Получение спиртов и фенолов
- •2.7. Применение гидроксисоединений
- •2.8. Контрольные вопросы
- •2. Сколько первичных, вторичных и третичных спиртов приведено ниже?
- •3. Альдегиды и кетоны
- •Для перехода к виртуальной (vrml) модели щелкните на нужной картинке.
- •3.1. Номенклатура альдегидов и кетонов
- •3.2. Изомерия альдегидов и кетонов
- •3.4. Реакции альдегидов и кетонов
- •3.4.1. Реакции присоединения по карбонильной группе
- •3.4.2. Реакции полимеризации карбонильных соединений
- •3.4.3. Реакции конденсации карбонильных соединений
- •3.4.4. Реакции восстановления альдегидов и кетонов
- •3.4.5. Реакции окисления альдегидов и кетонов
- •3.5. Получение альдегидов и кетонов
- •3.6. Применение альдегидов и кетонов
- •4.1. Классификация карбоновых кислот
- •4.2. Номенклатура карбоновых кислот
- •Некоторые предельные одноосновные кислоты
- •4.3. Изомерия карбоновых кислот
- •4.4. Строение карбоксильной группы
- •4.5. Функциональные производные карбоновых кислот
- •4.6. Сложные эфиры
- •4.7. Жиры
- •4.8. Контрольные вопросы
- •2. Какая из приведенных структур соответствует молекуле жира?
- •5. Углеводы
- •5.1. Моносахариды
- •Vrml-модели (30589 и 30602 байт)
- •Пространственные формы (конформации) шестичленного цикла
- •5.2. Дисахариды
- •6.2. Полисахариды
- •6.2.1. Крахмал
- •6.2.2. Целлюлоза
- •5.3. Контрольные вопросы
- •1. Какая формула соответствует фруктозе?
- •6. Заключение
2.5.2.2. Реакции дегидратации спиртов
Отщепление воды от молекул спирта (дегидратация спиртов) в зависимости от условий происходит как внутримолекулярная или межмолекулярная реакция.
Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании выше 140 °С. Например:
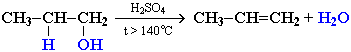
В тех случаях, когда возможны 2 направления реакции, например:

дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного атома углерода).
Реакции элиминирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях дегалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов. Такие алкены обладают более низкой энергией.

Межмолекулярная дегидратация спиртов происходит при температуре ниже 140 °С с образованием простых эфиров:

2.5.3. Простые эфиры
Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'–O–R", где R' и R" - различные или одинаковые радикалы.
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова "эфир". Например, CH3OCH3 - диметиловый эфир; C2H5OCH3 - метилэтиловый эфир.
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов.
![]()
При этом в одной молекуле спирта разрывается связь О-Н, а в другой - связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы). Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода (синтез Вильямсона). Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
C2H5ONa + CH3Cl C2H5OCH3 + NaCl
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–)
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О–Н.
Простые эфиры - малоактивные соединения, они значительно менее реакционноспособны, чем спирты. Хорошо растворяют многие органические вещества и поэтому часто используются как растворители. Наиболее характерные реакции простых эфиров:
разложение под действием концентрированных иодоводородной или бромоводородной кислот
R–O–R' + HI ROH + R'I
образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами
R2O + HCl [R2OH]+Cl-
К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения - этиленоксид (эпоксид) и диоксан.

Диоксан (т. кип. 101С) - хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали "органической водой". Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана. Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Диоксин (2,3,7,8-тетрахлордибензо-п-диоксин)

Это вещество даже в очень низких концентрациях резко снижает иммунитет человека к вирусным инфекциям и влияет на генетический аппарат. Аналогичную опасность представляют и другие полихлорированные дибензо-п-диоксины, называемые просто "диоксинами".
