
- •Часть III
- •1. Введение
- •1. Введение
- •1.1. Строение кислорода
- •1.2. Химические связи кислорода
- •2. Гидроксисоединения
- •2.1. Спирты
- •2.1.1. Классификация спиртов
- •2.1.2. Номенклатура спиртов
- •2.1.3. Изомерия спиртов
- •2.2. Фенолы
- •2.3. Строение гидроксильной группы
- •Мезомерный эффект он-группы в феноле
- •2.4. Водородные связи и физические свойства
- •2.5. Химические свойства гидроксисоединений
- •2.5.1. Реакции по связи о–н
- •2.5.1.1. Кислотные свойства гидроксисоединений
- •2.5.1.2. Образование сложных эфиров
- •2.5.1.3. Окисление
- •2.5.2. Реакции по связи с–о
- •2.5.2.1. Реакции замещения он-группы
- •2.5.2.2. Реакции дегидратации спиртов
- •2.5.3. Простые эфиры
- •2.5.4. Реакции фенола по бензольному кольцу
- •2.6. Получение спиртов и фенолов
- •2.7. Применение гидроксисоединений
- •2.8. Контрольные вопросы
- •2. Сколько первичных, вторичных и третичных спиртов приведено ниже?
- •3. Альдегиды и кетоны
- •Для перехода к виртуальной (vrml) модели щелкните на нужной картинке.
- •3.1. Номенклатура альдегидов и кетонов
- •3.2. Изомерия альдегидов и кетонов
- •3.4. Реакции альдегидов и кетонов
- •3.4.1. Реакции присоединения по карбонильной группе
- •3.4.2. Реакции полимеризации карбонильных соединений
- •3.4.3. Реакции конденсации карбонильных соединений
- •3.4.4. Реакции восстановления альдегидов и кетонов
- •3.4.5. Реакции окисления альдегидов и кетонов
- •3.5. Получение альдегидов и кетонов
- •3.6. Применение альдегидов и кетонов
- •4.1. Классификация карбоновых кислот
- •4.2. Номенклатура карбоновых кислот
- •Некоторые предельные одноосновные кислоты
- •4.3. Изомерия карбоновых кислот
- •4.4. Строение карбоксильной группы
- •4.5. Функциональные производные карбоновых кислот
- •4.6. Сложные эфиры
- •4.7. Жиры
- •4.8. Контрольные вопросы
- •2. Какая из приведенных структур соответствует молекуле жира?
- •5. Углеводы
- •5.1. Моносахариды
- •Vrml-модели (30589 и 30602 байт)
- •Пространственные формы (конформации) шестичленного цикла
- •5.2. Дисахариды
- •6.2. Полисахариды
- •6.2.1. Крахмал
- •6.2.2. Целлюлоза
- •5.3. Контрольные вопросы
- •1. Какая формула соответствует фруктозе?
- •6. Заключение
Для перехода к виртуальной (vrml) модели щелкните на нужной картинке.
3.1. Номенклатура альдегидов и кетонов
Систематические названия альдегидов строят по названию соответствующего углеводорода и добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода.

Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
Формула |
Название |
|
систематическое |
тривиальное |
|
H2C=O |
метаналь |
муравьиный альдегид (формальдегид) |
CH3CH=O |
этаналь |
уксусный альдегид (ацетальдегид) |
(CH3)2CHCH=O |
2-метил-пропаналь |
изомасляный альдегид |
CH3CH=CHCH=O |
бутен-2-аль |
кротоновый альдегид |
Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон (радикально-функциональная номенклатура ИЮПАК). Например:
CH3–CO–CH3 - диметилкетон (ацетон); CH3CH2CH2–CO–CH3 - метилпропилкетон.
В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе (заместительная номенклатура ИЮПАК). Примеры:
CH3–CO–CH3 - пропанон (ацетон); CH3CH2CH2–CO–CH3 - пентанон-2; CH2=CH–CH2–CO–CH3 - пентен-4-он-2.
3.2. Изомерия альдегидов и кетонов
Для альдегидов и кетонов характерна структурная изомерия.
Изомерия альдегидов:
изомерия углеродного скелета, начиная с С4

межклассовая изомерия с кетонами, начиная с С3
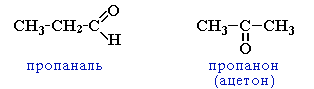
циклическими оксидами (с С2)

непредельными спиртами и простыми эфирами (с С3)

См. пример - изомеры C4H8O, содержащие группу С=О.
Изомерия кетонов:
углеродного скелета (c C5)

положения карбонильной группы (c C5)

межклассовая изомерия (аналогично альдегидам).
Cтруктурные изомеры карбонильных соединений C4H8O анимация –бутаналь-2-метилпропаналь- бутанон -2
3.3. Строение карбонильной группы C=O
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 -связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в -связи С–О, две другие содержат неподеленнные электронные пары.

-Связь образована р-электронами атомов углерода и кислорода.
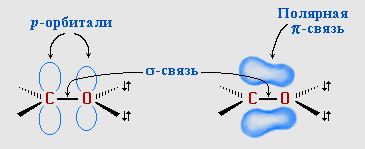
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные -электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд (см. распределение зарядов).

Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+.
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Электрофильные реакции
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные ("любящие электроны") реагенты или электрофилы - это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне. Примеры электрофильных частиц: H+, CH3+ и другие карбокатионы, NO2+, ZnCl2, AlCl3. Незаполненность внешнего электронного уровня в электрофиле показана на примере AlCl3. Электрофильное присоединение: CH2=CH2 + HCl CH3CH2Cl (электрофил - H+ в составе HCl) Стадии: I. CH2=CH2 + HCl CH3CH2+ + Cl (медленная) II. CH3CH2+ + Cl CH3CH2Cl (быстрая)

Механизм электрофильного присоединения обозначается символом AE (по первым буквам английских терминов: A – addition [присоединение], E – electrophile [электрофил]).
Электрофильное замещение: C6H6 + NO2+ C6H5NO2 + H+ (электрофил - NO2+) Катион NO2+ образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма - SE (S – substitution [замещение]).
Заряды на атомах в ацетальдегиде – данные квантово-механического расчета Заряды на -анических расчетов)

