- •Часть III
- •1. Введение
- •1. Введение
- •1.1. Строение кислорода
- •1.2. Химические связи кислорода
- •2. Гидроксисоединения
- •2.1. Спирты
- •2.1.1. Классификация спиртов
- •2.1.2. Номенклатура спиртов
- •2.1.3. Изомерия спиртов
- •2.2. Фенолы
- •2.3. Строение гидроксильной группы
- •Мезомерный эффект он-группы в феноле
- •2.4. Водородные связи и физические свойства
- •2.5. Химические свойства гидроксисоединений
- •2.5.1. Реакции по связи о–н
- •2.5.1.1. Кислотные свойства гидроксисоединений
- •2.5.1.2. Образование сложных эфиров
- •2.5.1.3. Окисление
- •2.5.2. Реакции по связи с–о
- •2.5.2.1. Реакции замещения он-группы
- •2.5.2.2. Реакции дегидратации спиртов
- •2.5.3. Простые эфиры
- •2.5.4. Реакции фенола по бензольному кольцу
- •2.6. Получение спиртов и фенолов
- •2.7. Применение гидроксисоединений
- •2.8. Контрольные вопросы
- •2. Сколько первичных, вторичных и третичных спиртов приведено ниже?
- •3. Альдегиды и кетоны
- •Для перехода к виртуальной (vrml) модели щелкните на нужной картинке.
- •3.1. Номенклатура альдегидов и кетонов
- •3.2. Изомерия альдегидов и кетонов
- •3.4. Реакции альдегидов и кетонов
- •3.4.1. Реакции присоединения по карбонильной группе
- •3.4.2. Реакции полимеризации карбонильных соединений
- •3.4.3. Реакции конденсации карбонильных соединений
- •3.4.4. Реакции восстановления альдегидов и кетонов
- •3.4.5. Реакции окисления альдегидов и кетонов
- •3.5. Получение альдегидов и кетонов
- •3.6. Применение альдегидов и кетонов
- •4.1. Классификация карбоновых кислот
- •4.2. Номенклатура карбоновых кислот
- •Некоторые предельные одноосновные кислоты
- •4.3. Изомерия карбоновых кислот
- •4.4. Строение карбоксильной группы
- •4.5. Функциональные производные карбоновых кислот
- •4.6. Сложные эфиры
- •4.7. Жиры
- •4.8. Контрольные вопросы
- •2. Какая из приведенных структур соответствует молекуле жира?
- •5. Углеводы
- •5.1. Моносахариды
- •Vrml-модели (30589 и 30602 байт)
- •Пространственные формы (конформации) шестичленного цикла
- •5.2. Дисахариды
- •6.2. Полисахариды
- •6.2.1. Крахмал
- •6.2.2. Целлюлоза
- •5.3. Контрольные вопросы
- •1. Какая формула соответствует фруктозе?
- •6. Заключение
2.6. Получение спиртов и фенолов
1. Щелочной гидролиз галогеноуглеводородов:
CH3–Br + NaOH (водн.) CH3–OH + NaBr ClCH2–CH2Cl + 2 NaOH (водн.) HOCH2–CH2OH + 2NaCl C6H5Cl + NaOH (P, 340°С) C6H5OH + NaCl
2. Гидратация алкенов:
CH2=CH2 + H2O (кат.) CH3CH2OH
Присоединение воды к несимметричным алкенам идет по правилу Марковникова с образованием вторичных и третичных спиртов:
CH3–CH=CH2 + H2O (кат.) CH3CH(OH)CH3 (CH3)2C=CH2 + H2O (кат.) (CH3)3C–OH
3. Гликоли получают окислением алкенов щелочным раствором KMnO4:
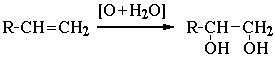
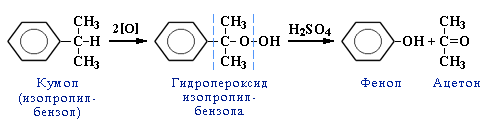
4. Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH–СН3) определяется правилом Марковникова:
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний:
![]()
Эта закономерность была первоначально установлена эмпирически. В современной органической химии дано теоретическое обоснование правила Марковникова на основе положения о влиянии электронного строения молекул на их реакционную способность.
Следует отметить, что правило Марковникова в его классической формулировке соблюдается только для электрофильных реакций самих алкенов. В случае некоторых производных алкенов или при изменении механизма реакции идут против правила Марковникова.
Правило Марковникова объясняется +I-эффектом (положительным индуктивным электронным эффектом) алкильных групп (часть I, раздел 6.4.3.1). Например, в молекуле пропилена СН3–СН=СН2 метильная группа СН3 за счет суммирования небольшой полярности трех С–Н связей является донором электронов и проявляет +I-эффект по отношению к соседним атомам углерода. Это вызывает смещение подвижных -электронов двойной связи в сторону более гидрогенизированного атома углерода (в группе СН2) и появлению на нем частичного отрицательного заряда -:
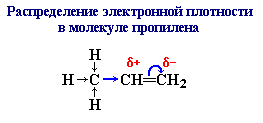
На менее гидрогенизированном атоме углерода (в группе СН) возникает частичный положительный заряд ( +).
Поэтому присоединение электрофильной частицы Н+ происходит к более гидрогенизированному углеродному атому, а электроотрицательная группа Х присоединяется к менее гидрогенизированному атому углерода.
Кроме того, следует учитывать также относительную устойчивость промежуточных частиц (карбокатионов), образующихся на лимитирующей стадии реакции, поскольку реакция идет в том направлении, на котором образуются наиболее устойчивые частицы и, соответственно, более низкая энергия активации (часть I, раздел 6.1.2).

Устойчивость карбокатиона возрастает с увеличением числа алкильных групп, которые за счет +I-эффекта уменьшают положительный заряд на атоме углерода:
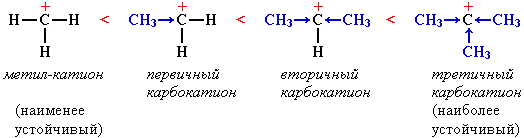
Современная формулировка правила Марковникова:
электрофильное присоединение к двойной связи идет через образование наиболее устойчивого карбокатиона.
Присоединение против правила Марковникова отмечается в случаях, когда заместитель при двойной связи оттягивает электронную плотность на себя, т.е. проявляет электроноакцепторные свойства (–I и/или –М-эффект).
Например, в реакции трихлорпропена Сl3CCH=CH2 с HХ водород присоединяется к менее гидрогенизированному атому углерода, а Х – к более гидрогенизированному. Это обусловлено тем, что группа СCl3 проявляет отрицательный индуктивный эффект и -электронная плотность связи С=С смещена к менее гидрогенизированному атому углерода.
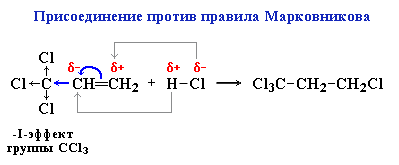
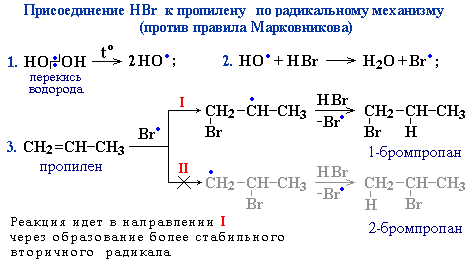
Кроме того, если реакция присоединения идет не по электрофильному, а по радикальному механизму, то правило Марковникова также не соблюдается. Так, реакция HBr с пропиленом в присутствии пероксидов (H2O2 или R2O2), образующих свободно-радикальные частицы (НО или RО), происходит по радикальному механизму и идет против правила Марковникова.