
- •Часть III
- •1. Введение
- •1. Введение
- •1.1. Строение кислорода
- •1.2. Химические связи кислорода
- •2. Гидроксисоединения
- •2.1. Спирты
- •2.1.1. Классификация спиртов
- •2.1.2. Номенклатура спиртов
- •2.1.3. Изомерия спиртов
- •2.2. Фенолы
- •2.3. Строение гидроксильной группы
- •Мезомерный эффект он-группы в феноле
- •2.4. Водородные связи и физические свойства
- •2.5. Химические свойства гидроксисоединений
- •2.5.1. Реакции по связи о–н
- •2.5.1.1. Кислотные свойства гидроксисоединений
- •2.5.1.2. Образование сложных эфиров
- •2.5.1.3. Окисление
- •2.5.2. Реакции по связи с–о
- •2.5.2.1. Реакции замещения он-группы
- •2.5.2.2. Реакции дегидратации спиртов
- •2.5.3. Простые эфиры
- •2.5.4. Реакции фенола по бензольному кольцу
- •2.6. Получение спиртов и фенолов
- •2.7. Применение гидроксисоединений
- •2.8. Контрольные вопросы
- •2. Сколько первичных, вторичных и третичных спиртов приведено ниже?
- •3. Альдегиды и кетоны
- •Для перехода к виртуальной (vrml) модели щелкните на нужной картинке.
- •3.1. Номенклатура альдегидов и кетонов
- •3.2. Изомерия альдегидов и кетонов
- •3.4. Реакции альдегидов и кетонов
- •3.4.1. Реакции присоединения по карбонильной группе
- •3.4.2. Реакции полимеризации карбонильных соединений
- •3.4.3. Реакции конденсации карбонильных соединений
- •3.4.4. Реакции восстановления альдегидов и кетонов
- •3.4.5. Реакции окисления альдегидов и кетонов
- •3.5. Получение альдегидов и кетонов
- •3.6. Применение альдегидов и кетонов
- •4.1. Классификация карбоновых кислот
- •4.2. Номенклатура карбоновых кислот
- •Некоторые предельные одноосновные кислоты
- •4.3. Изомерия карбоновых кислот
- •4.4. Строение карбоксильной группы
- •4.5. Функциональные производные карбоновых кислот
- •4.6. Сложные эфиры
- •4.7. Жиры
- •4.8. Контрольные вопросы
- •2. Какая из приведенных структур соответствует молекуле жира?
- •5. Углеводы
- •5.1. Моносахариды
- •Vrml-модели (30589 и 30602 байт)
- •Пространственные формы (конформации) шестичленного цикла
- •5.2. Дисахариды
- •6.2. Полисахариды
- •6.2.1. Крахмал
- •6.2.2. Целлюлоза
- •5.3. Контрольные вопросы
- •1. Какая формула соответствует фруктозе?
- •6. Заключение
Мезомерный эффект он-группы в феноле
Заряды
на атомах в феноле и метаноле (данные
квантово-механических расчетов)
метаноле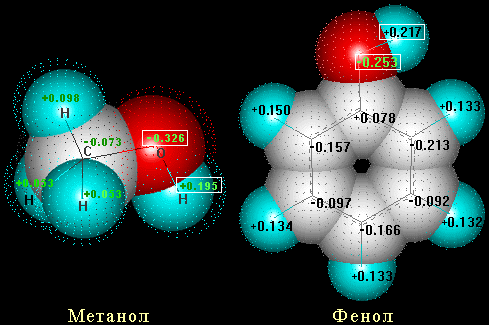
Отрицательный заряд на атоме кислорода в феноле ниже, чем в метаноле, (-0,253 и -0,326 соответственно), а положительный заряд на атоме водорода в гидроксигруппе выше в феноле (+0,217 и +0,195). Следовательно, в феноле должно легче протекать отщепление этого атома водорода в виде Н+.
2.4. Водородные связи и физические свойства
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей (часть I, раздел 4.11).
![]() Ассоциация
молекул ROH
Ассоциация
молекул ROH
Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения (т.кип. метанола +64,5С). При переходе от одноатомных к многоатомным спиртам или фенолам температуры кипения и плавления резко возрастают.
Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
 Гидратация
молекул ROH
Гидратация
молекул ROH
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена.
2.5. Химические свойства гидроксисоединений
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
С–ОН с отщеплением ОН-группы
О–Н с отщеплением водорода.
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона Н+ проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О - свойства основания и нуклеофильного реагента.
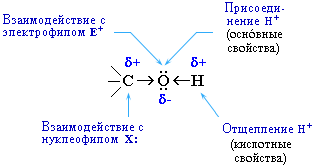
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксисоединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных соединений.
2.5.1. Реакции по связи о–н
К наиболее характерным реакциям гидроксисоединений, идущим с разрывом связи О–Н, относятся:
реакции замещения атома водорода на металл (кислотные свойства);
реакции замещения атома водорода на остаток кислоты (образование сложных эфиров);
реакции отщепления водорода при окислении и дегидрировании.
Легкость этих реакций и строение образующихся продуктов зависят от строения углеводородного радикала и взаимного влияния атомов.
Реакционная способность одноатомных спиртов в реакциях по связи О–Н:
CH3OH > первичные > вторичные > третичные.
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах. Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Фенолы в большинстве реакциий по связи О-Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе -сопряжения).
