
- •Часть III
- •1. Введение
- •1. Введение
- •1.1. Строение кислорода
- •1.2. Химические связи кислорода
- •2. Гидроксисоединения
- •2.1. Спирты
- •2.1.1. Классификация спиртов
- •2.1.2. Номенклатура спиртов
- •2.1.3. Изомерия спиртов
- •2.2. Фенолы
- •2.3. Строение гидроксильной группы
- •Мезомерный эффект он-группы в феноле
- •2.4. Водородные связи и физические свойства
- •2.5. Химические свойства гидроксисоединений
- •2.5.1. Реакции по связи о–н
- •2.5.1.1. Кислотные свойства гидроксисоединений
- •2.5.1.2. Образование сложных эфиров
- •2.5.1.3. Окисление
- •2.5.2. Реакции по связи с–о
- •2.5.2.1. Реакции замещения он-группы
- •2.5.2.2. Реакции дегидратации спиртов
- •2.5.3. Простые эфиры
- •2.5.4. Реакции фенола по бензольному кольцу
- •2.6. Получение спиртов и фенолов
- •2.7. Применение гидроксисоединений
- •2.8. Контрольные вопросы
- •2. Сколько первичных, вторичных и третичных спиртов приведено ниже?
- •3. Альдегиды и кетоны
- •Для перехода к виртуальной (vrml) модели щелкните на нужной картинке.
- •3.1. Номенклатура альдегидов и кетонов
- •3.2. Изомерия альдегидов и кетонов
- •3.4. Реакции альдегидов и кетонов
- •3.4.1. Реакции присоединения по карбонильной группе
- •3.4.2. Реакции полимеризации карбонильных соединений
- •3.4.3. Реакции конденсации карбонильных соединений
- •3.4.4. Реакции восстановления альдегидов и кетонов
- •3.4.5. Реакции окисления альдегидов и кетонов
- •3.5. Получение альдегидов и кетонов
- •3.6. Применение альдегидов и кетонов
- •4.1. Классификация карбоновых кислот
- •4.2. Номенклатура карбоновых кислот
- •Некоторые предельные одноосновные кислоты
- •4.3. Изомерия карбоновых кислот
- •4.4. Строение карбоксильной группы
- •4.5. Функциональные производные карбоновых кислот
- •4.6. Сложные эфиры
- •4.7. Жиры
- •4.8. Контрольные вопросы
- •2. Какая из приведенных структур соответствует молекуле жира?
- •5. Углеводы
- •5.1. Моносахариды
- •Vrml-модели (30589 и 30602 байт)
- •Пространственные формы (конформации) шестичленного цикла
- •5.2. Дисахариды
- •6.2. Полисахариды
- •6.2.1. Крахмал
- •6.2.2. Целлюлоза
- •5.3. Контрольные вопросы
- •1. Какая формула соответствует фруктозе?
- •6. Заключение
2.5.2. Реакции по связи с–о
Наиболее характерные реакции гидроксисоединений, происходящие с разрывом связи С–О:
реакция замещения OH-группы на галоген или другую нуклеофильную группу (RO-, NH2- и т.п.), идущая по механизму нуклеофильного замещения SN;
реакция отщепления (элиминирования) ОН и Н от соседних атомов углерода (внутримолекулярная дегидратация спиртов – образование алкенов);
реакция замещения группы ОН при разрыве связи С–О в одной молекуле и замещения атома Н с разрывом связи О–Н - в другой молекуле гидроксисоединения (межмолекулярная дегидратация – образование простых эфиров).
Реакционная способность спиртов в реакциях по связи С-О: третичные > вторичные > первичные > CH3OH
Для фенолов реакции этого типа не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения
2.5.2.1. Реакции замещения он-группы
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований.

Механизм реакции - нуклеофильное замещение SN.
Нуклеофил – хлорид-анион Cl:– – замещает группу HO:–
( VRML-анимация, 7088 байт).
Данная реакция является одним из способов получения галогеноуглеводородов.
При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы.

Механизм нуклеофильного замещения в спиртах (катализатор - кислота). Сильные кислоты – это доноры протонов (H+):
H2SO4 = H+ + HSO4–
Спирты являются слабыми основаниями (акцепторами протона) за счет неподеленной пары электронов атома кислорода. Поэтому в присутствии сильной минеральной кислоты происходит протонирование спирта (образование донорно-акцепторной связи Н–О):

Далее возможно протекание реакции по одному из двух возможных механизмов. Механизм I. I стадия. Катион алкилгидроксония, отщепляя воду, превращается в карбокатион:

Роль кислоты, таким образом, заключается в превращении ОН-группы в Н2О, которая отщепляется легче, чем анион НО–.
II стадия. Карбокатион вызывает гетеролитический разрыв связи в галогеноводороде и присоединяет галогенид-анион с образованием конечного продукта:
![]()
или
![]()
![]()
Освободившийся H+ идет на протонирование новых молекул спирта.
Механизм II. Другой возможный механизм нуклеофильного замещения заключается в практически одновременном отщеплении воды и присоединении галогена (без образования карбокатиона) и идет в одну стадию.
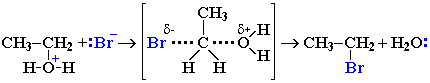
Механизм замещения зависит от строения реагентов и условий реакции. Для третичных спиртов предпочтительней первый механизм, а для первичных - второй. Почему? На стадии, определяющей скорость реакции (так называемой, лимитирующей стадии), в механизме I образуется карбокатион. Чем стабильнее этот катион, тем легче он образуется. Третичный катион стабильнее, чем первичный (три +I-эффекта алкильных групп в третичном катионе и один - в первичном). С другой стороны, энергия переходного состояния в механизме II тем ниже, чем меньше стерические препятствия, т.е. чем меньше алкильных групп у атакуемого атома углерода.
Из другого раздела, поэтому № иной
(ззззззз(((6.3. Понятие о механизме химической реакции
Механизм реакции - детальное ее описание с учетом всех промежуточных стадий и промежуточных веществ, природы взаимодействия реагирующих частиц, характера разрыва связей, изменения энергии химической системы на всем пути ее перехода из исходного в конечное состояние. Цель изучения механизма реакции - возможность управлять ходом реакции, ее направлением и эффективностью.
Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями, а реакции, включающие несколько стадий - сложными. Энергетическая диаграмма простой реакции приведена на рис. 6.3 (а), сложной (двухстадийной) - на рис. 6.3 (б).
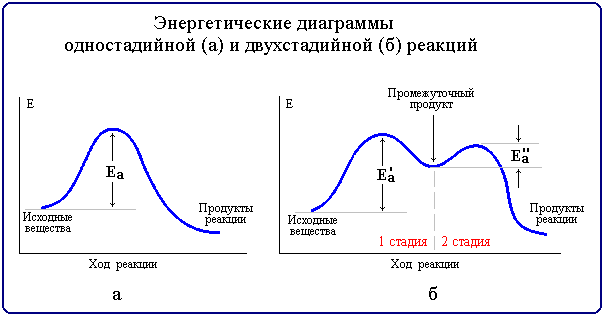 Рис.
6.3. Энергетические диаграммы
Рис.
6.3. Энергетические диаграммы
Многие органические реакции являются сложными и идут в несколько элементарных стадий (последовательных или параллельных). Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии. Например, в приведенной на рис. 6.3,б диаграмме лимитирующей является стадия 1 с более высокой энергией активации Еа'.
В случае сложных реакций на некоторых стадиях образуются нестабильные промежуточные частицы - органические ионы или свободные радикалы. Их относительная устойчивость и, следовательно, вероятность образования растут с увеличением возможности делокализации (рассредоточения) заряда в ионе или неспаренного электрона в радикале.
