
- •Раздел 2
- •Глава 11
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием Расчёты, связанные с приготовлением растворов
- •Расчёты, связанные с титрованием
- •Глава 13
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •Метиловый красный
- •Тимолфталеин (бесцветный синий)
- •Феноловый красный
- •13.3. Кривые титрования
- •0,10 М раствором NaOh
- •Расчёты для построения кривой титрования
- •Расчёты для построения кривой титрования
- •0,10 М Na2co3 0,10 м раствором hCl
- •13.4. Факторы, влияющие на величину скачка титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.2. Критерии выбора растворителя для кислотно-основного титрования
- •14.3. Применение в фармацевтическом анализе Титрование в кислотных растворителях
- •Глава 15
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •1,010-3 М раствором эдта при рН 9,50 в присутствии 510-2 м nh3
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •Глава 16
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •Расчёты для построения кривой титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •Метод Мора
- •Метод Фольгарда
- •Особенность определения хлоридов
- •Особенность определения иодидов
- •Метод Фаянса
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •Титранты и стандартные вещества
- •Обнаружение конечной точки титрования
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
15.3.3. Кривые титрования
Кривая комплексонометрического титрования обычно представляют собой зависимость рM = -lg[M] от степени оттитрованности. В качестве примера рассмотрим кривую титрования 1,010-3 М Zn2+ 1,010-3 М раствором ЭДТА. Титрование проводится в аммиачном буферном растворе, рН которого равен 9,50, а концентрация NH3 – 510-2 моль/л. Поскольку C(NH3) значительно больше С(Zn2+), будем считать, [NH3] С(NH3). Константа образования комплекса ZnY2- равна 3,21016, а её десятичный логарифм – 16,50.
Катион цинка образует аммиачные комплексы, содержащие от 1 до 6 молекул лиганда. Общие константы образования этих комплексов: 1 = 1,5102; 2 = 2,7104; 3 = 8,5106; 4 = 1,2109; 5 = 2,9109; 5 = 5,61012.
![]() =
=
![]()
![]()
![]() =
1,510-1,
=
1,510-1,
![]() .
.
![]() =
=
![]()
До начала титрования
![]()
До точки эквивалентности
![]()
Чтобы
получить формулу для расчёта величины
pZn
в
точке эквивалентности,
воспользуемся выражением
![]() .
.
![]()
где СZn и CY – общие концентрации, соответственно ионов Zn2+ и ЭДТА, образовавшихся при диссоциации комплекса ZnY2-.
С учётом того, что в точке эквивалентности CZn = CЭДТА
![]()
Если принять, что степень диссоциации комплекса ZnY2- пренебрежимо мала, то
![]()
С
учётом того, что
![]() :
:
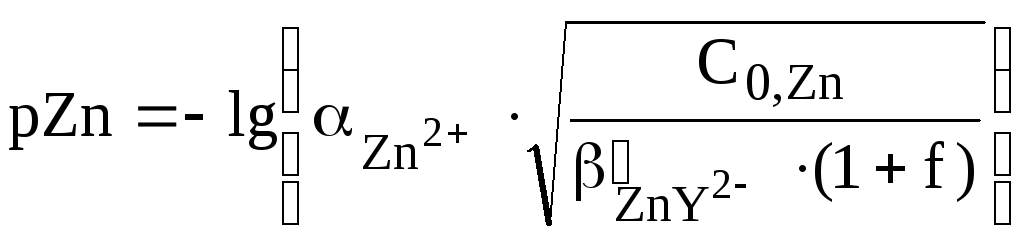 =
=
=
![]()
Для того чтобы получить формулу для расчёта pZn после точки эквивалентности, также воспользуемся формулой, описывающей условную константу образования комплекса.
![]()
Так
как
![]() ,
то
,
то
 =
=
=
![]()
Формулы для расчёта рZn в различных точках кривой титрования и рассчитанные по ним значения рZn приведены в табл. 15.1. Кривая титрования показана на рис. 15.3.
На величину скачка титрования в комплексонометрии влияют (рис. 15.4):
-
исходные концентрации титруемого иона и титранта,
-
устойчивость комплекса катиона металла с ЭДТА,
-
величины
 и
и
 в условиях титрования.
в условиях титрования.
Молярная
доля Y4-
зависит от рН, а величина
![]() – от концентрации комплексообразующего
реагента и устойчивости образующихся
комплексов
– от концентрации комплексообразующего
реагента и устойчивости образующихся
комплексов
Табл. 15.1
Расчёты для построения кривой титрования 1,010-3 М Zn2+
1,010-3 М раствором эдта при рН 9,50 в присутствии 510-2 м nh3
|
f |
Расчётная формула |
pZn |
|
0 |
|
8,00 |
|
0,10 |
|
8,09 |
|
0,50 |
аналогично |
8,48 |
|
0,90 |
аналогично |
9,28 |
|
0,99 |
аналогично |
10,3 |
|
0,999 |
аналогично |
11,3 |
|
1,00 |
|
12,0 |
|
1,001 |
|
12,7 |
|
1,01 |
аналогично |
13,7 |
|
1,10 |
аналогично |
14,7 |
|
1,50 |
аналогично |
15,4 |

Рис. 15.3. Кривая титрования 1,010-3 М Zn2+ 1,010-3 М раствором ЭДТА при рН 9,50 в присутствии 510-1 М NH3


Рис. 15.4. Влияние различных факторов на величину скачка комплексонометрического титрования
А - концентрация титруемого иона (pH 10, Ca2+) - 1) 1,010-4 М; 2) 1,010-2 М;
Б -устойчивость комплекса (рН 10, 1,010-2 М) - 1) Ca2+, 2) Ba2+;
B - pH ( Сa2+, 1,010-2 М) - 1) pH 10; 2) pH 7;
Г – концентрация NH3 (рН 9,5, 1,010-3 М Zn2+) – 1) [NH3] = 110-1 М; 2) [NH3] = 510-2 М
Изменение исходной концентрации титруемого вещества и концентрации вспомогательного реагента (а также и рН, если происходит образование гидроксокомплексов металла) влияют на ход кривых титрования до точки эквивалентности, в то время как pH и устойчивость комплекса – после точки эквивалентности.
Для каждого металла существует определённое значение рН, ниже которого комплексонометрическое титрование с удовлетворительной погрешностью оказывается невозможным.
При начальной концентрации титруемого катиона 110-2 моль/л и допустимой погрешности 0,1% минимальная величина условной константы образования комплекса металла с ЭДТА составит
![]()
Таким
образом, комплексонометрическое
титрование 110-2
М раствора катиона металла с погрешностью
0,1% можно провести при таких значениях
рН, чтобы величина
![]() оставалась
большей 8.
Например, минимальное значение рН для
титрования 110-2
М Ca2+
составляет
7,5, 110-2
М Mg2+
9,8. Комплексонометрическое определение
таких катионов проводят в щелочной
среде. Ионы, образующие очень прочные
комплексы с ЭДТА, можно титровать с
допустимой погрешностью даже в
сильнокислой среде. Например, даже при
рН 1,0 величина
оставалась
большей 8.
Например, минимальное значение рН для
титрования 110-2
М Ca2+
составляет
7,5, 110-2
М Mg2+
9,8. Комплексонометрическое определение
таких катионов проводят в щелочной
среде. Ионы, образующие очень прочные
комплексы с ЭДТА, можно титровать с
допустимой погрешностью даже в
сильнокислой среде. Например, даже при
рН 1,0 величина
![]() остаётся
равной 9,4. Поскольку уже в слабокислой
среде ионы типа Bi3+
или Fe3+
образуют гидроксокомплексы и
малорастворимые гидроксиды, их
комплексонометрическое определение
проводится в сильнокислой среде.
остаётся
равной 9,4. Поскольку уже в слабокислой
среде ионы типа Bi3+
или Fe3+
образуют гидроксокомплексы и
малорастворимые гидроксиды, их
комплексонометрическое определение
проводится в сильнокислой среде.
Ионы
типа Zn2+
или Ni2+
определяют в слабощелочной среде. Для
поддерживания определённого значения
рН используют аммиачный буферный
раствор. Роль буферного раствора
заключается не только в создании
определённого значения рН, но и в
предотвращении выпадения осадков
гидроксидов металлов. Концентрация
NH3
в буферном растворе должна быть такой,
чтобы не происходило образование осадка
гидроксида металла, но при этом
устойчивость комплекса металла с ЭДТА
оставалась бы приемлемой для проведения
титрования. Например, в присутствии 1,0
М NH3
при рН 10,0
![]() =
3,30. Комплексонометрическое определение
Zn2+
с
удовлетворительной погрешностью
оказывается невозможным.
=
3,30. Комплексонометрическое определение
Zn2+
с
удовлетворительной погрешностью
оказывается невозможным.
