
- •Раздел 2
- •Глава 11
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием Расчёты, связанные с приготовлением растворов
- •Расчёты, связанные с титрованием
- •Глава 13
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •Метиловый красный
- •Тимолфталеин (бесцветный синий)
- •Феноловый красный
- •13.3. Кривые титрования
- •0,10 М раствором NaOh
- •Расчёты для построения кривой титрования
- •Расчёты для построения кривой титрования
- •0,10 М Na2co3 0,10 м раствором hCl
- •13.4. Факторы, влияющие на величину скачка титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.2. Критерии выбора растворителя для кислотно-основного титрования
- •14.3. Применение в фармацевтическом анализе Титрование в кислотных растворителях
- •Глава 15
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •1,010-3 М раствором эдта при рН 9,50 в присутствии 510-2 м nh3
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •Глава 16
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •Расчёты для построения кривой титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •Метод Мора
- •Метод Фольгарда
- •Особенность определения хлоридов
- •Особенность определения иодидов
- •Метод Фаянса
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •Титранты и стандартные вещества
- •Обнаружение конечной точки титрования
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
Расчёты для построения кривой титрования
0,10 М Na2co3 0,10 м раствором hCl
|
f |
Компонент, определяющий рН |
Формула для расчёта рН (pKa1 = 6,35; pKa2 = 10,32) |
рН |
|
0 |
слабое основание СO32- |
|
11,7 |
|
0,50 |
буферная смесь HCO3-/CO32- |
|
10,4 |
|
0,90 |
то же |
аналогично |
9,37 |
|
0,95 |
то же |
аналогично |
9,04 |
|
1,00 |
амфолит HCO3- |
|
8,34 |
|
1,05 |
буферная смесь H2CO3/HCO3- |
|
7,63 |
|
1,50 |
то же |
аналогично |
6,35 |
|
1,90 |
то же |
аналогично |
5,40 |
|
1,99 |
то же |
аналогично |
4,45 |
|
2,00 |
слабая кислота H2CO3 |
|
3,91 |
|
2,01 |
сильная кислота |
|
3,48 |
|
2,10 |
то же |
аналогично |
2,48 |

Рис. 13.3 Кривая титрования 0,10 М Na2CO3 0,10 М раствором HCl
13.4. Факторы, влияющие на величину скачка титрования
На величину скачка титрования в кислотно-основном титровании влияют:
-
концентрация титруемого вещества и титранта,
-
сила титруемой кислоты или основания,
-
температура,
-
ионная сила раствора.
Рис.
13.4. Кривые
титрования 0,1М CH3COOH
0,1М NaOH
(1),
0,001М HCl
0,001М NaOH
(2) и 0,1М HCl
0,1М NaOH
(3)

Температура и ионная сила влияют на величину скачка титрования менее заметно, чем концентрация или сила титруемой кислоты или основания. При повышении температуры константа автопротолиза воды увеличивается, поэтому величина скачка кислотно-основного титрования в водном растворе уменьшается. Аналогичным образом влияет на величину скачка титрования ионная сила раствора.
13.5. Погрешности титрования
Методика титриметрического анализа многостадийна, погрешности могут возникать на любой стадии её проведения: при измерении массы навески, объёма приготовленного раствора или аликвоты, при проведении титрования, обнаружении конечной точки титрования. В зависимости от причины возникновения погрешности в титриметрических методах анализа, как и погрешности вообще, могут быть:

К появлению систематических погрешностей в титриметрических методах анализа может приводить:
-
использование неверно градуированной посуды;
-
неправильная техника титрования (слишком быстрое добавление титранта);
-
неточное считывание объёма титранта, израсходованного для титрования;
![]() несовпадение
точки эквивалентности и рТ индикатора.
несовпадение
точки эквивалентности и рТ индикатора.
Погрешности, обусловленные несовпадением точки эквивалентности и рТ индикатора, называются индикаторными.
Индикаторные погрешности в кислотно-основном титровании удобно разделить на 4 вида:

Водородная индикаторная погрешность может возникнуть при недотитровании сильной кислоты (в таком случае погрешность отрицательная) либо когда сильная кислота используется в качестве титранта и добавлена в избытке (положительная погрешность).
![]()
Если концентрации титруемого вещества и титранта одинаковы, то Vконечн = 2V0, тогда
![]()
Гидроксидная погрешность может возникнуть при недотитровании сильного основания (отрицательная погрешность) либо в том случае, когда сильное основание используется в качестве титранта и добавлено в избытке (положительная погрешность).
![]()
Кислотная и основная индикаторные погрешности могут быть только отрицательными (если, конечно, исключить гипотетический случай использования слабой кислоты или основания в качестве титранта).
Величина кислотной погрешности представляет собой молярную долю неоттитрованной кислоты.
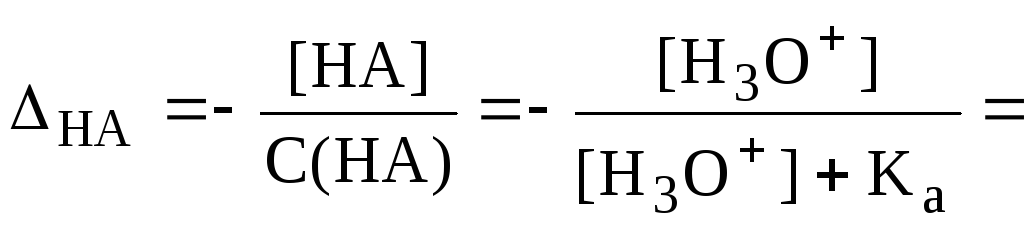
![]()
Если
![]() ,
то
,
то
![]()
Формула для расчёта основной погрешности выводится аналогичным образом и выглядит следующим образом
![]()
или в упрощённом виде
![]()
Пример 13.1. Рассчитать систематическую индикаторную погрешность титрования 0,1 М HCl и 0,1 М HCOOH при использовании в качестве титранта 0,1 М NaOH и индикатора метилового оранжевого (рТ = 4).
В случае HCl титрование заканчивается при рН меньшем (4), чем рН в точке эквивалентности (7), поэтому имеет место водородная индикаторная погрешность. Поскольку в конечной точке титрования определяемое вещество будет недотитровано, величина систематической индикаторной погрешности будет отрицательной
![]()
При титровании HCOOH в конечной точке титрования будет оставаться неоттитрованная слабая кислота, поэтому в данном случае будет кислотная индикаторная погрешность.
![]()
Совершенно очевидно, что метиловый оранжевый не может быть использован для обнаружения конечной точки титрования раствора HCOOH раствором NaOH.
Даже в том случае, если систематическая индикаторная погрешность равна 0 (pHэкв = рТ), всё равно будет иметься случайная погрешность визуального обнаружения конечной точки титрования с помощью индикатора. Вследствие физиологических особенностей нашего зрения рТ индикатора можно определить лишь с неопределённостью примерно 0,4 ед. рН. Величина случайной индикаторной погрешности зависит от крутизны скачка титрования - чем она больше, тем случайная погрешность меньше. Индекс крутизны скачка титрования рассчитывается следующим образом:
![]()
При титровании слабых кислот (оснований) крутизна скачка титрования меньше, следовательно, случайная индикаторная погрешность больше, чем при титровании сильных кислот (оснований) (рис 13.5). Для 0,1 М сильных кислот и оснований величина случайной индикаторной погрешности составляет 210-7. По мере уменьшения силы кислоты (основания) и концентрации случайная погрешность увеличивается.

Рис. 13.5. Влияние крутизны скачка титрования на случайную индикаторную погрешность: 1 – 0,1 М HCOOH; 2 – 0,1 М HCl
В виде полосы показана область неопределённости обнаружения конечной точки титрования для индикатора, имеющего рТ 8

