
- •§ 1Х.7. Неизотермическая кинетика. Определение кинетических параметров
- •Глава X
- •Глава X
- •§ Xl1. Теория активных славна
- •119) К виду
- •Глава XI
- •§ Xl1. Теорий активных столкновений
- •§ XI.2. Теория активированного комплекса или переходного состояния. Теория абсолютных скоростей реакций
- •§ XI.3. Применение к оценке предэксп в элементарных реанаавк
- •§ XI.3. Применение теории абсолютных скоростей реакций к оценке предэкспоненциального множителя в элементарных реакциях
- •§ XI.8. Правило сохранения
- •Глава XII
- •Глава XII
- •§ XI 1.1. Основные понятия кинетики цепных оеакций
- •§ XII.2. Основы теории юшпи
- •§ XII.3. Горение и взрыв
- •Глава XIII
§ XII.3. Горение и взрыв
Горением называют химические реакции окисления, сопровождающиеся свечением и значительным выделением теплоты; к ним относятся, например, реакции соединения углерода с кислородом, водорода с кислородом или 1 хлором и др.
Взрывом называют процесс быстрого выделения энергии, связанного с вне-швгным изменением состояния вещества, в результате чего в среде образуется Щдарная или взрывная волна. При ядерном взрыве совершается мгновенный шереход внутриядерной энергии атомных ядер в кинетическую энергию их [■сколков. Различают цепной и тепловой взрывы.
Цепной взрыв, или воспламенение, наблюдается при протекании цепных реакций с разветвленными цепями. Эти реакции характеризуются верхним я нижним пределами воспламенения, которые зависят от температуры, формы Ьсуда и содержания примесей в газовой смеси. Так, например, для водородно-кислородных смесей при 298 К и общем давлении 1033 гПа нижний предел воспламенения составляет около 6 об.% кислорода, верхний предел — около В5 об.% кислорода. Существуют аналогичные пределы для хлоро-водородных ж других горючих смесей.
Зависимость нижнего и верхнего пределов воспламенения от температуры представлена на рис. XII. 1. Кривая CAB является границей самовоспламенения горючей смеси. Ветвь АВ отвечает нижнему, а ветвь АС — верхнему пределу давления. В заштрихованной области реакция достигает стадии самовоспламенения или взрыва (полуостров воспламенения); вне этой области реакция течет медленно и стационарно. Ниже температуры ТА самовоспламенение не наступает ни при каких давлениях. Температуре Т соответствует нижний предел давления рх и верхний р2, ниже и выше которых самовоспламенение невозможно. Полуостров самовоспламенения характерен для реакций с разветвленными цепями. Если цепная реакция в горючей смеси протекает ниже нижнего предела давления, то цепи не развиваются из-за их обрыва на стенках сосуда. Поэтому нижний предел воспламенения зависит от состава смеси, диаметра сосуда и материала его стенок; от температуры он зависит незначительно. С ростом давления обрыв цепей затрудняется, они сильно разветвляются, реакция идет самоускоряясь и заканчивается самовоспламенением и взрывом. При достижении верхнего предела воспламенения разветвление цепей снова затрудняется из-за их обрыва в объеме в результате тройных столкновений с частицами загрязнений, концентрация которых растет с давлением. Верхний предел воспламенения зависит от температуры, природы и количества примеси и мало зависит от формы сосуда, его диаметра и состояния стенок.
Возникновение цепного воспламенения или взрыва объясняется лавинообразным нарастанием числа активных частиц (свободных радикалов) при постоянной температуре в результате протекания разветвленной цепной реакции.
Тепловой взрыв возникает при обычной (не цепной) экзотермической реакции, когда выделение теплоты при химической реакции становится больше теплоотдачи. При медленном протекании реакции окисления теплота отводится в окружающее пространство и температура в зоне реакции окисления лишь немного выше температуры окружающей среды.
При быстром протекании экзотермических реакций теплота не успевает отводиться в окружающую среду и температура в зоне реакции начинает повышаться. По мере нагревания реагирующих веществ скорость реакции быстро увеличивается, а вместе с этим увеличивается и скорость тепловыделения. Одновременно растет и скорость теплоотдачи, но медленнее, чем скорость тепловыделения. Скорость реакции и, следовательно, скорость
379
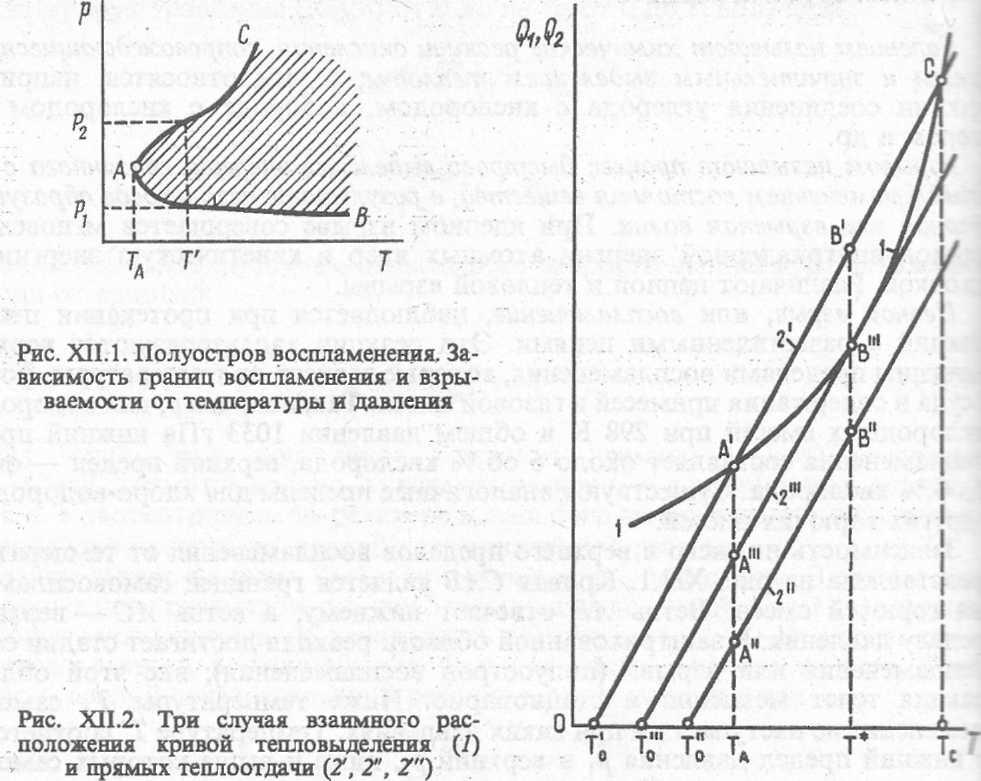
тепловыделения возрастает с повышением температуры по экспоненциала-ному закону (уравнение Аррениуса). Скорость теплоотдачи растет с тем пературой линейно, так как тепловой поток прямо пропорционален градиенту температуры.
На рис. XII.2 представлены три случая взаимного расположения криЕ:1 тепловыделения при протекании реакции (кривая 1) и три возможных расположения кривой теплоотдачи в зависимости от температуры наружи:! стенки реактора 7", Г", Т" (прямые 2', 2" и 2"'). В первом случае (кривые 1 z . при температуре Т< Тл скорость тепловыделения Q больше скорости теплоотдачи Q'2 (Qi>Q2) и температура будет повышаться. В точке А', когда Ох —Я разогрев прекратится, так как при температуре Т> Г4, как видно из графика Qi < Q'i, и система будет охлаждаться. Если ввести в реактор дополнительны! источник теплоты (например, змеевик с паром) и поднять температуру вьггтте Тс, то будем иметь Qi>Q'2 и начнется самопроизвольный разогрев, которые может закончиться воспламенением или взрывом. Во втором случае (i и 2*1 тепловыделение при протекании реакции Qi всегда выше теплоотдачи, и:> этому при любой температуре процесс будет идти с саморазогрев: В третьем случае (1 и 2"') кривая 1 и прямая 2" касаются только в одной точк: В". Температура Т*, соответствующая точке В'", называется температур:-, воспламенения данной реакционной смеси.
Получим выражение для расчета температуры воспламенения Г*. Очевидно, в точке В" ра^з* не только обе рассматриваемые теплоты, но и их производные по температуре:
Qi-Q-2 и -—=~~-йТ dT
!айдем зависимость этих величин от температуры. Скорость тепловыделения, т. е. количество ииоты, выделяемое в единицу времени при протекании реакции, равно
Qx-AHwV,
(101.17)
'ее АН — тепловой эффект реакции (на 1 моль прореагировавшего вещества); w — скорость реакции по этому веществу, т. е. количество вещества, прореагировавшего в единицу времени з единице объема; V — объем реактора. Если в реакторе протекает реакция второго порядка
А+В -» Продукты го скорость образования вещества А или В равна
w= -ксАсв.
(ХП.18)
(MI.I9)
Учитывая зависимость константы скорости к от температуры по уравнению Аррениуса, рюгучаем вместо (XII. 19) выражение
Е -
RT
w-—Ae сАсв.
(ХП.20)
Подставляя уравнение (ХП.20) в (XII.17), получаем для скорости тепловыделения выражение
Е
RT
Qi-Le , (XII .21)
где L= — AHVAcacb и для производной (считая, что L приближенно не зависит от температуры)
dt RT2'
gm.2Z)
Заметим, что в рассматриваемой экзотермической реакции тепловой эффект АН имеет отрицательное значение, поэтому коэффициент L и соответственно Q\ и dgj/d Г —положительные реличивы.
Скорость теплоотдачи через стенки реактора согласно законам теплопередачи равна
С2"«5*(Г-Г2"0),
pai.23)
где s -^—площадь наружной поверхности стенки реактора; а—коэффициент теплопередачи, рав-вый количеству теплоты, которая передается в единицу времени от единицы поверхности стенки в окружающую среду при разности температур в один градус. Производная от QЈ по температуре равна
ш
dE
Приравнивая в соответствии с (XII.16) правые части уравнений (ХП.21) и (XII.23), а также MI.22) и (XII.24) получаем два уравнения с двумя неизвестными 7* и 7*о:
Ы
Е RT*
■ж(Т*-Т0)
(XII .25)
t. кг*
L е
RT*2
(ХИ.26)
рРяпая методом подбора трансцендентное уравнение (XII .26), находим Т*. Температуру стенки гегктора Та можно найти (зная Т*} из уравнения (XII.25) или разделив уравнения (XII.25) на ТрШ.26).
381
R , _ Г0=- t*2~t*. e
(XH.
Как видно из рис. XII.2 и уравнений (XII.25) — (XII.27), температтьj воспламенения 7* зависит от температуры стенки реактора Т0.
азе:
'проран эм, скорость фсг
§ ХП.4. Фотохимические реакции
Фотохимия изучает химические процессы, идущие при воздействии i вещество. Фотохимические реакции называются фотолизом; они могут шаться в твердых, жидких и газообразных телах. Фотохимические возникают под влиянием видимого света, инфракрасных и ультрафиоле лучей с длинами волн от 100 до 1000 нм. Энергия этих квантов равна от 1200 кДж/моль или от 1,2 до 12 эВ. Поглощение энергии электрома колебаний усиливает вращательное движение молекул или колебания ат и атомных групп, составляющих молекулу, и может приводить к возбужде электронов наружных оболочек атомов и появлению активных частиц, действием света протекают многие химические процессы.
В основе фотохимии лежат два закона. Первый закон фотохимия (Гротгуса — Дрепера) гласит, что только поглощаемое средой излучение жет произвести ее химическое превращение. Согласно второму закон фотохимии (Эйнштейна — Штарка) каждый поглощенный квант света в первичном акте способен активировать только одну молекулу. На основе вторе:: закона фотохимии количество энергии Еы, поглощаемой одним молем вещее ва, определяется по уравнению
Поглощенную энеггн:-: £
Ламберта — Веера 1 через слой вещества ■
с /0 — начальная : рфициент иогло ■■сюда поглощенная
1=.
Подставляя уравнение (ХШ.
фотохимической
EM=NAhv=
NAhc
(XII,
Если ес/«1, то 1-е-*" -
где NA — постоянная Авогадро; h — постоянная Планка; v — частота; с -скорость света; X — длина волны.
Если подставить в уравнение (XII .28) числовые значения постоянных А", А и с, то
с'смл
_ 1,196 ИГ* кДж 1,24-10* зВ
x с ■ см3 • моль
Большими энергией и химической активностью обладают колебаши с меньшей длиной волны. В видимом свете наиболее активными являются фиолетовые лучи с 1=400 нм; для них £=297 кДж/моль. Наименее активна, красная часть спектра, где Я=750 нм; для нее £=159 кДж/моль.
Число молей вещества, которое в единицу времени в единице объема активируется под действием радиации и может участвовать в первично:: фотохимической реакции, в соответствии с (XII.28) можно рассчитать с: уравнению
w0=—=—, (XII .29
где Е — световая энергия, которая поглощается единицей объема системы в единицу времени.
При опытной проверке закона фотохимической эквивалентности Эйнштейна — Штарка иногда обнаруживается расхождение между числом частиц которые активируются под действием радиации (числом поглощенных кван-
382
Квантовый выход •/ •поглощаемая молекулами, гае процессы, например на caj [она поглощается молекулами j Квантовый выход может сна [протекания обратного просеет ■вели реакция является цепной. Hj [приводит к появлению активней! [новый выход повышается до am Кроме полного квантового аа ■ого выше, различают еще аш у и который равен откола Волекул в первичной фотохимия Его величину можно оцени: пей, участвующих в первичной 1
А- -л
РШ-25) — (XII.27), температ\т* j ~ш реактора Т0.
в), и числом прореагировавших молекул. Сложность общего течения фото-1ческих реакций зависит от последующих вторичных реакций, идущих без з действия света, в связи с чем для характеристики фотохимических процес-введено понятие квантового выхода у, который равен отношению числа йствительно прореагировавших молекул к числу поглощенных квантов. Таким вбразом, скорость фотохимической реакции определяется по уравнению
Ьаугдие при воздействии света ав кя фотолизом; они могут совет-■елах. Фотохимические реакпжв "трасных и ультрафиолетов»!
этих квантов равна от 120 лг _е энергии электромагнитньзк Ъолекул или колебания атом» **iaxi приводить к возбужденна»! пению активных частиц. Пел процессы.
[ервый закон фотохимии швщаемое средой излучение м:-I Согласно второму зекое щвглощенный квант света в пе:-Щ молекулу. На основе второг: виаемой одним молем вещест
(XII.30)
dc у
w=yw0=—= Е.
' dt N/Jtv
-eel
I=he
Поглощенную энергию Е можно выразить через другие величины. По сону Ламберта — Беера интенсивность / светового потока после прохожде-через слой вещества толщиной / равна
(ХП.31)
(XII.32)
I0 —начальная интенсивность светового потока радиации; б — молярный эффициент поглощения; с — концентрация вещества, поглощающего свет, сюда поглощенная энергия Е равна
E=I0-I=I0(l-e~"')
(ХП.ЗЗ)
Подставляя уравнение (XII.32) в (XII.30), получаем выражение для скоро-фотохимической реакции:
w=—h(\-e ). JVXAv
Планка; v — частота; с — значения постоянных Ищ эВ
С CMJ
обладают колебания ее активными являются ЬДж/моль. Наименее актив ел ■=.59 кДж/моль.
времени в единице объема участвовать в первичной '°>) можно рассчитать по
(XII .29
единицей объема системы
эквивалентности Эйнштей-между числом частил, том поглощенных кван-
Если ес/<с 1, то 1 — е~к'«ес/ и выражение (ХП.ЗЗ) преобразуется к виду
yfot
NAhv
w=kc, (XII.34)
(XII.35)
Квантовый выход у меняется от 10"3 до 106. При у<1 световая энергия, поглощаемая молекулами, частично расходуется ими на какие-нибудь побочные процессы, например на соударения с молекулами другого вещества, или она поглощается молекулами других веществ, не участвующих в реакции. Квантовый выход может снижаться также вследствие самопроизвольного протекания обратного процесса. Отклонения в сторону у>\ наблюдаются, если реакция является цепной- При этом поглощение молекулой одного кванта приводит к появлению активной частицы, вызывающей развитие цепи, и квантовый выход повышается до очень больших значений.
(XII.36)
Кроме полного квантового выхода фотохимического процесса, рассмотренного выше, различают еще квантовый выход первичной фотохимической реакции yi, который равен отношению числа прореагировавших возбужденных молекул в первичной фотохимической реакции к числу поглощенных квантов. Его величину можно оценить, зная константы скорости элементарных реакций, участвующих в первичной фотохимической реакции:
A+hv -> А* -» Продукты
к'
тографируемое
изображав в освещенных местах котсяЯ
A
lis
разующиеся
атомы брома скрытое изображение, так
i
| что внешний вид эму и ■■ более сильному
освенвэвя! айшие частицы серебра шт
дальнейшее
разложение 1 при проявлении, при Оставт
Скорость
изменения концентрации возбужденных
частиц А* равна
dc
—
=
w+1
—
w_j
—
w'-i
—
w2=k+lc—fe_ic*
—
k'-iC*—k2c*,
dt
где
— константа скорости образования
возбужденных частиц под дев ем квантов
света; — константа скорости дезактивации
возбужденных лекул за счет излучательных
переходов, т. е. за счет обратного испу
кванта света; к'-г
—
константа скорости дезактивации за
счет безызлуча ных переходов с
превращением энергии в тепловые формы
движения. Скорость первичной реакции
равна
w2=k2c*.
Неизвестную
концентрацию возбужденных молекул с*
можно
выразить ч концентрацию исходных
молекул из уравнения (XII.37),
если считать прсг стационарным и
dc*/dr=0:
е
предмета, иставтпиися i
ром
гипосульфита натрия. Галогениды серебра
неч?! начиная с зеленого, и этот <
органических красителе* галогенида
серебра, деиаея или другим длинново;
сибилизаторами химической реакции,:
Примером сенсибил
Подставляя
(XII.39) в (XII.38), получаем
k2k+ic
w2--
Скорость
превращения исходных молекул в
возбужденные равна
wQ—k+lc, (XL
Отсюда
квантовый выход первичной фотохимической
реакции равен
и-2 к2
?1-
Очевидно, квантовый выход первичной фотохимической реакции всегда меньше единицы: У\ < 1.
Среди многочисленных фотохимических реакций особое значение имеет реакция ассимиляции углерода растениями, без которой не могла бы существовать жизнь на Земле. Эта реакция может быть записана в виде
6С02+6Н20=СбН1206+602, AG0=2860 кДж
Квантовый выход этой реакции близок к ОД на одну молекулу С02 или С Механизм реакции ассимиляции углерода растениями до сих пор подностыс не выяснен. Несмотря на положительное изменение энергии Гиббса, за реакция протекает в листьях растений благодаря энергии, получаемой извне с: солнца.
Фотография, открытая Ньепсом (1826) и впервые осуществленная Дагер-ром (1839), представляет собой наиболее важное практическое применение фотохимических процессов. В основе фотографического процесса лежит способность галогенидов серебра разлагаться под действием света с выделение* металлического серебра. Светочувствительный слой фотопленки толщиной ст 0,3 до 5 нм представляет собой в основном эмульсию бромида серебра в желатине.
384
разложение. молекулярного
- с длиной: волны 252Д точной величины для в энергия £"=471,5 436 к:Дж/моль. Тем газа ртутной длиной волны. Если ают кванты с длиной ения - молекулам
нормальное состояние, отда ■ого, как они успеют передал Квантовый выход рассмот
ЯЕЦЫ.
Е-К фотохимическим прог. юдразделяется на флуореспенш в хемилюминесценцию.
" § X11S Радиационнс-хим 111' г с i;i
Радиационная химия изучает я ври воздействии на него излучвя ррез -него пучков ионизирукнвв| ывают-радиолнзом. К ноеиэя и у-излучения, а также пучвя
Радио лиз существенно от дни «падающих значительно болы! ■ш- ультрафиолетовые лучи, mm :т внутренних оболочек атоааош высоких энергий с веществом вы аязи между атомами в молекуя ■ободные радикалы, валентнс-я
- 5861
енных частиц А* равна ET-k'-^-kiC*, (XII.31
формы движения.
(XII.38
л с* можно выразить через тт.37), если считать процесс
pfiy iи 11in i 'i Частиц под действЕ ■езахтивации возбужденных мс-за счет обратного испускания —|ттии за счет безызлучатель-
Ь XII
(XII.35
(ХП.40 возбужденные равна
(ХП.41) ■мнческой реакции равен
(ХП.42)
■гохимической реакции всегда
особое значение имеет которой не могла бы суще-записана в виде
=2860 кДж
о дну
молекулу
С02
или
02
до
сих
пор
полностью
энергии
Гиббса,
эта
получаемой
извне
от
дну
молекулу
С02
или
02
до
сих
пор
полностью
энергии
Гиббса,
эта
получаемой
извне
от
осуществленная Дагер-практическое применение _лхого процесса лежит спо-■ействием света с выделением ~ i фотопленки толщиной от гульсию бромида серебра
i Фотографируемое - изображение проектируется на светочувствительный ■ой, в освещенных местах которого идет фотохимическая реакция:'
AgBr+Av -»Ag+Br
Образующиеся атомы брома связываются желатиной, а атомы серебра скрытое изображение, так как количество выделившегося серебра так ю, что внешний вид эмульсии не изменяется. Те участки, которые подвер-более сильному освещению, содержат больше выделившегося серебра. Мельчайшие частицы серебра являются зародышами новой фазы, облегчаю-лщми дальнейшее разложение бромида серебра под действием восстановителей при проявлении, при котором получается видимое (негативное) изображение предмета. Оставшийся неразложенным бромид серебра удаляется раствором гипосульфита натрия.
Галогениды серебра нечувствительны к длинноволновым участкам епект-! ра, начиная с зеленого.; и этот свет ими не поглощается. Добавление соответствующих органических красителей — сенсибилизаторов, адсорбирующихся на зернах галогенида серебра, делает светочувствительный слой восприимчивым к тем или другим длинноволновым участкам спектра.
Сенсибилизаторами называются вещества, которые сами не участвуют Ь фотохимической реакции, но поглощают кванты света и передают их реагентам. Примером сенсибилизированной реакции может служить фотохимическое разложение молекулярного водорода в присутствии паров ртути. Ртутная линия, с.. дяиной.'.'.волны 252,7 нм в спектре ртутной лампы имеет квант достаточной величины для расщепления молекул водорода. Для моля этих квантов энергия £=471,5 кДж, тогда как энергия связи молекул водорода вна-436 к Дж/моль. Тем не.менее- -молекулыводорода не разлагаются при газа ртутной лампой, так как они не поглощают кванты света с такой длиной волны. Если прибавить к водороду пары ртути, то последние поглощают кванты с длиной волны 252,7 нм и затем передают энергию возбуждения-молекулам:водорода, которые распадаются на атомы. Значительное число атомов ртути из возбужденного состояния переходят обратно | нормальное состояние, отдавая квант света в виде резонансного свечения до Itoro, как они успеют передать энергию возбуждения молекулам водорода. Квантовый выход рассмотренной сенсибилизированной реакции меньше единицы.
К фотохимическим процессам относится также люминесценция, которая подразделяется на флуоресценцию (фотолюминесценцию), фосфоресценцию и хемилюминесцещ^йЮ. V.. ' v., :.?■-<-.>-
3'~ХП.5/Радиационне~химичеекие реакции
Радиационная химия изучает химические реакции, протекающие в веществе при воздействии на него излучений высоких энергий, т. е. при прохождении через него пучков ионизирующих частиц. Радиационно-химические реакции называют радиолизоМ. К ионизирующим излучениям относятся рентгеновское и у-излучения, а также пучки электронов, протонов, нейтронов, а-частиц
":- Р'адиолиз- существенно- отличается от фотолиза. Поглощение излучений, обладающих-значительно большей энергией, чем видимые,. инфракрасные или ультрафиолетовые лучи, вызывает возбуждение или отрыв электронов от внутренних оболочек атомов.-Первичный акт взаимодействия излучений высоких энергий с веществом вызывает ионизацию вещества, что разрушает связи ^между- атомами в молекулах и образует химически активные, частицы: свободные радикалы, вапеатао-ненасьпценные атомы, ноны и возбужденные
! 25-5861 385
I
Щл
и свойствам.
Излучения высоких энергий обладают сильным химическим действия*! однако различие и специфика их действия большей частью обусловлю! вторичными процессами, так как первичными являются процессы отдел; лз или возбуждения внутренних электронов. Например, при воздействии щ вещество а-частиц последние захватывают электроны, в результате чего :т разуются электронейтральные атомы гелия и однозарядные ионы. При взэяв модействии вещества с у-излучением, имеющим длины волн от 0,15 до СЛкя нм и соответствующие им энергии от 0,8'104 до 1,2 • 10е эВ, происходя! сильная ионизация вещества. Рентгеновское излучение действует аналогия! у-из л учению. Нейтроны, проходя через вещество, взаимодействуют с ядрл*Я1 и сливаются с ними с образованием изотопов, которые в свою очерон в результате распада могут дать новые элементы.
В качестве единицы дозы в настоящее время принята величина, называемая грей. Один грэй равен одному джоулю поглощенной энергии на один гтнн грамм вещества. Для рентгеновского и гамма излучений применяется такяя единица рентген. 1 грэй для живой ткани приблизительно соответствует Щ рентген. Радиационно-химические процессы весьма сложны и механизм их т многих случаях неизвестен.
Рассмотрим процессы радиолиза воды и водных растворов. При дейеттяяв излучений высоких энергий на воду происходит суммарная реакция
2Н20 = H202+H2; H202=H20 + V202
Первичное химическое действие излучения на воду приводит к образованна свободного радикала гидроксида и атома водорода по схеме
н2о=бн+н
Если вода облучается а-частицами или протонами и электронами малтя энергии, то большое число радикалов возникает вдоль пути частиц. Реагиг i друг с другом, радикалы могут образовать водород, пероксид водорода и воду:
Н+Н=Н2; 6н+бн = Н202; Н+ОН=Н20
Если в воде содержится растворенный из воздуха кислород, то это приводил к образованию радикалов Н02 по реакции
н+о2=но2
Эти радикалы вступают в реакцию с пероксидом водорода и гидроксилом:
Н02+Н202 = Н20 + 02+ОН; Н02+ОН=Н20 + 02
Многие окислительно-восстановительные реакции, протекающие в водных] растворах под действием излучений высоких энергий, можно объяснить образованием радикалов Й, ОН и Й02. В присутствии, например, анионов бро?... происходят следующие реакции:
Вг-+6н-.Вг+0Н~; Вг+Н=Вг~+Н+
При облучении раствора Fe(HS04)2 в отсутствие кислорода воздуха протекает реакция
386
Fe1--:
присутствии растворе не: :: а радикалов Н02 по схеме
Fe2-+QHJ
рбразование свободных :•:, происходящее при облучея явации стирола, акрилонвтрж бензола и т. п. Под дейсш ■мерах увеличивается числе» i гойкость полимера.
