
Общие свойства растворов
.docxКоллигативные свойства растворов
Коллигативными (общими) свойствами раствора являются те свойства, которые зависят от природы растворителя и концентрации растворенного вещества, но не зависят от свойств самого растворенного вещества. К ним относятся:
-
Относительное понижение давления насыщенного пара растворителя над раствором.
-
Увеличение температуры кипения раствора по сравнению с чистым растворителем.
-
Уменьшение температуры замерзания раствора по сравнению с чистым растворителем.
-
Осмотическое давление.
Первое свойство характеризует закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором по сравнению с чистым растворителем пропорционально мольной доле растворенного вещества. Данная формулировка закона Рауля справедлива для растворов неэлектролитов.
Рассмотрим разбавленный двухкомпонентный раствор, состоящий из растворителя (воды) и нелетучего растворенного вещества. Тогда математическое выражение закона Рауля имеет вид
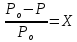 ,
,
где
Ро
– давление насыщенного пара растворителя
над раствором

Р
– давление насыщенного пара растворителя
над чистым растворителем
Ро – Р = ∆Р – абсолютное понижение давления;
Х
=
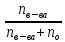 – мольная доля растворенного вещества.
– мольная доля растворенного вещества.
Выразив Р через Ро и Х, получим вторую форму записи закона Рауля
Р = Ро – Ро·Х = Ро·(1 – Х) = Ро·Хо.
Понижение давления пара вызывает изменение в температурах кипения и кристаллизации раствора, что видно из фазовой диаграммы воды и водного раствора, на которой сплошная линия AD соответствует нахождению в равновесии твердого растворителя и пара, линия DЕ – жидкого растворителя и пара, линия DB – твердого растворителя и жидкого растворителя. Пунктирные линии соответственно для раствора.
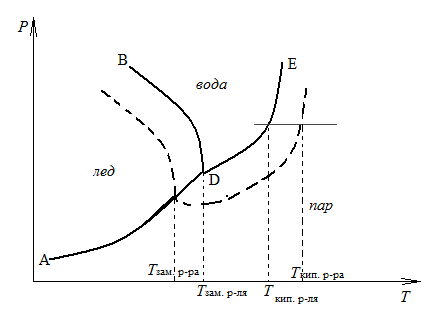
Это отражают следствия из закона Рауля:
-
Увеличение температуры кипения раствора по сравнению с чистым растворителем пропорционально моляльной концентрации растворенного вещества
∆Ткип ~ Сm.
Коэффициентом пропорциональности является эбуллиоскопическая постоянная растворителя Е
∆Ткип = ЕСm,
∆Ткип = Т кип. р-ра – Т о кип.
Физический смысл Е: эбуллиоскопическая постоянная одномоляльного раствора численно равна ∆Ткип.
Е
=
 [
[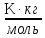 ].
].
-
Уменьшение температуры замерзания раствора по сравнению с чистым растворителем пропорционально моляльной концентрации растворенного вещества
∆Тзам ~ Сm,
∆Тзам = Т о пл– Т пл. р-ра.
Коэффициентом пропорциональности является криоскопическая постоянная растворителя K
∆Тзам = KСm,
Физический смысл K: криоскопическая постоянная одномоляльного раствора численно равна ∆Тзам.
K
=
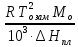 [
[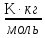 ].
].
Закон Рауля и его следствия в таком виде для растворов электролитов не соблюдаются.
Также было замечено, что компоненты раствора обладают способностью к диффузии. Можно создать такие условия, при которых диффузия идет только в одном направлении. Например, если раствор и растворитель разделить полупроницаемой перегородкой (пленка растительного или животного происхождения; например, пергамент, целлофан), через которую могут переходить только молекулы растворителя
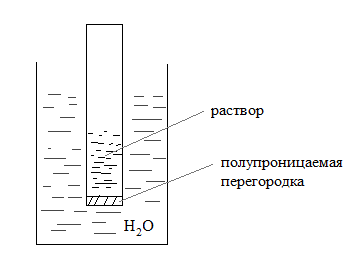
Процесс самопроизвольного перехода растворителя в раствор через полупроницаемую перегородку называется осмосом.
По мере диффузии растворителя через полупроницаемую перегородку объем раствора в малом сосуде возрастает, и давление на перегородку со стороны раствора увеличивается. Таким образом, возникает сила (гидростатическое давление), препятствующая дальнейшей диффузии растворителя через пергородку, которая называется осмотическим давлением π.
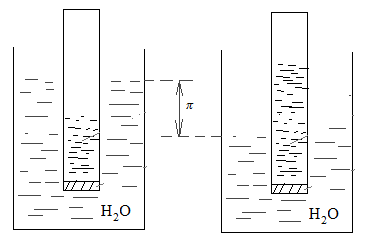
Вант-Гофф показал, что для разбавленных растворов неэлектролитов осмотическое давление не зависит от природы растворителя и растворенного вещества, и определяется соотношением:
π = CRT.
Осмос играет большое значение для растительных и животных организмов. Он обеспечивает движение воды в растениях и подъем ее от корней до вершин. В организмах животных некоторые типы клеток (эритроциты) содержат солевой раствор и ограничены плазматической мембраной. В водной среде эритроциты подвергаются осмосу, набухают и лопаются. Однако, если они попадают в более концентрированный раствор соли, клетки сморщиваются.
Если давление, приложенное к концентрированному раствору, превышает осмотическое давление, то растворитель переходит из концентрированного раствора в разбавленный. Данный процесс называется обратным осмосом. Он находит широкое применение с целью получения питьевой воды из морской.
Осмотическое давление растворов очень велико: при нормальных условиях для идеальных 1М растворов оно составляет 22,4 атм. Растворы, имеющие одинаковое значение осмотического давления, называются изотоническими.
Закон Рауля и его следствия, закон Вант-Гоффа, в том виде, в каком они записаны для растворов неэлектролитов, для растворов электролитов не действуют. Причем, растворы сильных электролитов имеют большие отклонения по сравнению со слабыми электролитами.
Вант-Гофф предложил для растворов электролитов использовать выражения для растворов неэлектролитов, но ввести поправочный коэффициент i,− коэффициент диссоциации Вант-Гоффа (изотонический коэффициент, коэффициент увеличения числа частиц):
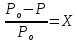 ·i,
·i,
∆Ткип = ЕСm·i,
∆Тзам = KСm·i,
π = CRT·i.
Изотонический коэффициент принимает значения больше или равные единице, но чаще имеет дробные значения. Это говорит о том, что электролит диссоциирует на ионы не полностью.
Рассмотрим процесс диссоциации соли
KatxAny ⇄ xKaty+ + yAnx−.
Если концентрация электролита, распавшегося на ионы, составляет αС0, то не распалось на ионы − С0(1 − α). В результате диссоциации образовалось xαС0 катионов и yαС0 анионов. Тогда общее число частиц в растворе
xαС0 + yαС0 + С0(1 − α) = С0 · (xα + yα + 1 – α)
i
=
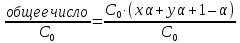 = α(x
+
y
−
1) + 1 = α(n
−
1) + 1,
= α(x
+
y
−
1) + 1 = α(n
−
1) + 1,
где n – число частиц, на которые диссоциирует молекула электролита.
Например, n(AlCl3) = 4.
Сильные электролиты диссоциируют полностью, в результате в растворе оказывается много сольватированных ионов противоположного знака. При этом ионы подходят друг к другу на близкое расстояние и образуют так называемую ионную пару. В этом случае говорят о кажущейся степени диссоциации.
