
- •§ 1Х.7. Неизотермическая кинетика. Определение кинетических параметров
- •Глава X
- •Глава X
- •§ Xl1. Теория активных славна
- •119) К виду
- •Глава XI
- •§ Xl1. Теорий активных столкновений
- •§ XI.2. Теория активированного комплекса или переходного состояния. Теория абсолютных скоростей реакций
- •§ XI.3. Применение к оценке предэксп в элементарных реанаавк
- •§ XI.3. Применение теории абсолютных скоростей реакций к оценке предэкспоненциального множителя в элементарных реакциях
- •§ XI.8. Правило сохранения
- •Глава XII
- •Глава XII
- •§ XI 1.1. Основные понятия кинетики цепных оеакций
- •§ XII.2. Основы теории юшпи
- •§ XII.3. Горение и взрыв
- •Глава XIII
Глава XIII
КИНЕТИКА ГЕТЕРОГЕННЫХ РЕ
| ХШ.1. Гетерогенные процессы яри нестационарной диффуэаш
1
гтерогенные процессы гдхгя ржить
процессы растворении, а ркяе реакции
на границе дв;-ектрод — раствор злехт:
есы
протекают
на границе шя
ердая
— жидкая, твердая — галс кюразная.
Пусть твердое яплт.
■
Ibdm
в
растворе В (р-р) с образав
такого типа реакциям относим эм магния и раствором солавая
MgO (т)+2Ш|
. реакция протекает на грал Гетерогенный процесс составят IC1) из раствора к поверхно: на поверхности твердого телаи убь раствора. Могут быть я j ческое превращение исхлввв! эциация молекул, изменение св зческие превращения вряя пексообразование, рекхиабявя, щя из этих стадий мс: астанту скорости и оказыв: грим гетерогенный пропе реакционной границе фаз. Доставка вещества к граинве конвекции и диффузии. Коавв яелом. Конвекция раствора ш : исходить из-за разной пдотап
оольшого числа различных ему строению, устойчивостж
химическим действием юй частью обусловлены гея процессы отделения I ;р, при воздействии ни] в результате чего ос-арядные ионы. При взан-длины волн от 0,15 до ОД 1 до 1,2- 10б эВ, происходит чение действует аналогичи: взаимодействуют с ядрами , которые в свою очередь
га величина, называема! зой энергии на один киле-злучений применяется так>_: гельно соответствует 10С сложны и механизм их вс
растворов. При действии ! суммарная реакция
>+V202
аду приводит к образовашс-: по схеме
и электронами малег | вдоль пути частиц. Реагируя Юрод, пероксид водородя
-ОН = Н20 кислород, то это приводит
: водорода и гидроксилом:
^6н=н2о+о2
| протекающие в водных i, можно объяснить об-, например, анионов брома
tir-+H+
кислорода воздуха проте-
Fe2++OH=Fe3++OH-
В присутствии растворенного кислорода эта реакция протекает с образованием радикалов Н02 по схеме
Fe2 + + ОН + Чг02=Fe3 + + Н02
Образование свободных радикалов и атомов с ненасыщенной валентностью, происходящее при облучении, было использовано для процессов полимеризации стирола, акрилонитрила и других веществ, для получения дифенила бензола и т. п. Под действием у-излучения в полиэтилене и в других ■юлимерах увеличивается число поперечных связей, что повышает прочность ж стойкость полимера.
Глава ХШ
КИНЕТИКА ГЕТЕРОГЕННЫХ РЕАКЦИЙ
§ ХШ.1. Гетерогенные процессы при нестационарной диффузии
Гетерогенные процессы протекают на границе двух фаз. Примерами могут служить процессы растворения, кристаллизации, испарения, конденсации, химические реакции на границе двух фаз, электрохимические процессы на границе электрод — раствор электролита и гетерогенный катализ. Гетерогенные процессы протекают на границе между разными фазами: твердая — твердая, твердая — жидкая, твердая — газообразная, жидкая -- жидкая, жидкая — газообразная. Пусть твердое вещество А (т) реагирует на поверхности с веще-[ством в растворе В (р-р) с образованием продукта АВ (р-р) в растворе:
А(т)+В(р-р)->АВ(р-р)
К такого типа реакциям относится, например, реакция между твердым оксидом магния и раствором соляной кислоты:
MgO (т)+2НС1 (p-p)-MgCl2 (р-р)+Н20
; Эта реакция протекает на границе фаз MgO (т) — раствор.
Гетерогенный процесс состоит из нескольких стадий: доставка реагента (НС1) из раствора к поверхности твердого тела, собственно химическая реакция на поверхности твердого тела и отвод продуктов реакции от поверхности в глубь раствора. Могут быть и другие стадии. Например, дополнительное химическое превращение исходного вещества в растворе: ассоциация или диссоциация молекул, изменение состава компонента и т. п.; или дополнительные химические превращения продукта реакции у поверхности твердого тела: комплексообразование, рекомбинация, димеризация, протонизация и т. п. Каждая из этих стадий может быть лимитирующей, т. е. иметь самую малую константу скорости и оказывать наибольшее сопротивление процессу. Рассмотрим гетерогенный процесс, лимитируемый стадией доставки вещества к реакционной границе фаз.
Доставка вещества к границе между фазами может осуществляться за счет конвекции и диффузии. Конвекцией называется перемещение всей среды з целом. Конвекция раствора на границе с твердой поверхностью может эоисходить из-за разной плотности раствора в объеме раствора и вблизи
25* 387
поверхности твердого тела, что вызывается неодинаковой концентрацией температурой раствора. Конвекцию можно создавать также перемещев твердого тела в растворе или раствора вблизи поверхности твердого (вращение твердого тела, перемешивание раствора).
Диффузией называется перемещение молекул вещества в неподв* среде под влиянием градиента концентрации. Скорость диффузии —это кс Чество вещества, проходящее через данное поперечное сечение в едв времени. Количественные закономерности диффузии описываются двумя у нениями Фика. Согласно первому уравнению Фика скорость диффузии пропорциональна площади s поперечного сечения и градиенту концентра dc/dx:
dm „ dc ■- —=Ds—, .
■'-л ^ : &r dx . '
где D — коэффициент пропорциональности, называемый коэффициентом \
фузии, м2/с. Если принять $=1 м2 и dc]dx== 1 моль/м4, то D=—-—-.
■ ' ■■■•-*'■■'■'■■> "■ . s(dc/dx)
образом, коэффициент диффузии равен скорости диффузии через сече! равное 1 м2 при градиенте концентрации равном 1 моль/м4.
В уравнении (XIII. 1) предполагается, что вещество диффундирует в напр лении, противоположном направлению оси х, поэтому производная dcj положительна: с уменьшением х концентрация с также уменьшается.
С увеличением температуры коэффициент диффузии вещества в растве растет, так как вязкость растворителя уменьшается. Зависимость коэфф* та диффузии от температурь! можно получить следующим образом. Дина ческая вязкость экспоненциально зависит от температуры:
:г';
' '■ • ----• Ш
где п0 — коэффициент, который приближено можно считать не зависящим I температуры; Еп — энергия активации вязкого течения жидкости. Для завис мости между коэффициентом диффузии и коэффициентом сопротивления Э1 штейн получил приближенное соотношение:
- 9
Г
Еторов, в частности от темпера! 1Я (XIII.5) (считая приближение
D = ft
lnD=MJ
D:=-
I Опыт подтверждает линейную ратуры на 1 К коэффициент диффузией Второе уравнение Фика можно выпев Кения 1м на расстоянии dx друг orj рвое сечение равна Ddc/dx, то через i правлению диффузии вещества) они Щ
.стояние dx частица пройдет (пролввр -Отсюда изменение концентрации ~ •единицу времени равно (для юложном х}:
де
D — dc £ж
" dt~~
i:
выражение (XIII. 10) называете s =т Если диффузия происходит в прес Шлет вид
где г—коэффициент сопротивления (т. е. коэффициент пропорциональнс между силой, действующей на движущееся тело, и его скоростью). Для радиусом R, который перемещается в непрерывной среде, Стоке полу выражение
г=6пАп. , (XIII
Подставив уравнение (XIII.4) в (ХШ.З), получаем уравнение Стокса ~ Тейна: т" .. ~„.../
rt ..
D=-
6nib,NA
Несмотря на то что движение молекулы в растворе довольно силы отличается от движения шара в непрерывной среде, уравнение (XIII.5) я] статочно хорошо передает зависимость коэффициента диффузии от ра
388
У2е=3
j У2 — оператор Лапласа. Задавая начальные и граничные тя орого уравнения Фика (XIII. 10 из эрости гетерогенного процесса, длин Различают диффузию линейную и и ченную; стационарную и нестацштщ одном направлении, пространствеиви) зывается бесконечной, если фрсев] не успевает достигнуть гр
![]() овой
концентрацией ть также перемещеЕ
поверхности
твердого
т&
I)-
овой
концентрацией ть также перемещеЕ
поверхности
твердого
т&
I)-
to вещества в неподвижва
Ьость диффузии это ко j
■еречное сечение в един! ни описываются двумя ypaj ка скорость диффузии dm ш и градиенту концентра!
(Ш.Ь) (ХШ.7)
СХП1.8)
КТОров, в частности от температуры. Учитывая (XIII.2) получаем из ур»-шя (XIII.5) (считая приближенно EdkE4):
D=Due ,
ed l
lnD=lnЈ>o--r; ~» rt
rt
■аемый коэффициентом ди: Ьль/м , т0 D~s(dc[ix)
жк диффузии через сечеь |1 моль/м4.
ктво диффундирует в напр ■юэтому производная dc/d ракже уменьшается, рузии вещества в раствор. . Зависимость коэффицне; сдуюшим образом. Дина эатуры:
рай.
ю считать не зависящим гения жидкости. Для завис* гентом сопротивления 3i
■ Опыт подтверждает линейную зависимость \x\D — I/Т. При изменении тем-ературы на 1 К коэффициент диффузии многих веществ меняется на 3 — 4%.
Второе уравнение Фика можно вывести, если рассмотреть два поперечных Нения 1 м ■ на расстоянии dx друг от друга. Если скорость диффузии через ёрвое сечение равна Ddc/dx, то через второе сечение на расстоянии dx (по
dx
аравлению диффузии вещества) она равна
d(e»dc)
^стояние dx частица пройдет (продиффундирует) за время dt. Отсюда изменение концентрации вещества в элементе объемом шх м единицу времени равно (для линейной диффузии в направлении, проти-эположном х):
(XIII.9)
dc df
dc d(c—dc) D--D—^
dx dx
= _ ,
(XIII. 10)
dc ■ d2c dt dx2
(XIII.
гент пропорциональное | и его скоростью). Для шар вной среде, Стоке пол}
(XIII.4]
уравнение Стокса — Эйшп-(Х1И5)|
растворе довольно СйЛьни еде, уравнение (ХШ.5) дс-гента диффузии от разных
Выражение (XIII. 10) называется вторым уравнением Фика. Если диффузия происходит в пространстве, то второе уравнение Фика рймёТ вид
-DV2c; (XIII.11)
(XIII.12)
-■ dt ■ - .. -.
81с 82с д2с
где .У?-—оператор Лапласа.
Задавая начальные и граничные условия, можно путем интегрирования второго уравнения Фика (XIII. 10) или (XIII. 11) получить выражение для корости гетерогенного процесса, лимитируемого процессом диффузии.
Различают диффузию линейную и пространственную; бесконечную и ограниченную; стационарную и нестационарную. Линейная диффузия происходит ■в одном направлении, пространственная — в разных направлениях. Диффузия (называется бесконечной, если фронт диффузии в процессе гетерогенной еакции не успевает достигнуть границы системы; диффузия является
389
ограниченной, если она достигает границы системы. Под фронтом диффузгт понимается граница внутри раствора, где еще не заметны (с заданной погрел-ностью) изменения в концентрации, вызванные процессом диффузии. П:« стационарной диффузии концентрация вещества в любой данной точке пространства не меняется со временем; при нестационарной — меняется.
Для нестационарной линейной полубесконечной диффузии, когда вещестъ: диффундирует, например, вдоль длинной цилиндрической трубки, а реагис ющей твердой поверхностью является дно этого цилиндра, начальные и коне-ные условия будут следующие. В начальный момент времени, когда реакци! на поверхности еще не началась, концентрация вещества вблизи поверхностк
с равна его концентрации с0 в объеме раствора: t=0 и с=с0 (начальн: условие). Если реакция на поверхности протекает очень быстро, то в любо! момент времени после начала процесса концентрация у поверхности праг-тически равна нулю: />0 и с*=0 (первое граничное условие). Кроме того, пр» полубесконечной диффузиии концентрация в глубине раствора должна оставаться постоянной: />0; х=оо и с(х, t) = c0 (второе граничное условие Решение второго уравнения Фика (XIII. 10) при этих начальном и граничны условиях имеет вид (приводим его без вывода):
■речением времени удаляется т
Ьузионного слоя со вреаязяя] [щечной, пока фронт диффузия
1атриваемом приме; Скорость гетерогенного шмш ■ответствии с первым урааввя единицу поверхности)
=с
1чало координат х=0 псавяи юм внутрь раствора). Нахоя
дс (х, 0
дх
При х=0 уравнение птхобрш|
с(х, t) = c0 erfz;
erf 2=j" e~z dz; о
z=
(XIII.13
(XIII.14) (XIII. 15,
Подставляя (XIII. 18) в юнарного гетерогенного вечной диффузией (уравнез
■со
где с (x, i) — концентрация вещества в данной точке на расстоянии от поверхности твердого тела в момент времени /; erf z — интеграл ошибок; z — переменная интегрирования, которая в рассматриваемом случае меняется от 0 дс со. Интеграл ошибок erfz решается только приближенными методами интегрирования и его значения приводятся в специальных таблицах для разных значений верхнего предела интегрирования z. При
z =-
=-
(т. е. при х=оо или /=0) егГг = ^/тг/2 и. следовательно, с(х, 0 = со в соответствии со вторым граничным и начальным условиями.
На рис. XIII. 1 представлено изменение относительной концентрации вещества с(х, г)/с0 с расстоянием х от поверхности твердого тела в разные промежутки времени /[ -н- /4. Процесс диффузии является нестационарным; при данном значении х концентрация с(х, t) уменьшается со временем. При этом фронт диффузии
По истечении достатоям практически до нуля. На
уравнению (XIII. 19) должш мала координат. Рассмотрим нестационар Ьюгда реагирующей твердой шве определяется диффузией вешесва кый процесс считаем быстрым принимаем равной нулю. При зя [вид:
при ;>
При этих начальных и грая ка (XIII. 10). Скорость дан ставлена уравнением
390
. Под фронтом диффузн» заметны (с заданной погреи-с процессом диффузии. Прав 1 5 любой данной точке пр<-вонарной — меняется.
диффузий, когда веществ; ической трубки, а реагиг • -линдра, начальные и коег^-времени, когда реакпы вещества вблизи поверхноста
: /=0 и с=с0 (начальное очень быстро, то в любое втрация у поверхности прах-ш :е условие). Кроме того, при Шубине раствора должна оста-I(второе граничное условие. ■ этих начальном и граничных
(XIII.15
■
(XIII.14
ран. 15
течением времени удаляется от реагирующей поверхности, т. е. толщина «ффузионного слоя со временем увеличивается. Диффузия считается полубе-конечной, пока фронт диффузии за время гетерогенного процесса не дойдет (в [рассматриваемом примере) до конца трубки с раствором.
ран. 16)
Скорость гетерогенного процесса, лимитируемого процессом диффузии, соответствии с первым уравнением Фика (XIII. 1) описывается выражением единицу поверхности)
W
1 (<ь"\ =п (дс(х, t)\ (-l)s\dtjx„o \ дх )х=0
х -У
derfz
2
paii.i7)
-=с
= с
1чало координат х=0 помещаем на поверхности твердого тела, ось х напра-аем внутрь раствора). Находим производную от выражения (XIII. 13):
l<sj~dt
дс (х, /)
дх ^ дх
cxm.is)
При х=0 уравнение преобразуется к виду
'дс(х, t)\
~jndt
fdcjx, t)\ \ dt )x=0'
Подставляя (XIII. 18) в (XIII.16), получаем выражение для скорости нестационарного гетерогенного процесса, контролируемого линейной полубеско-нечкой диффузией (уравнение Коттреля):
■Ой
■иже на расстоянии от поверт-I" интеграл ошибок; z — пере-юм случае меняется от 0 л; ■жженными методами интег-его значения приводят;! таблицах для разных зна-предела интегрирована!
lyfEt
или f=0) erfz=^/7t/2 и. в, с(х, t) = c0 в соответствии плм и начальным услс-
.1 представлено изменение концентрации вещества гоянием х от поверхности в разные промежутки вре-зцесс диффузии является при данном значении с(х, 0 уменьшается с; этом фронт диффузии
С0.
К yft
(XIII. 19)
По истечении достаточно большого времени скорость диффузии падает
>актически до нуля. На графике в координатах w—^= опытные точки соглас-
V*
уравнению (XIII. 19) должны расположиться на прямой, выходящей из {начала координат.
Рассмотрим нестационарную сферическую полубесконечную диффузию, когда реагирующей твердой поверхностью является сфера и скорость процесса определяется диффузией вещества из раствора к этой поверхности. Гетерогенный процесс считаем быстрым и концентрацию вещества у поверхности принимаем равной нулю. При этом начальное и два граничных условия имеют вид:
при г=0 с=с0;
при г>0 с-0 и с(со,т)=с0.
\ dr
При этих начальных и граничных условиях нужно решить второе уравнение Фика (XIII. 10). Скорость данного гетерогенного процесса может быть представлена уравнением
pan.20)
391
Отсюда окончательное выражение (приводим его без вывода):
Id
Я у/Т Г
(хин:
>и этом второй закон вка (XIII.10) принимает
где г — радиус сферы.
Из уравнения (XIII.21) видно, что для нестационарной полубесконечЕ:* сферической диффузии по истечении длительного времени (f-»co) скоростт гетерогенного процесса на сферической поверхности падает до некоторс:: постоянного значения:
Dc
Зависимость w от линейная. При 1/л/7 = 0 эта прямая отсекает на оса отрезок, равный Z)c/r. Зная зависимость количества прореагировавшего вепд-ства от времени t, можно определить коэффициент диффузии реагируюше;: I вещества в растворе, если известна величина поверхности твердого тела (та как w—(i/s)dmjut, а из опыта определяется dmjdt), или можно найти (актвз-] ную) поверхность s реагирующего твердого тела, если известен коэффициент диффузии D. '"■
§ ХШ.2. Гетерогенные процессы
при стационарной конвективной диффузии
Гетерогенные процессы при стационарной конвективной диффузии осуществляются в перемешиваемых растворах. Согласно законам гидродинамика] поток жидкости вблизи поверхности твердого тела тормозится, причем слой жидкости молекулярных размеров, непосредственно прилегающий к поверхности, прочно удерживается на ней и не перемещается относительно нее (рио XIII.2, в). Если раствор перемещается относительно реагирующей поверхности твердого тела, то реагент доставляется из раствора к ней за счет конвекпн! и диффузии (конвективной диффузии).
Математические выражения для скорости гетерогенных процессов npi стационарной конвективной диффузии получаются обычно очень сложными. Поэтому рассмотрим вначале приближенную теорию стационарной конвех тивной диффузии (Нернст). Предположим, что вблизи поверхности твердого тела даже при наличии конвекции в растворе имеется гипотетический нес: движный слой толщиной в несколько тысяч молекулярных размеров, так! называемый эффективный диффузионный слой толщиной S, через которые доставка вещества к поверхности твердого тела осуществляется только за счет диффузии. Полагаем, что внутри слоя 5 конвекция отсутствует (рис. XIII.2, с Концентрация вещества в эффективном диффузионном слое на границе с раствором равна концентрации с0 в объеме раствора. А внутри диффузионно: : слоя концентрация вещества падает вблизи поверхности твердого тела д: некоторой величины с. Эффективная толщина диффузионного слоя не имеет физического смысла И представляет Собой эмпирический коэффициент. Прет-ставдение об эффективной толщине диффузионного слоя позволяет считать что вещество доставляется к реагирующей поверхности только за счет дис-фузиии.
Установим зависимость концентрации реагирующего вещества внутри эффективного диффузионного слоя от расстояния до твердой поверхности. Условие стационарности при линейной диффузии запишется как
дс дх'
D
со-с
-= const =
(XIII.22)
уравнения (ХШ.22) дует, что концентра-реагирующего на пряности вещества меняется внутри эффективного даффузионного слоя лн-аейно с растоянием от поверхности твердого тела (рис. XIII.2, Ъ). Подстав-ияя уравнение (XIII 21 в (XIII. 1), получаем див скорости стационарного гетерогенного процесса, анмитируемого процессом диффузии,
fee s — поверхность твериш ния; jS — коэффициент маса Если реакция на поверив У=0. При этом вместо урав
-Как видно, в данном случае лимитируется диффузией и и Подставляя :
Befit—const,
в (XIII-25), разделяя пере: L получаем
392
его без вывода):
(ХШ21
зарной полубесконечЕ :* времени (г->оо) скорое падает до некоторс:
эта прямая отсекает на ас прореагировавшего вепсе-диффузий реагируюшегт эхностй твердого тела (таи
или можно найти (акгж если известен коэффициез
вной диффузии осупэ-ао законам гидродинамика тормозится, причем слое прилегающий к поверх-относительно нее (ри: I реагирующей поверхностж к ней за счег конвекпиж
эгенных процессов прь обычно очень сложными зрею стационарной конвех-зи поверхности твердогс :я гипотетический непо-улярных размеров, так шой 6, через которые зествляется только за счет j отсутствует (рис. XIII.2, а ишом слое на границе с рас: А внутри диффузионного эхностй твердого тела д: зузионного слоя не имеет ский коэффициент. Пред-слоя позволяет считать ги только за счет диф-
эщего вещества внутри эф-твердой поверхности. Усло-ся как
![]()
ври этом второй закон Фика (XIII. 10) принимает [вид
D—=0
дс дх'
о *
б
Ш дх1
о *
а
со-с 5 '
-= const=
(XIII.22)
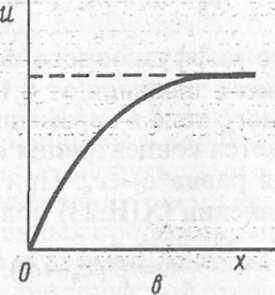
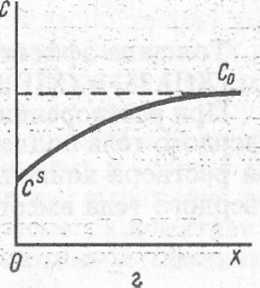
Рис. ХШ.2. Изменение скорости потока раствора (а, в), текущего вдоль поверхности, и концентрации реагента в растворе (б, г) с расстоянием от реакционной поверхности твердого тела при протекании гетерогенной реакции, лимитируемой процессом стационарной конвективной диффузии
уравнения (X11I.22) едует, что концентра- реагирующего на по- f верхности вещества меня- [ется внутри эффективного диффузионного слоя ли- нейно с растоянием от по- верхности твердого тела [(рис. XIII.2, Ь). Подстав- ляя уравнение (XIII.22) в (XIII. 1), получаем для скорости стационарного тетерогенного процесса, лимитируемого процес- сом диффузии, -
(ХШ.23) (XIII.24)
где s — поверхность твердого тела, на которой протекает гетерогенная реакция; /? — коэффициент массопередачи; D — коэффициент диффузии.
w=f}c0.
Если реакция на поверхности протекает очень быстро, то можно принять jcf=0. При этом вместо уравнения (ХШ.23) получаем
(XIII.25)
1
Am
dc
Как видно, в данном случае скорость стационарного гетерогенного процесса лимитируется диффузией и подчиняется уравнению реакций первого порядка. \~ Подставляя -
"?0
и Cq-
в (XIII.25), разделяя переменные и интегрируя в пределах от т0 до т, и от 0 до t, получаем
393
(XIII
It
(XIII"
где
моим,
— количество вещества в растворе
соответственно в начальный момент
времени (t=0)
и
через время t
протекания
стационарного гетерогенного процесса;
V
—
объем раствора.
По
уравнению (XIII.26) можно вычислить
количество вещества, прореагировавшего
на границе фаз за время t:![]()
![]()
то-т,=то(1-е~^').
(XIII.2:
Толщина эффективного диффузионного слоя 8, вычисленная по уравнениям (XIII.28) и (XIII.27), имеет значения от 0,1 до 0,01 мм.
При растворении твердого тела в перемешиваемом растворе у поверхностт твердого тела поддерживается концентрация с„ насыщенного раствора, а внутри раствора концентрация равна с0<сл. При этом для скорости растворены твердого тела вместо уравнения (XIII.23) получаем
При с0=0 это уравнение имеет вид w=/?сн. Этому уравнению подчиняете! также стационарный процесс растворения газа в перемешиваемой жидкости, если доставка газа из газовой фазы к поверхности жидкости не лимитирует процесс.
В действительности, в перемешиваемой жидкости неподвижный диффузионный слой отсутствует и осуществляется процесс конвективной диффузии (см рис. XIII.2, в, г). Поэтому для теоретического расчета количества вещества, доставляемого к реагирующей поверхности, нужно учитывать не только дис -фузию, но и конвекцию. Различают ламинарное и турбулентное движение потока жидкости. При турбулентном движении потока жидкости в нем появляются завихрения. Закономерности конвективной диффузии при ламинарном и турбулентном режимах движения потока жидкости различны.
Математические соотношения конвективной диффузии, как правило, достаточно сложные. Только в нескольких случаях удается получить боле* простые выражения. Так, например, для скорости гетерогенного процесса на поверхности вращающегося диска при конвективной диффузии и ламинарном движении потока раствора В. Г. Левичем получено выражение
![]()
(XIII.29
где s — поверхность, м2; т — количество вещества, моль; р — плотность раствора, г/м3; п — динамическая вязкость раствора, Па с; и — число оборотов диска, с-1; D — коэффициент диффузии, м2/с; с0 — концентрация реагирующего вещества в растворе, моль/м3; 3,90' Ю-8 — теоретический коэффициент (при указанных размерностях величин). Диск вращается вокруг оси, проходящей через его центр и перпендикулярно ему; одна сторона (верхняя) диска изолируется от соприкосновения с раствором. Особенностью вращающегося
394
(ХШ.2:
(XIII.2-
соответственно в начальны! стационарного гетерогез
количество вещества, прорег
диска является равнодоступность его поверхности для диффузии вещества из раствора. Это означает, что количество вещества, доставляемое диффузией к любой точке поверхности вращающего диска в течение данного времени, одинаково. По уравнению (ХШ.29), можно вычислить скорость гетерогенного процесса на вращающемся диске без использования каких-либо эмпирических констант, в отличие от уравнения (XIII.25).
(Г
3,90 КГ V'2
В теории конвективной диффузии разъясняется смысл эффективной толщины диффузионного слоя. Из сравнения уравнений (ХШ.29) и (XIII.25) получаем выражение для эффективной толщины диффузионного слоя 8 (м) на вращающемся диске:
8~ (ХШ.ЗО)
(ХШ.28
8, вычисленная по уравненн-' 0,01 мм.
емом растворе у поверхности , насыщенного раствора, а внут-:м для скорости растворения ем
гому уравнению подчиняется в перемешиваемой жидкости, жидкости не лимитирует
е неподвижный диффузион-конвективной диффузии (см расчета количества вещества, ао учитывать не только диф-и турбулентное движение потока жидкости в нем появ-эй диффузии при ламинарном гости различны, диффузии, как правило, дскупается получить более гетерогенного процесса на зой диффузии и ламинарном ао выражение
Как видно, эффективная толщина диффузионного слоя согласно теории конвективной диффузии представляет собой комбинацию физико-химических величин: D, п, t], 6. Согласие теории стационарной диффузии Нернста с опытом объясняется тем, что скорость гетерогенного процесса, так же как и в теории конвективной диффузии, пропорциональна концентрации вещества в растворе, а значение эффективной толщины диффузионного слоя входит в теорию как эмпирический коэффициент. В настоящее время теоретические выражения для скорости стационарных гетерогенных процессов, лимитируемых конвективной диффузией, получены также для струи, набегающей на край тонкой пластинки, для потока жидкости внутри цилиндрической трубы и т. п.
' КГ
При повышении температуры лимитирующая стадия и соответственно механизм гетерогенного процесса могут измениться. Это связано с разным характером зависимости константы скорости к химической реакции и коэффициента массопереноса /? от температуры, т. е. от их температурных коэффициентов. Константа скорости химической реакции в соответствии с уравнением Аррениуса имеет вид
(XIII.31)
(XIII.32)
или
In Л—In Ах-
r Т'
где Ех —- энергия активации гетерогенной реакции.
Зависимость коэффициента массопереноса от температуры определяется выражением
(ХШ.29)
V
гва, моль; р — плотность эра, Па с; п — число оборо-; с0 — концентрация реагиру-■ теоретический коэффици-: вращается вокруг оси, прохо-гна сторона (верхняя) диска эенностью вращающегося
(ХШ.ЗЗ)
(ХШ.34)
RT
или
lnp=\nAd-~r t
где v —- показатель степени, с которым коэффициент диффузии входит в выражение для скорости процесса диффузии; ED — энергия активации процесса диффузии.
Пусть при низкой температуре лимитирующей стадией гетерогенного процесса является химическая реакция (кинетическая область гетерогенного про-
395
т/т
АВ — кинетическая область; CD —- диффузионная область; ВС —проме-жуточноая область
 цесса).
При повышении температуры константа
ско-
рости химического процесса быстро
увеличивается (е
2—
4 раза на 10
К)
и, начиная с некоторой тем-
пературы,
когда константа скорости к
химическое
реакции
сделается больше: коэффициента
массопере-
носа, лимитирующей стадией
становится диффузион-
ный процесс
(диффузионная область). При этом
про-
исходит цостепещплй переход из
кинетической об-
ласти гетерогенного
процесса в диффузионную и из-
менение
углового Коэффициента прямой на
графике
Ык
(или
1пД)-1/Г
(рис. XIII.3)
от
EJR
(прямая
АВ
до
vED/K
(прямая
CD).
По
величине углового коэф-
фициента можно
судить о механизме гетерогенного
процесса.
Если энергия активаций, определенная
из
углового коэффициента, равна 5
—
20
кДЖ/моль,
тс
процесс
диффузионный (диффузионная область;
пря-
мая CD).
Если
энергия активации равна 50
—
200
кДж/моль,
то
имеем кинетическую область гетероген-
ного
процесса (прямая АВ).
В
промежуточной области (кривая СВ)
гетероген-
ный
процесс контролируется как диффузией,
так и химическим процессом на
границе
фаз. - о .
цесса).
При повышении температуры константа
ско-
рости химического процесса быстро
увеличивается (е
2—
4 раза на 10
К)
и, начиная с некоторой тем-
пературы,
когда константа скорости к
химическое
реакции
сделается больше: коэффициента
массопере-
носа, лимитирующей стадией
становится диффузион-
ный процесс
(диффузионная область). При этом
про-
исходит цостепещплй переход из
кинетической об-
ласти гетерогенного
процесса в диффузионную и из-
менение
углового Коэффициента прямой на
графике
Ык
(или
1пД)-1/Г
(рис. XIII.3)
от
EJR
(прямая
АВ
до
vED/K
(прямая
CD).
По
величине углового коэф-
фициента можно
судить о механизме гетерогенного
процесса.
Если энергия активаций, определенная
из
углового коэффициента, равна 5
—
20
кДЖ/моль,
тс
процесс
диффузионный (диффузионная область;
пря-
мая CD).
Если
энергия активации равна 50
—
200
кДж/моль,
то
имеем кинетическую область гетероген-
ного
процесса (прямая АВ).
В
промежуточной области (кривая СВ)
гетероген-
ный
процесс контролируется как диффузией,
так и химическим процессом на
границе
фаз. - о .
~ § ХШьЗ. Кинетика топохимическйх реакций
- Кинетика реакций с участием твердых веществ выдвигается в настоящее время на одно из ведущих мест среди проблем химической кинетики. Твердофазные реакции лежат в основе многочисленных процессов химической промышленности, металлургии и др. Возможности интенсификации этих процессов в значительной мере определяются состоянием кинетических исследовании твердофазных реакций, развитие которых приобретает, таким образом, практическое значение.
Большинство твердофазных реакций относятся к классу топохимических Рассмотрим реакцию
CuSC-4 5Н20 (t)-*CuSCv3H20 (т)+2Н20 (г)
поберхность
![]()
Рис. XIII .4. Образование зоны реакции при топохими-ческой реакции
 Потеря
двух молекул воды (в виде пара) при ее
протекании сопровождается образованием
твердого продукта реакции — тригидрата
сульфата меди. Но образуется он не по
всему объему реагента, а в виде
отдельных островков, называемых
зародышами или ядрами. Центры этих
зародышей располагаются, как правило,
на поверхности кристаллических
частиц и связаны с какими-либо дефектами
структуры, а сами зародыши прорастают
в глубь, кристалла, сначала независимо
друг от друга (рис. XIII ,4, а),
а
затем сливаясь и образуя общий
реакционный фронт (рис. XIII.4,
б). Таким образом, гистохимической
реакцией называется гетерогенная
реакция, в которой участвует по крайней
мере одно твердое исходное вещество и
один твердый продукт реакции. При
этом топОхимические реакции
локализованы в так называемой зоне
реакции на границе раздела между твердым
исходным веществом и твердым продуктом
химического пре-
Потеря
двух молекул воды (в виде пара) при ее
протекании сопровождается образованием
твердого продукта реакции — тригидрата
сульфата меди. Но образуется он не по
всему объему реагента, а в виде
отдельных островков, называемых
зародышами или ядрами. Центры этих
зародышей располагаются, как правило,
на поверхности кристаллических
частиц и связаны с какими-либо дефектами
структуры, а сами зародыши прорастают
в глубь, кристалла, сначала независимо
друг от друга (рис. XIII ,4, а),
а
затем сливаясь и образуя общий
реакционный фронт (рис. XIII.4,
б). Таким образом, гистохимической
реакцией называется гетерогенная
реакция, в которой участвует по крайней
мере одно твердое исходное вещество и
один твердый продукт реакции. При
этом топОхимические реакции
локализованы в так называемой зоне
реакции на границе раздела между твердым
исходным веществом и твердым продуктом
химического пре-
температуры константа скс-быстро увеличивается (• ж, начиная с некоторой тем--анта скорости к химической выпе коэффициента массопере-с~ алией становится диффузиоЕ-иная область). При этом про ререход из кинетической об-сщесса в диффузионную и из-финиента прямей на графике I ХП1.3) от ejr (прямая ав По величине углового коэф-ь о механизме гетерогенногс активации, определенная из I равна 5 — 20 кДж/моль, то лиффузионная область; пря-активации равна 50 — 20С этическую область гетероген-йвасти (кривая св) гетерогеЕ-и химическим процессом на
sera выдвигается в настоящее логической кинетики. Твердо-*х процессов химической про жнтенсификации этих процес-кинетических исследований лет, таким образом, прак-
кя к классу топохимическйх
£г)+2Н20 (г)
_; протекании сопровождается ■гидрата сульфата меди. Не
вращения. Из сказанного следует, что скорость топохимической реакции будет определяться как числом зародышей, так и скоростью их роста, т. е^ суммар- ной протяженностью реакционной зоны во всем образце в каждый данный момент времени: : л:л.л.л.
S В качестве примеров топохимическйх реакций можно привести также термическое разложение карбоната Кальция
(XIII.35)
СаСОз (т)->СаО (т)+С02 (г) н восстановление оксида железа водородом
FeO (т)+Н2 (r)-»Fe (т)+Н20 (г)
(ХШ.Зб)
и>= —
dm
d7'
Для удобства вывода математических моделей кинетики топохимическйх реакций используем массовые (а не молярные) единицы для выражения скорости процесса. Определим скорость топохимической реакции соотношением
(ХШ.37)
где т — изменение массы исходного твердого вещества. Если речь идет о реакции между двумя или более твердыми веществами, то под dm следует понимать изменение массы того реагента, после полного расходования которого реакция прекратится (т. е. взятого в недостаточном количестве против стехиометрии реакции).
(ХШ.38)
[В топохимическйх реакциях теряет смысл понятие концентрации.:0 скоростиПротеканияреакции судят по изменению степени превращения а исходного вещества (взятого в недостаточном количестве) -
гщ—m т
« ——*—=1 ——,
т : щ
где то — начальная масса исходного вещества. Отсюда т—т0 (1 — а); dm—moda. Тогда из уравнения (XIII.37) получим ,
.'.. -, - ' . ' dm da - •'
w= =m0 —
К -At dt - ■ -: ~J- ■■'
ИЛИ
da 1 dm 1 w*=—=-— ~=~ w, dt щ dt mo
(XIII.39)
![]()
 г-
г-
где we —скорость реакции, нормированнаяца единицу исходной массы ре^
Кента. ' г'■ ^
(XIII.40)
Скорость топохимической реакции зависит от давления газообразных компонентов, температуры'и, кроме того, является функцией времени или глубины протекания реакции (степени превращения):
w = w(p, Т, t),wa==w(p, Г, a).
Рис. ХШ.4. Образование зоны реакции при топохимической реакции *
Получение уравнения скорости (XIII.40) в явном виде является конечной целью кинетического исследования. Для достижения этой цели требуется найти зависимость скорости от температуры и объяснить экспериментально определяемую зависимость wa=f(a) при Т, р=const. Зависимость скорости
397
топохимической реакции от давления и возможные затруднения, связа с доставкой газообразных веществ к зоне реакции или с отводом газообразна продуктов из зоны реакции за счет диффузии через поры твердого продукт*, в дальнейшем не будут приниматься во внимание.
Топохимические реакции характеризуются специфическими кинетически:' л j закономерностями. В начале топохимической реакции скорость ее мала (ез~| Аукционный период), затем она возрастает, проходит через максимум и сниил-1 ется практически до нуля. Степень превращения при этом обычно меняется п»1 сигмоидной (S-образной) кривой. Такой характер кинетических закономер-] ностей топохимическйх реакций можно объяснить следующим образом. Г: I мере того как образуются зародыши фазы твердого продукта реакции, появляется реакционная поверхность раздела фаз, которая растет во времени кы вследствие роста имеющихся, так и из-за образования новых зародыше: В соответствии с этим скорость реакции в начале процесса мала, а затем возрастает. По мере развития поверхности раздела фаз растущие зародыши фазы твердого продукта начинают сливаться. Из-за отсутствия свободней поверхности образования новых зародышей практически не происходит; реакционная поверхность раздела твердых фаз и соответственно скорость реакция] проходят через максимум. В дальнейшем слияние отдельных зародыше! приводит к уменьшению реакционной поверхности раздела твердых фаз и образованию сплошного слоя твердых продуктов, граница которого постепенл: продвигается в глубь зерен исходного твердого вещества. При этом скоростл реакции постепенно падает до нуля.
Для формулирования математической модели кинетики топохимическсл реакции будем исходить из предположения, что скорость реакции пропорциональна объему реакционной зоны. Чтобы это предположение выполняло: г необходима лишь однородность реакционной зоны по температуре и дав.л нию. Так как плотность твердого тела меняется с температурой мало, може : записать
(XIII.41
at
где к — константа скорости реакции; р — плотность реагента; V — объем реакционной зоны, т. е. той части образца, которая затронута реакцией в данный момент; это величина изменяется во времени.
Для дальнейших преобразований необходимо обратиться к надежно установленному экспериментальному факту, согласно которому зона реакции локализована в переходном слое 8 между исходным веществом и продукте1.: на поверхности раздела фаз и мало меняется по ходу реакции (рис. XIII.5). поэтому
V(t) = 8s(t), (XIII.42
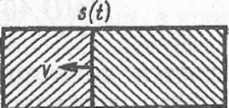
Исходное Продукт дещестдо
где s(t) —реакционная поверхность раздела. Величина 8 мала по сравнению с другими размерами, определяющими зону реакции, за исключением самых ранних стадий реакции. Таким образом, с учетом (XIII.42) соотношение (XIII .41) принимает вид
Рис. XIII.5. Скорость топохимической реакции как линейная скорость продвижения зоны реакции на границе двух твердых фаз
Величина kp8=wya называл остается постоянной во К определению w(f) ■представить реакцию в i Едя отдельного зародыша] сп Изменение массы и сходнее Шт=ps (t)vdt. Отсюда
Приравняв правые части
ми
Легко видеть, что константа си Объем исходного вещества в за вания вещества в зоне реанзявк ного слоя, получаем v/d= . что А: =1/7. Таким образов*, вив это величина, обратная вреаеяя ной 8. Для определения к ив скорость ее продвижения. С jbbj ся линейная скорость v, то тем информация будет тем бс о структуре реакционной зеява неизвестны методы непосрежая что удается достичь, — это прав ния границы v.
Как видно из уравнения {ЖЩ знать зависимость реакняканив! периментальные методы с: вычисления этой величинь моделях реакции. Эти моде и росте зародышей фазы тверди кую форму (т. е. соотношение а
Сущность метода расчета! примером. Пусть на поверхшов ттьтй момент реакции обраэяяя каждый зародыш имеет z условии постоянства линей зародыша равен
Поверхность полусферы, о
398
затруднения, связанна с отводом газообраз ел поры твердого продукта.
кинетическвма скорость ее мала <иа-через максимум и скижь-этом обычно меняется гзг ажнетических закономет-сдедующим образом. Па а реакции, появл$-растет во времени esc новых зародышей, процесса мала, а затем фаз растущие зародыш отсутствия свободнее не происходит; релг-о скорость реакции отдельных зародыше! а твердых фаз и некоторого постепенл: При этом скорость
топохимическся реакции пропорцис-ожение выполнялось. но температуре и давле-ратурой мало, може:
(XIII.4
реагента; V — объем затронута реакцие!
ититься к надежно уста-которому зона реакции веществом и продуктом реакции (рис. XIII. 5>
(XIII.4Z
а 8 мала по сравнению за исключением самых (XIII .42) соотношение
(ХШ.43)
w(t)-kp8s(t).
Величина kp8 = wya называется удельной скоростью реакции (при s= 1); она остается постоянной во времени и для ее определения необходимо знать 5 (г).
(ХЩ.44)
К определению w(t) можно подойти и с другой стороны. Мы можем представить реакцию в твердом теле как движение поверхности 5 (г) [или a (t) для отдельного зародыша] сквозь реагент с постоянной линейной скоростью v. Изменение массы Исходного вещества за время dt, очевидно, равно dm = ps (t)vdt. Отсюда
.. dm .. , .
w(t)= = pvs(t).
dt
Приравняв правые части уравнения (ХШ.43) и (ХШ.44), найдем, что
v = k8 (XIII.45)
к=-
или
(XIII .46)
Легко видеть, что константа скорости к (с 1) имеет ясный физический смысл. Объем исходного вещества в зоне реакции равен V= vis, где 7 — время пребывания вещества в зоне реакции. Учитывая, что V/s—8 —толщина реакционного слоя, получаем v/8= l/t. Из сравнения с выражением (XIII.46) следует, что к=1/7. Таким образом, константа скорости топохимической реакции — это величина, обратная времени пребывания реагента в зоне реакции толщиной 8. Для определения к необходимо знать толщину зоны и линейную скорость ее продвижения. С другой стороны, если в эксперименте определяется линейная скорость v, то тем самым мы получаем информацию и о к. Эта информация будет тем более определенной, чем более достоверны сведения о структуре реакционной зоны. Следует отметить, что в настоящее время неизвестны методы непосредственного определения величины к, и максимум, что удается достичь, — это прямое определение линейной скорости продвижения границы v.
Как видно из уравнения (ХШ.44), для определения скорости реакции нужно знать зависимость реакционной поверхности раздела s(t) от времени. Экспериментальные методы определения s(t) отсутствуют. Поэтому все способы вычисления этой величины основаны на так называемых морфологических моделях реакции. Эти модели включают в себя представления об образовании и росте зародышей фазы твердого продукта, сохраняющих свою геометрическую форму (т. е. соотношение размеров) на протяжении всей реакции.
Сущность метода расчета s(t) можно проиллюстрировать следующим примером. Пусть на поверхности полубесконечного твердого тела в начальный момент реакции образуются зародыши с плотностью N0 м-2, причем каждый зародыш имеет полусферическую форму (см. рис. XIII.4, а), При условии постоянства линейной скорости продвижения границы раздела радиус зародыша равен
r=vt. (XIH.47)
топохимической реакции как ливня зоны реакции на границ; тзердых фаз
2.2
Поверхность полусферы, ограничивающей один зародыш, равна
o(t)=2nr2 = 2Ttv2t
(XIII.48)
399
w (?) = pvNoO (0 = pvNo2nvzt
Поскольку по предположению образец полубесконечный, все расчеты ведут на единицу поверхности исходного образца. Если предположить, что все N0 зародышей на 1 м2 поверхности образуются в начальный момент, то из уравнения (ХШ.44) с учетом соотношения s(t)—N0&(t) и (ХШ.48) получим
гл
(XHI.49;
или
w(t)=t2npN0v3tz
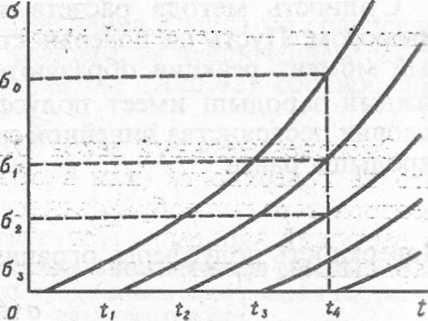
Однако не всегда дело обстоит так просто; Если мы мысленно проследим за развитием процесса, изображенного на рис. XIII .6, то поймем, что соот- ношение (XIII.49) выполняется до тех пор, пока соседние зародыши нестанут «перекрываться». Как учесть этот эффект при выводе кинетических уравнений, мы увидим несколько позже. ■ • ■
Сейчас же отметим другую сложность. Она обусловлена тем, что зароды- ши не обязательно должны начинать свой рост в один и тот же момент времени. Чаще всего этот процесс растянут во времени, И если бы мы попытались учесть этот фактор в рассмотренном выше примере, то оказались бы перед необходимостью пересчитывать зародыши одинаковых размеров, чтобы найти s(t). Кроме того, зародыши, как правило, образуются на разного рода дефектах, именуемых обычно «потенциальными центрами» зародышеоб- разования. Эти центры распределены по внешней поверхности образца и, естественно, могут поглощаться в процессе роста зародышей, не успев ак- тивироваться в растущий зародыш.
Таким образом, в общем случае картина развития топохимической реакции оказывается довольно сложной. Поэтому рассмотрим сначала более простой случай зародышеобразования в объеме твердого реагента. Если зародыши не перекрываются и образуются в разные промежутки времени после начала реакции, то нам потребуется только одно предположение: потенциальные центры распределены по объему реагента статистически и вероятность превратиться в зародыши одинакова для любого из них и не меняется на протяжении всей реакции. Будем считать, что зародыши сферические и их число изменяется во времени по закону N=N(t).
Рассмотрим более детально протекание топохимической реакции. Для этого откладываем по оси ординат величину поверхности одного зародыша a(t) (рис. ХШ.7.) Момент времени t0 — 0 будем считать совпадающим с моментом появления в системе первого зародыша. Следующие зародыши появляются в моменты tu.tb ... в последовательности и с частотой, определяемой функцией N(t). Суммарная поверхность всех зародышей к моменту времени I определяется как сумма всех оу
Щ 5(0=1***
К , »-*""
Но поскольку все заро тьп-и р
а
Выражение a(t—ti) означает,
функцией разности
Если зародышей образуется
U попадает в среднем — можно заменить интегрщ» вш
![]()
где т — время появления два Формула (XIII.51) явлиек льной топокинетики. Чтобк и а (0 подставить их явные вид определяется формой положения о постоянстве Если это предположение
Функция N(t), а говоря, только из экстнзввмш каким-либо причинам, то мснв теоретических предпосылс пользуют два типа закономер экспоненциальный закон зарвд эмпирическая формула

400
Второй тип — степенно* зав
Экшоненпиальный
зажовх | что на поверхности (иди а :
центров зародьшгеобразоиавв] в растущий
зародыш. Прм я
зародышей,
пропорциотп
ш
ш
