
- •§ 1Х.7. Неизотермическая кинетика. Определение кинетических параметров
- •Глава X
- •Глава X
- •§ Xl1. Теория активных славна
- •119) К виду
- •Глава XI
- •§ Xl1. Теорий активных столкновений
- •§ XI.2. Теория активированного комплекса или переходного состояния. Теория абсолютных скоростей реакций
- •§ XI.3. Применение к оценке предэксп в элементарных реанаавк
- •§ XI.3. Применение теории абсолютных скоростей реакций к оценке предэкспоненциального множителя в элементарных реакциях
- •§ XI.8. Правило сохранения
- •Глава XII
- •Глава XII
- •§ XI 1.1. Основные понятия кинетики цепных оеакций
- •§ XII.2. Основы теории юшпи
- •§ XII.3. Горение и взрыв
- •Глава XIII
§ XII.2. Основы теории юшпи
Известны две разновидно j ветвленными цепями. Первые ■ ; частица при своем взаимодейсп активной частицы.
Кинетическое уравнение пси жет быть получено при помавая мер, скорость реакции образован нением
Эта реакция относится к реи
1. < 1 С
свободная валентность у ра_ ?вение свободной валентное: ого радикала со стенкой сосу, ям свободным радикалом и отнять или передать ему од_ с насыщенными молекулам -_ов, которые в свою с-|дит до тех пор, пока суще
ие исходных веществ в щ
нескольких реакций с у\в| относятся реакции сгорали! , хлорирования и бромиревь-тяжелых нефтепродуктов, пр>
т. е. с образования свобсл-этана образуются два одииа-
уксусного альдегида киеде-радикалов:
1-Н02
стенках реакционных сосуд:* за счет каких-либо внешних ■ света, излучений и др. Пост? характеризуется длиной цек±. ч исходного вещества, которые —ого акта зарождения цег-^ числом цепей, возникающих "эшения между числом акти~ и расходуемых на получение
ультате которого активны» \ брыв цепи может произойти со стенкой сосуда и дезак-1 - взаимодействия с друге* пример,
; не может произойти, так молекула снова распада-I избыточная энергия переда-для течения цепных реакций "иное значение имеет форе i трубках реакция может идти ггенсивнее, так как в узких Еновениях активных частил ее re наличие в сосуде частил газа избыточная энергия цепных реакций характерна - веществ и от удельнс! 1ается отношение площа-
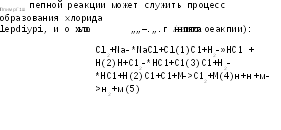
При взаимодействии атомов Na с молекулами С12 происходит образование (активных частиц С1, т. е. зарождение цепи [стадия (1)]. Затем идет развитие [цепи [стадия (2), (3)]. В стадиях (4) и (5) происходит обрыв цепи в результате [дезактивации атомов при ударе о стенки сосуда или об инертные частицы |с образованием молекул Н2 и С12. Бурному протеканию реакции образования [хлорида водорода способствует довольно большая ее экзотермичность, со-{ставляющая —92,3 кДж/моль, в результате чего смесь разогревается и процесс заканчивается взрывом. Аналогичным образом протекает реакция между бромом и водородом. Образование оксида азота N0 из кислорода и азота также осуществляется по цепному механизму. Зарождение цепи происходит при I диссоциации 02, так как энергия связи у 02 в два раза меньше, чем у N2. [Цепной механизм развивается по схеме 02=20, 0+N2=NO+N, N+02=
=N0+6 и т. д.
Примером цепной реакции полимеризации может служить процесс получения поливинилхлорида из газообразного хлористого винила СН2 = СНС1.
§ XII.2. Основы теории кинетики цепных реакций Известны две разновидности цепных реакций с неразветвленными и с разветвленными цепями. Первые возникают в том случае, если одна активная частица при своем взаимодействии вызывает образование тольхо одной новой активной частицы.
Кинетическое уравнение цепных реакций с неразветвленными цепями может быть получено при помощи метода стационарных концентраций. Например, скорость реакции образования фосгена определяется эмпирическим уравнением
d[COCld=fc[CO][Cl2]3/2. (ХИЛ)
dt
Эта реакция относится к реакциям с неразветвленными цепями:
1. С12+1->2С1+1
2. С0+С1-»С0С1
3. cod+ci2 -* c6ci2+ci
2. С0 + С1->С0С1
375
С0С1-+С0+С1
С1+С1+М-.С12+М
Первоначальный процесс зарождения стадия (1) представляет собой реакцнг диссоциации молекулы хлора под влиянием инициатора — атома иода. Затем! идет развитие цепи [стадии (2), (3), (2) ...]. Обрыв цепи происходит в стадиях -и (5). При этом активные частицы — атомы хлора — рекомбинируют в результате тройных столкновений в неактивные молекулы хлора.
Если обозначить константы скоростей пяти элементарных стадий реакции соответственно через ки к2, къ, к4 и ks и написать их кинетические уравнения, т: на основе метода стационарных концентраций можно получить теоретическс-е уравнение для определения скорости образования фосгена (приводим его без вывода):
![]()
сЦСОСЩ
dt
*4+*э[СЦ
(XII.
Уравнение (XII.3) совпадает с эмпирическим уравнением (ХИЛ) при условии что къ<зск4.
Если в результате одного элементарного акта регенерируются две иле больше активных частиц, то происходит цепная реакция с разветвленньвог цепями. Примером процесса цепной реакции с разветвленными цепями может служить реакция окисления водорода кислородом. В этой цепной реакции наряду с образующимися радикалами ОН и Н, обеспечивающими развитие неразветвленной цепи, возникает атом кислорода, имеющий две свободные валентности.
В простейшем виде реакцию горения водорода в кислороде можно представить в виде схемы:
Цепь I
Н + 02-.ОН + 6
бн + Н2->Н20 + Н
Н + 02-»ОН+0
ОН + Н2-Н20 + Н
ЦепьП
3. 6 + н2-»6н + н
2, 6н+Н2->Н20 + Н
1. н+о2-»6н+6
3. 6+н2-»бн+н
(ХИЛ
Цепь I состоит из чередующихся стадий 1, 2, 1, 2 цепь II — из стадий 3 2, 1, 3, 2, 1 .... При этом только в одной стадии (второй) образуется молекула продукта (вода) и одна активная частица (Н); а в двух других (первой
и третьей) образуются по две активные частицы (ОН, 6 и ОН, Н), т. е. в этих стадиях происходит разветвление цепи. Образовавшиеся активные частицы в результате разветвленной цепной реакции вызывают превращение большое массы исходных веществ в конечные продукты, что может привести к взрыв;-или воспламенению.
редставляет собой реакцвк ора — атома иода. Затем [ происходит в стадиях (4 — ^комбинируют в репы хлора, арных стадий реакция i кинетические уравнения, тс Кво получить теоретическое [фосгена (приводим его без
Для регулирования скорости и торможения разветвленных цепных реакций • реакционную смесь добавляют вещества, называемые замедлителями или ингибиторами; обрывая цепь, они уменьшают скорость процесса. Таким об-разом ведет себя, например, тетраэтилсвинец, прибавляемый в небольших количествах к авиационным и автомобильным бензинам. Переходя вместе с бензином в парообразное состояние в камере двигателя, тетраэтилсвинец обрывает цепь при горении топлива. При хранении мономеров часто добавляют ингибиторы, чтобы предотвратить цепную реакцию самопроизвольной полимеризации.
Рассмотрим элементарную вероятностную теорию цепных реакций. Предположим сначала, что цепная реакция — неразветвленная. Пусть т — время между двумя последовательными стадиями. Тогда число молекул продукта, которое образуется в единицу времени из одной активной частицы, равно 1/т. Если концентрации активных частиц в момент времени t равна и, то скорость цепной (неразветвленной) реакции (по продукту реакции) равна
(XII.5)
(ХИ.З
(XII. 1) при условии.
■а регенерируются две или ез 1кция с разветвленными Ь&етвленными цепями может ши В этой цепной реакции ■обеспечивающими развитие lea имеющий две свободные
ki в кислороде можно пред
П
: -ОН + Н
(XII.4)
:-::-н2о+н -бн+н
1 цепь II — из стадий 3. эрой) образуется молекула а в двух других (первой
Ж, б и ОН, Н), т. е. в этих тшеся активные частник эт превращение большой может привести к взрыв;>
Таким образом, если известна зависимость от времени числа активных частиц n=f(t), то можно найти временную зависимость скорости неразветвленной цепной реакции. Для этого найдем сначала скорость изменения концентрации активных частиц ал/ёт. Пусть гщ — скорость возникновения активных частиц в единице объема реакционной смеси, т. е. это число активных частиц, которое возникает в единицу времени и в единице объема под влиянием внешнего воздействия (например, излучения).
Рассмотрим случай, когда концентрация исходных веществ поддерживается постоянной, а продукты убираются из сферы реакции. Этот случай имеет место, например, в реакторе идеального вытеснения. Кроме того, полагаем, что реакция протекает при постоянной температуре, т. е. в изотермических условиях. Тогда скорость возникновения активных частиц под влиянием внешнего воздействия будет постоянной (/Ио=const). Скорость исчезновения активных частиц определяется выражением n/vt, где v — среднее число звеньев в цепи. В самом деле, цепь существует в среднем в течение времени vt, следовательно, через такое время каждая возникшая частица прекратит свое существование, ибо, пока цепь развивается, активная частица все время регенерируется и имеется в реакционной смеси. Если в момент времени t имеется п активных частиц, то через время vt они все исчезнут, а скорость их исчезновения равна и/vt.
(XIL6)
Отсюда скорость изменения концентрации активных частиц равна
dn л
— =7Ио .
dt vt
(XII.7)
Обозначив q=1/(vt), приведем это уравнение к виду
dn
■■ dt
(ХП.8)
Для решения этого дифференциального уравнения с неразделяющимися переменными умножим обе его части на е" и преобразуем к виду
— (т )=тое . dlt
ехр[-r/(vr)iстремитсяк^юТскор^г^кпиТ^
('
"*
да>
ЭКСПОЕе
W»v,
т.
е.
в
PBJ^rpibaB^^K^S^^
Г7
К
постоянному
значен
стационарное протекание
^B^*^S^,SS^
™вливаехся|
других
Введем теперь понятие ^llv—
верТяпто^тн^^
n I
Завис если
обрыв цепи
рассматривать
как
бл£опГ—-°б_РываЧе™-
Ц самом
дел-1
=— (е -1), а
Интегрируя уравнение (XII.8) от 0 до пе" и от 0 до t, получаем
■е ).
П=~ (1
а
пе
(XII. 1
(XII.
реактцшКоат вТем^' П0ЛУЧИМ зависимость скорости денной неразветвленнс
видно, при
w=-=m0v(l-e ").
Как
число звеньев скорость цепной неразветвленн~ой"^шмож^о
как общее число сТучаев^ СЛУ^> а » +1 звеньев це
что число званк^ в пепГоб^нп ^ брЫВа равна V(v+1); в связи с те
"!™j?„™° большое число, считаем v+l~v. Та
выразить как
)■ (XII
Для разветвленной
^оовс1ьленнои цепи вероятность обрыва цепи будет меньше приближенно можно выразить как
р-8=щ pai.i3
Qai.h
где 8 — вероятность разветвления цепи, а fS — S — вероятность обрыва наличии разветвления цепи. При этом скорость цепной разветвленной ре равна
уравнение. 1. Если 0<8<8 то Й-Л^п const так же, как и в случае неразветвленн^й цепи.'
w
это
При t-
Если 0<8>р, то <5-/?>0. Уравнение (XII.14) удобно
преобразовать
Исследуем ■*1щ1(Р-8)=
2
-1
(XII.1:
к виду
§ ХП.З. Горение и взрыв
Горением называют химические ят ием и значительным выделением ■ акции соединения углерода с кика юром и др. Взрывом называют процесс быеввм ным изменением состояния вещеат
![]()
I
Парная или взрывная волна. При яле реход внутриядерной энергия зло* колков. Различают цепной и тепл:» Цепной взрыв, или воспламеяешшщ акций с разветвленными цепко нижним пределами воспламенен юуда и содержания примесей в газеяв [слородных смесей при 298 К ж сев >спламенения составляет окот: : :•: > об.% кислорода. Существуют аиаш горючих смесей. Зависимость нижнего и верхи е:: : редставлена на рис. XII. 1. Кривая I ия горючей смеси. Ветвь АВ ределу давления. В заштрихо оспламенения или взрыва (а «акция течет медленно и [ламенение не наступает ни при т нижний предел давления р} и вер [ламенение невозможно. По.
с разветвленными цепями. Если ниже нижнего предела давлении, и енках сосуда. Поэтому нижний щ :еси, диаметра сосуда и материал Значительно. С ростом давдеаваг ветвляются, реакция идет сам ем и взрывом. При достижении не в цепей снова затрудняется из-за i олкновений с частицами загрязнив ем. Верхний предел воспламевеш личества примеси и мало зал стенок.
Возникновение цепного разным нарастанием числа стоянной температуре в резу.тьт
Тепловой взрыв возникает вив] реакции, когда выделение теплея больше теплоотдачи. При медленна отводится в окружающее прост] окисления лишь немного выше
При быстром протекании отводиться в окружающую срезу овышаться. По мере нагревание ыстро увеличивается, а вместе < выделения. Одновременно растет чем скорость тепловыделения. Свс
■-
от 0 до /, получаем
(XII-
(XIII
юрости цепной неразветвленна
paui
времени (*-» со) экспонента аи — к постоянному значения о вытеснения устанавливаете ой реакции.
-ь обрыва цепи. В самом деле, ■ыи случай, а v +1 звеньев пеня а Ра883 V(v+1); в связи с тем в"ло, считаем v+l~v_ Тогда выразить как
(XII.12
цепи будет меньше и ее
(XII.13
вероятность обрыва при ой разветвленной реакции
(XII.14)
то Я-д>0. При t-*a-«етвленной цепи.
14) удобно преобразовать
(XII. 15}
гаивается по экспоненциаль-оянной температуре.
