
- •Белки: строение, свойства и функции
- •1. Белки и их основные признаки
- •2. Биологические функции белков
- •3. Аминокислотный состав белков
- •4. Классификация белков
- •4.1. По растворимости
- •4.2. По форме молекул
- •5. Физические свойства белков
- •6. Структурная организация белковых молекул
- •6.1. Первичная структура белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •6.2. Вторичная структура белков
- •6.3. Третичная структура белков
- •7. Способность к специфическим взаимодействиям как основа биологической активности белков
- •8. Ингибиторы функций белков
- •9.Связь структуры белков с их функциями на примере гемоглобина и миоглобина Четвертичная структура белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •10. Изофункциональные белки
- •11. Изменения белкового состава организма
Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
Термин конформация используют для описания пространственного расположения в органической молекулы замещающих групп, способных свободно изменять свое положение в пространстве без разрыва каких бы то ни было связей.
Пептидная цепь обладает значительной гибкостью. В результате внутри цепочечных взаимодействий она приобретает определенную пространственную структуру (конформацию). В белках различают два уровня пространственной организации для одной полипептидной цепи: вторичную и третичную структуры белка. Для белков, содержащих несколько полипептидных цепей, возможно, рассматривают пространственную укладку этих цепей относительно друг друга - четвертичную структуру белка.
6.2. Вторичная структура белков
- это укладка белковой молекулы в пространстве без учета влияния боковых заместителей. Выделяют два типа вторичной структуры: -спираль и - структуру (складчатый слой). Остановимся более подробно на рассмотрении каждого типа вторичной структуры.
-Спираль представляет из себя правую спираль с одинаковым шагом, равным 3,6 аминокислотных остатков. -Спираль стабилизируется внутримолекулярными водородными связями, возникающими между атомами водорода одной пептидной связи и атомами кислорода четвертой по счету пептидной связи.
![]()
Боковые заместители расположены перпендикулярно плоскости -спирали.
Т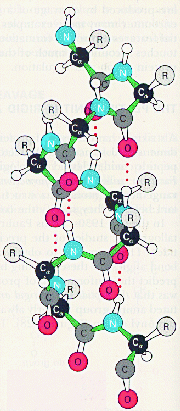 .о.
свойства данного белка определяются
свойствами боковых групп аминокислотных
остатков: входящих в состав того или
иного белка. Если боковые заместители
гидрофобны, то и белок, имеющий структуру
-спираль
гидрофобен. Примером такого белка
является белок кератин, из которого
состоят волосы.
.о.
свойства данного белка определяются
свойствами боковых групп аминокислотных
остатков: входящих в состав того или
иного белка. Если боковые заместители
гидрофобны, то и белок, имеющий структуру
-спираль
гидрофобен. Примером такого белка
является белок кератин, из которого
состоят волосы.
В результате получается, что - спираль пронизана водородными связями и является очень устойчивой структурой. При образовании такой спирали работают две тенденции:
-
молекула стремится к минимуму энергии, т.е. к образованию наибольшего числа водородных связей;
-
из-за жесткости пептидной связи сблизиться в пространстве могут лишь первая и четвертая пептидные связи.
В складчатом слое пептидные цепи располагаются параллельно друг другу, образуя фигуру, подобную листу, сложенному гармошкой. Пептидных цепей, взаимодействующих между собой водородными связями, может быть большое количество. Расположены цепи антипараллельно.
Ч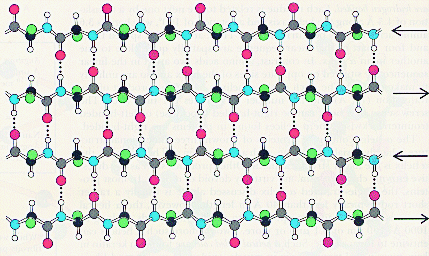 ем
больше пептидных цепей входит в состав
складчатого слоя, тем прочнее молекула
белка.
ем
больше пептидных цепей входит в состав
складчатого слоя, тем прочнее молекула
белка.
Сравним свойства белковых материалов шерсти и шелка и объясним различие в свойствах этих материалов с точки зрения строения белков, из которых они состоят.
Кератин - белок шерсти - имеет вторичную структуру -спираль. Шерстяная нить не такая прочная, как шелковая, легко растягивается в мокром состоянии. Это свойство объясняется тем, что при приложении нагрузки водородные связи рвутся и спираль растягивается.
Фиброин - белок шелка - имеет вторичную -структуру. Шелковая нить не вытягивается и является очень прочной на разрыв. Это свойство объясняется тем, что в складчатом слое взаимодействуют между собой водородными связями много пептидных цепей, что делает эту структуру очень прочной.
Аминокислоты различаются по способности участвовать в образовании -спиралей и -структур. Редко встречаются в -спиралях глицин, аспаргин, тирозин. Пролин дестабилизирует -спиральную структуру. Объясните, почему? В состав -структур входит глицин, почти не встречаются пролин, глютаминовая кислота, аспаргин, гистидин, лизин, серин.
В структуре одного белка могут находиться участки -структур, -спиралей и нерегулярные участки. На нерегулярных участках пептидная цепь может сравнительно легко изгибаться, менять конформацию, в то время, как спираль и складчатый слой представляют собой достаточно жесткие структуры. Содержание -структур и -спиралей в разных белках неодинаково.
