
- •Белки: строение, свойства и функции
- •1. Белки и их основные признаки
- •2. Биологические функции белков
- •3. Аминокислотный состав белков
- •4. Классификация белков
- •4.1. По растворимости
- •4.2. По форме молекул
- •5. Физические свойства белков
- •6. Структурная организация белковых молекул
- •6.1. Первичная структура белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •6.2. Вторичная структура белков
- •6.3. Третичная структура белков
- •7. Способность к специфическим взаимодействиям как основа биологической активности белков
- •8. Ингибиторы функций белков
- •9.Связь структуры белков с их функциями на примере гемоглобина и миоглобина Четвертичная структура белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •10. Изофункциональные белки
- •11. Изменения белкового состава организма
5. Физические свойства белков
На физических свойствах белков, таких как ионизация, гидратация, растворимость основаны различные методы выделения и очистки белков.
Так как белки содержат ионогенные, т.е. способные к ионизации аминокислотные остатки (аргинин, лизин, глутаминовая кислота и т.д.), следовательно, они представляют собой полиэлектролиты. При подкислении степень ионизации анионных групп снижается, а катионных - повышается, при подщелачивании наблюдается обратная закономерность. При определенном рН число отрицательно и положительно заряженных частиц становится одинаковым, такое состояние называется изоэлектрическим (суммарный заряд молекулы равен нулю). Значение рН, при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают рI. На различной ионизации белков при определенном значении рН основан один из методов их разделения - метод электрофореза.
Полярные группы белков (ионогенные и неионогенные) способны взаимодействовать с водой, гидратироваться. Количество воды, связанное с белком достигает 30-50 г на 100 г белка. Гидрофильных групп больше на поверхности белка. Растворимость зависит от количества гидрофильных групп в белке, от размеров и формы молекул, от величины суммарного заряда. Совокупность всех этих физических свойств белка позволяет использовать метод молекулярных сит или гель-фильтрацию для разделения белков. Метод диализа используется для очистки белков от низкомолекулярных примесей и основан на больших размерах молекул белка.
Растворимость белков зависит и от наличия других растворенных веществ, например, нейтральных солей. При высоких концентрациях нейтральных солей белки выпадают в осадок, причем для осаждения (высаливания) разных белков требуется разная концентрация соли. Это связано с тем, что заряженные молекулы белка адсорбируют ионы противоположного заряда. В результате частицы теряют свои заряды и электростатическое отталкивание, в результате происходит осаждение белка. Методом высаливания можно фракционировать белки.
6. Структурная организация белковых молекул
Белки - очень крупные молекулы, молярная масса белков колеблется от 6ооо до 1 млн. грамм/моль (см. таблицу).
|
Белок |
Мол.масса |
Число ост. |
Число цепей |
|
Инсулин (бычий) |
5733 |
51 |
2 |
|
Рибонуклеаза (из поджелудочной железы) |
13683 |
124 |
1 |
|
Лизоцим (из яичного белка) |
13930 |
129 |
1 |
|
Миоглобин (из миокарда лошади) |
16890 |
153 |
1 |
|
Химотрипсин (из поджел. железы быка) |
22600 |
241 |
3 |
|
Гемоглобин (человека) |
64500 |
574 |
4 |
|
Сывороточный альбумин (человека) |
68500 |
550 |
1 |
|
Гексокиназа (из дрожжей) |
102000 |
800 |
2 |
|
-Глобулин (лошади) |
149900 |
1250 |
4 |
|
Глутаматдегидрогеназа (из печени быка) |
1000000 |
8300 |
40 |
Некоторые белки в своем составе могут иметь химические группы небелковой природы. Такие белки называют сложными или холопротеинами. Неаминокислотную часть белков называют простетической группой, белковую часть - апоферментом. Сложные белки классифицируются по простетической группе. Например, липопротеины это белки, содержащие в своем составе группу - липид; металлопротеины содержат в своем составе ионы металла; в состав хромопротеинов входит хромофор, окрашенная группа небелковой природы. Частный случай, когда хромофором является гем. К таким белкам относятся гемоглобин и цитохромы. Простетические группы играют важную роль при функционировании сложного белка.
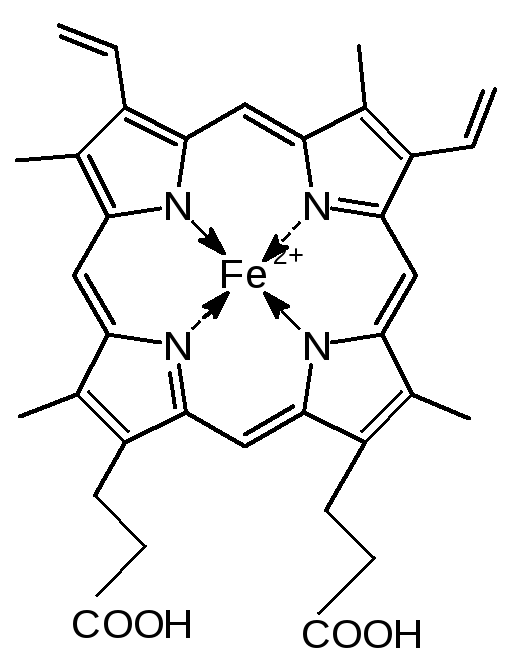
Простые белки можно классифицировать по форме молекул и по способности растворяться в воде на глобулярные и фибриллярные. Глобулярные белки имеют форму глобулы и, как правило, растворимы в воде. Фибриллярные белки имеют форму вытянутого волокна - фибриллы и нерастворимы в воде. Фибриллярные белки выполняют главным образом опорные функции, обеспечивая прочность тканей; глобулярные белки более разнообразны по функциям.
