
- •Белки: строение, свойства и функции
- •1. Белки и их основные признаки
- •2. Биологические функции белков
- •3. Аминокислотный состав белков
- •4. Классификация белков
- •4.1. По растворимости
- •4.2. По форме молекул
- •5. Физические свойства белков
- •6. Структурная организация белковых молекул
- •6.1. Первичная структура белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •6.2. Вторичная структура белков
- •6.3. Третичная структура белков
- •7. Способность к специфическим взаимодействиям как основа биологической активности белков
- •8. Ингибиторы функций белков
- •9.Связь структуры белков с их функциями на примере гемоглобина и миоглобина Четвертичная структура белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •10. Изофункциональные белки
- •11. Изменения белкового состава организма
3. Аминокислотный состав белков
Для определения аминокислотного состава белки подвергают гидролизу.
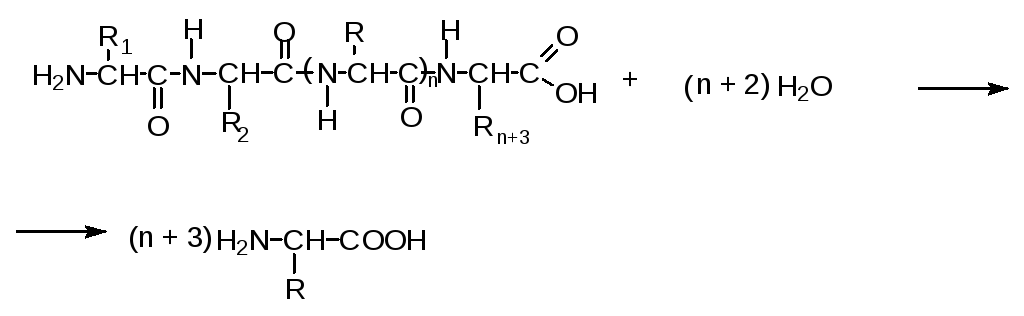
В состав белков входят 20 L--аминокислот: глицин, аланин, валин, лейцин, серин, глутаминовая кислота, глутамин, лизин, аргинин, пролин, аспарагиновая кислота, аспарагин, изолейцин, треонин, фенилаланин, тирозин, цистеин, метионин, гистидин, триптофан и некоторые производные этих аминокислот, образующиеся в белковой молекуле после матричного синтеза полипептидной цепи.
Частота, с какой аминокислоты встречаются в белках, неодинакова. Например, глицин обнаруживается в 10 раз чаще, чем триптофан. По частоте нахождения аминокислот в белках можно составить такой ряд: ала вал лей сер глу глн лиз арг про > асп асн изо тре фен > тир цис мет гис.
Большинство белков по аминокислотному составу отличаются не очень резко. Но некоторые белки с особыми свойствами отличаются и аминокислотным составом. Так, белок соединительной ткани коллаген на 1/3 построен из остатков глицина, около 1/5 на ост. пролина и оксипролина. Именно такой состав аминокислот позволяет готовой молекуле белка образовывать прочные олигомерные структуры - фибриллы. Фибриллы коллагена превосходят по прочности стальную проволоку равного поперечного сечения. При кипячении в воде нерастворимый коллаген превращается в желатину - растворимую смесь полипептидов. Необычный аминокислотный состав коллагена определяет его низкую питательную ценность. В состав связок и соединительной ткани стенок сосуда входит белок - эластин. Эластин богат остатками лизина. Четыре боковые группы лизина сближаются друг с другом и ферментативным путем превращаются в десмозин.
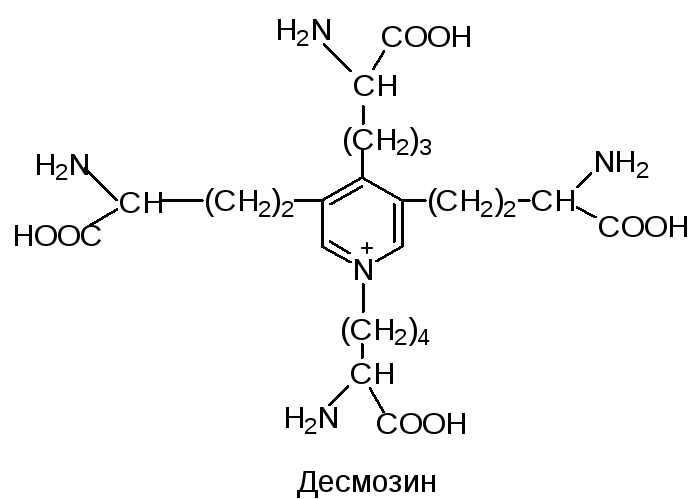
Таким путем полипептидные цепи эластина могут объединяться в системы, способные обратимо растягиваться во всех направлениях.
В хромосомах содержатся положительно заряженные белки гистоны, примерно на 1/3 построенные из остатков лизина и аргинина. Положительный заряд молекулы белка позволяет образовывать прочные комплексы с отрицательно заряженными молекулами нуклеиновых кислот.
4. Классификация белков
4.1. По растворимости
Альбумины. Растворимы в воде и солевых растворах.
Глобулины. Слаборастворимы в воде, но хорошо растворимы в солевых растворах.
Проламины. Растворимы в 70-80% этаноле, нерастворимы в воде и абсолютном спирте. Богаты аргинином.
Гистоны. Растворимы в солевых растворах.
Склеропротеины. Нерастворимы в воде и солевых растворах. Повышено содержание глицина, аланина, пролина.
4.2. По форме молекул
Если исходить из отношения осей (продольной и поперечной), можно выделить два больших класса белков. У глобулярных белков отношение составляет меньше 10 и в большинстве случаев не превышает 3-4. Они характеризуются компактной упаковкой полипептидных цепей. Примеры глобулярных белков: многие ферменты, инсулин, глобулин, белки плазмы крови, гемоглобин.
Фибриллярные белки, у которых отношение осей превышает 10, состоят из пучков полипептидных цепей, спирально навитых друг на друга и связанных между собой поперечными ковалентными или водородными связями (кератин, миозин, коллаген, фибрин).
