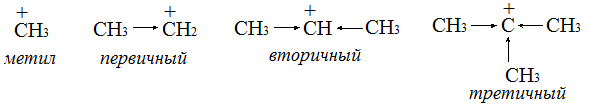- •Органическая химия
- •Оглавление
- •Введение
- •Общие методические указания по изучению учебной дисциплины
- •Унифицированные вопросы для самоконтроля
- •Методические указания по темам курса
- •Раздел 1.Основные теоретические положения органической химии.
- •Классификация органических соединений
- •Важнейшие классы органических соединений
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •Раздел 2. Природные источники органических соединений и продукты их переработки
- •Раздел 3. Алифатические углеводороды ( алканы, алкены, алкадиены, алкины)
- •Раздел 4. Галогенпроизводные алифатического ряда
- •Раздел 5. Кислородсодержащие соединения алифатического ряда
- •Раздел 6. Азотсодержащие соединения алифатического ряда
- •Раздел 7.Серосодержащие органические соединения
- •Раздел 8. Соединения со смешанными функциями
- •Раздел 9. Карбоциклические соединения ( циклоалканы, циклоалкены, арены)
- •Раздел 10. Ароматические галогенпроизводные
- •Раздел 11. Кислородсодержащие соединения ароматического ряда
- •Раздел 12. Ароматические сульфокислоты
- •Раздел 13. Азотсодержащие соединения ароматического ряда
- •Раздел 14. Многоядерные ароматические соединения
- •Раздел 15. Гетероциклические соединения
- •Раздел 16. Высокомолекулярные соединения
- •Список рекомендуемой литературы
Классификация органических соединений
Первым классификационным признаком является строение углеродного скелета (цепи). По этому признаку органические соединения классифицируют следующим образом:
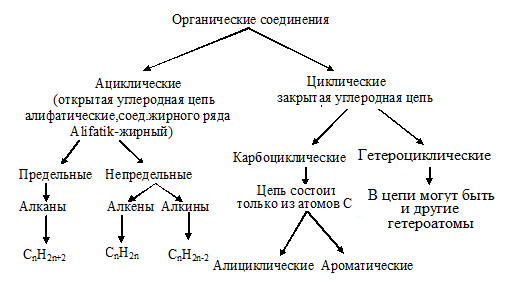
Если атомы углерода связаны только с атомами водорода, то соединения называют углеводородами. В углеводороде можно заменить (заместить) один или несколько атомов водорода какими-либо атомами или группами атомов, называемых заместителями. Неуглеводородные одно- или многовалентные заместители принято называть функциональными группами или просто функциями.
Характер (химическая природа) функциональной группы служит вторым классификационным признаком органических соединений.
Важнейшие классы органических соединений
|
Классы соединений |
Функциональные группы |
|||
|
Название |
Общая формула |
Название |
Общая формула
|
|
|
1 |
2 |
3 |
3 |
|
|
Спирты |
R-OH |
гидроксил |
-OH |
|
|
Оксосоединения: Альдегиды
Кетоны
Карбоновые кислоты
|
|
карбонил
карбоксил |
>C=O
|
|
|
Нитросоединения |
R-NO2 |
нитрогруппа |
-NO2 |
|
|
1 |
2 |
3 |
4 |
|
|
Аминосоединения |
R-NH2 R-NH-R
|
аминогруппа |
-NH2 |
|
|
Сульфосоединения: Сульфокислоты |
R -SO3H |
сульфогруппа |
-SO3H |
|
|
Галогенопроизводные |
R-Hal |
галогены |
-F,-Cl,-Br,-I |
|
|
Эфиры: Простые
Сложные |
R-O-R
|
алкокси-
алкоксикарбонил |
|
|
Где R– углеводородный радикал
Различают моно- и полифункциональные производные. Последние содержат несколько однородных функций. Соединения со смешанными функциями содержат разные функциональные группы.
Следует внимательно ознакомиться с классификацией соединений, понятиями радикал, первичный, вторичный и т д. атом углерода.
В органической химии до настоящего времени существует и параллельно применяется несколько систем названий органических соединений.
Самой первой номенклатурой в органической химии была историческая, или тривиальная, номенклатура, по которой ряд соединений получил название по источнику сырья, определенному использованием вещества или каким-либо важным его свойством. Таковы названия веществ: винный спирт - содержится в вине; серный эфир - получается из спирта в присутствии серной кислоты.
Первые четыре члена гомологического ряда предельных углеводородов - метан, этан, пропан, бутан - имеют тривиальные названия. С целью большей упорядоченности номенклатуры органических соединений на совещании Международного союза чистой и прикладной химии (International Union of Pure and Applied Chemistry, сокращено IUPAK; на русском языке ИЮПАК) в Лондоне в 1947 г. было принято решение о выработке новых международных правил. Эти правила положены в основу употребляемой в настоящее время в органической химии номенклатуры ИЮПАК (ее же называют международной или систематической), которая постоянно совершенствуется.
При образовании названий органических соединений по систематической номенклатуре руководствуются следующими правилами:
I. Выбирают главную, самую длинную цепь атомов углерода в молекуле (всякая цепь будет закопчённой, если первым и последним атомами углерода будут первичные атомы).
Например:
1 2 3 4 1 2 3 4
CH2 – CH2 – CH2 – CH2 CH3 – CH2 – CH2 – CH – CH3
5 CH3 5CH2 –CH3
6
2. Пронумеровывают атомы углерода главной цепи, начиная с того конца, ближе к которому расположена боковая цепь атомов углерода или другая группа атомов. Если боковых цепей несколько, предпочтение отдают меньшей. Названия всех радикалов боковых цепей перечисляют в порядке возрастания их молекулярных масс с указанием номера атома углерода главной цепи, с которой они связаны. Например:
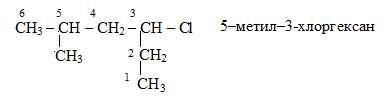
Главная функция получает меньший номер.
Окончание -ан подчеркивает, что главную цепь составляет предельный углеводород гексан (алкан).Окончание -ил обозначает одновалентный радикал (-алкил) предельного углеводорода (метил и др.).
3. Составляют название следующим образом: сначала называют алкильные заместители (метил, этил и др.), галоген, нитро-, аминогруппы, указывая порядковый номер атома углерода, с которым они связаны. Другие функциональные группы (гидроксильную, альдегидную, кетонную, двойную, тройную связь и др.) обозначают добавлением к названию углеводорода окончания –ол, -аль, -он, -ен, -ан и др.
Если атом имеет два одинаковых заместителя, то номер этого атома повторяют дважды, а перед названием одинаковых групп следует добавить частицы ди-, три-, тетра- и другие соответственно. Например:
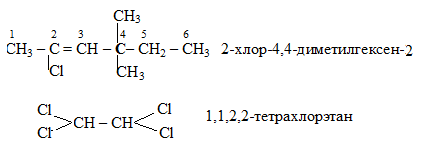
При наличии в соединении нескольких двойных или тройных связей перед окончанием -ен или -ин ставят умножающие приставки ди-, три-, тетра- и т.д. При наличии в соединении двойной и тройной связей двойную связь называют раньше тройной. Положение радикалов и функций показывают в названии цифрами, указывающими их место в главной цепи. Органические радикалы, нитрогруппа и галогены всегда обозначают приставками. Цифры, показывающие их положение, ставят перед приставками. Таким образом, при составлении названий наблюдают следующую очередность в названии заместителей и функций (табл. 1): нитро-, галоген-, окси-, оксо-, карбокси- (если функция не старшая), органические радикалы - название углеродной цепи (-ан, -ен, -ин), затем окончания -ол, -аль, -овая кислота (если функция старшая). Цифры в названии отделяют запятыми, а от названия соединения - черточкой (дефис). Приставки и окончания пишут слитно с названием главной цепи.
Развитие современных теоретических воззрений в области органической химии связано с квантово-механическим подходом к изучению строения соединений и реакций. Квантово-механический подход к электронному строению и поведению атомов и молекул выражается уравнением Э. Шрёдингера (1926), связывающим энергию электрона с его волновым движением. Из квантовой механики известно, что электроны в атоме располагаются на определенных орбиталях, которые отличаются разным запасом энергии. Положение электрона на орбитали не может быть определено точно, а характеризуется вероятностью (ψ2 ) пребывания электрона в определенной точке пространства. Функция ψ названа орбиталью. Различают атомные орбитали и молекулярные орбитали на которых находятся электроны в молекуле.
При изучении органической химии особый интерес представляет электронное строение атома углерода, так как с этим связаны его особые свойства, определяющие во многом различия между органическими и неорганическими соединениями.
Углерод - первый элемент IV группы периодической системы элементов. В основном (невозбужденном) состоянии электронная конфигурация атома углерода 1s2 2s2 2p2. В момент химической реакции атом углерода переходит из основного в возбужденное состояние, происходит распаривание 2s-электронов и переход одного их них на свободную 2p- орбиталь. Образуются 4 неспаренных электрона: один – 2s и три – 2p, различные по своему энергетическому состоянию. Электронная конфигурация возбужденного атома углерода– 1s22s 2p3.
Согласно квантово-механическим представлениям электроны s- уровня располагаются на орбиталях сферической формы, а электроны p-уровня на 3-х гантелеобразных орбиталях, направленных по трем взаимно перпендикулярным осям координат. Можно ожидать, что связи, образованные углеродом с другими атомами будут неравноценными. В действительности, в симметрично построенных органических соединениях (например СH4, CCL4 и др.) все 4 связи одинаковы. Для объяснения равноценности связей Полингом введено понятие гибридизации (смешения) орбиталей, согласно которому электроны в молекулах, как правило, располагаются не на «чистых» S- и P- орбиталях, а на смешанных – гибридных. Такие орбитали полнее перекрываются с орбиталями других атомов, образуя более прочные связи.
Для атома углерода возможны три валентных состояния с различными типами гибридизации:
1 валентное состояние – sp3 гибридизация. Смешение одной 2S- и трех 2P- –орбиталей приводит к образованию четырех одинаковых гибридных орбиталей. Такая геометрия обеспечивает минимальное отталкивание между электронами. Первое валентное состояние характерно для предельных углеводородов (СН3 –СН3) .
2 валентное состояние –sp2 гибридизация. Образуется в результате смешения одной s и 2-х p орбиталей третья 2p орбиталь не принимает участие в гибридизации и располагается в плоскости перпендикулярной плоскости гибридных орбиталей. Этот тип связей характерен для непредельных углеводородов ряда этилена CH2=CH2.
3 валентное состояние –sp гибридизация. При смешение одной s и одной p орбиталей образуется две гибридные орбитали расположенные на одной прямой. Две другие р орбитали не участвуют в гибридизации и располагаются во взаимно перпендикулярных плоскостях. Этот тип гибридизации характерен для атомов углерода, связанных тройной связью – непредельные ряда ацетилена HC≡CH.
При изучении материала о типах химической связи, необходимо иметь в виду, что в органической химии в основном мы встречаемся с ковалентной связью, которая образуется в результате обобщения неспаренных электронов с противоположными (антипараллельными) спинами. При этом происходит перекрывание орбитали одного атома с орбиталью другого.
Связь между атомами, осуществляемая одной парой электронов называют простой, одинарной или сигма (σ) - связью. Если в образовании ковалентной связи принимают участие две или три электронные пары, то связь называют кратной, она может быть двойной (две пары электронов) или тройной (три пары электронов). При изучении основных характеристик ковалентной связи следует обратить внимание на понятия полярность и поляризуемость, индукционный эффект (смещение электронной плотности по s- связям в сторону более электроотрицательного атома), рассмотреть частные случаи ковалентной связи, рассмотреть условия возникновения водородной связи, играющей очень важную роль в живой природе в биохимических процессах.
Все химические реакции сопровождаются разрывом одних химических связей и возникновением других. Распад ковалентной связи между двумя атомами может протекать с образованием свободных радикалов - гомолитический или ионов - гетеролитический распад.
Гомолитический или радикальный распад ковалентной связи можно представить следующей схемой:
А• | • В = А• +• В
Активный свет, кислород и другие радикалы способствуют гомолитическому распаду молекул. Свободные радикалы имеют неспаренный (холостой) электрон; они образуются, главным образом, в газовой фазе, т.е. при нагревании, и в растворах неполярных растворителей. Открыть их присутствие в реакционной системе можно с использованием методов электронной спектроскопии.
Гетеролитический или ионный распад связи схематически можно описать следующим образом:
А : ) В ↔ А:−+В+ или А ( : В ↔ А + + : В−
При разрыве связи одна их частей молекулы захватывает оба электрона ковалентной связи, образуются отрицательные карбанионы и карбкатионы. Ионный распад происходит в присутствии катализаторов А1С13,FеС13и др. кислот Льюиса, протекает в полярных растворителях, на холоде и в темноте.
По характеру химических превращений можно выделить три основных типа реакций:
Реакции замещения:
CH4+Cl2→CH3Cl+HCl
хлорметан
Реакции присоединения:
CH2=CH2+Br2→CH2Br-CH2Br
1,2-дибромэтан
К реакциям присоединения относят и реакции восстановления (присоединение атомов водорода):
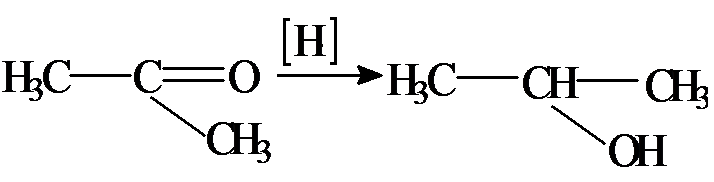
ацетон изопропиловый спирт
К этому типу реакций можно также отнести реакции полимеризации, когда в результате присоединения друг к другу большого числа простых веществ (мономеров) образуется новое вещество сложного строения с большей молекулярной массой:
n CH2=CH2 → [-CH2-CH2-]n
Сюда относят также реакции конденсации и поликонденсации, когда образуется более сложное вещество в результате соединения нескольких молекул и выделения простых веществ (воды, аммиака и др.):
HO-CH2-CH2-OH + HO-CH2-CH2-OH→HO-CH2-CH2-O-CH2-CH2-OH
этиленгликоль -H2O димер этиленгликоля
n HO-CH2-CH2-OH → [-CH2-CH2-O-]n + n H2O
Реакции отщепления:
Н+,t
CH3-CH2-CH2OH → CH3 -CH=CH2 + H2O
Однако химические реакции удобнее классифицировать по механизмам.
В зависимости от характера атакующего реагента и природы связей в реагирующей молекуле реакция может протекать по двум основным механизмам:
1. Гетеролитическому или ионному;
2. Гомолитическому или радикальному.
Следует более подробно ознакомиться с классификацией реакций по этим механизмам.
Место вступления реагента в молекулу углеводорода определяется вероятностью образования и стабильностью возникающего радикала или иона. Третичные радикалы более стабильны, т.к. свободная орбиталь сопрягается с наибольшим числом электронов С -Н связей .
В связи с этим реакции замещения идут избирательно и наиболее легко у третичного атома углерода.
Стабильность ионов карбония также увеличивается в ряду: