
- •Органическая химия
- •Оглавление
- •Введение
- •Общие методические указания по изучению учебной дисциплины
- •Унифицированные вопросы для самоконтроля
- •Методические указания по темам курса
- •Раздел 1.Основные теоретические положения органической химии.
- •Классификация органических соединений
- •Важнейшие классы органических соединений
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •Раздел 2. Природные источники органических соединений и продукты их переработки
- •Раздел 3. Алифатические углеводороды ( алканы, алкены, алкадиены, алкины)
- •Раздел 4. Галогенпроизводные алифатического ряда
- •Раздел 5. Кислородсодержащие соединения алифатического ряда
- •Раздел 6. Азотсодержащие соединения алифатического ряда
- •Раздел 7.Серосодержащие органические соединения
- •Раздел 8. Соединения со смешанными функциями
- •Раздел 9. Карбоциклические соединения ( циклоалканы, циклоалкены, арены)
- •Раздел 10. Ароматические галогенпроизводные
- •Раздел 11. Кислородсодержащие соединения ароматического ряда
- •Раздел 12. Ароматические сульфокислоты
- •Раздел 13. Азотсодержащие соединения ароматического ряда
- •Раздел 14. Многоядерные ароматические соединения
- •Раздел 15. Гетероциклические соединения
- •Раздел 16. Высокомолекулярные соединения
- •Список рекомендуемой литературы
Раздел 14. Многоядерные ароматические соединения
Соединения с неконденсированными бензольными ядрами. Среди этих соединений следует выделить группы дифенила, дифенилметана, трифенилметана и симметричного дифенилэтана. Молекула дифенила образована двумя связанными между собой фенильными радикалами С6Р5 – С6Н5 . Важнейшее производное дифенила – бензидин, который используется в синтезе красителей.
Изучая химические свойства дифенилметана С6Р5 – СН2 – С6Н5, обратите внимание на подвижность атомов водорода метиленовой группы, используемую при получении соответствующих спиртов и кетонов. Единственный атом водорода в метиновой группе трифенилметана НС(С6Н5)3, под влиянием фенильных групп становится ещё более подвижным, чем атомы водорода метиленовой группы дифенилметана. Он легко обменивается на галогены и металлы и окисляется до спиртовой группы. Причина этого – устойчивость трифенилметильных ионов и радикалов. Обратите внимание на реакции взаимных превращений трифенилметана, трифенилхлорметана и трифенилкарбинола. Соединения ряда дифенилэтана используются чаще в виде их производных.
Соединения
с конденсированными
бензольными ядрами. Свойства
этих соединений рассматриваются на
примере углеводородов – нафталина,
антрацена и фенантрена и наиболее
известных их производных. В молекулах
нафталина, антрацена, фенантрена и
других конденсированных ароматических
углеводородов невозможно такое полное
выравнивание электронной плотности,
как в молекулах бензола; ароматические
свойства их ослаблены и они проявляют
большую ненасыщенность. Монозамещенные
производные нафталина существуют в
виде α - и β- изомеров.
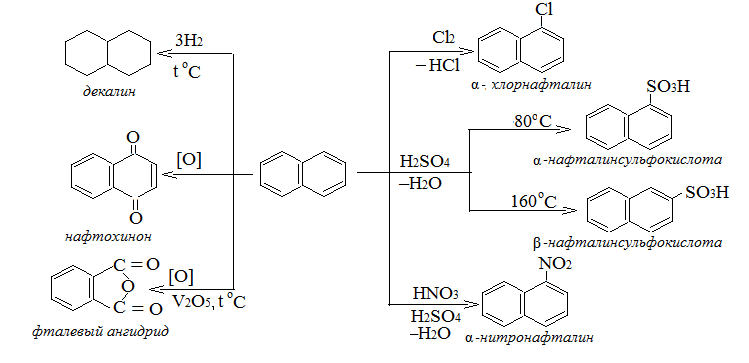
Электронная плотность у α-углеродного атома его молекулы выше, чем у β-атома, поэтому нафталин легко вступает в реакции электрофильного замещения преимущественно в α –положение (при этом образуется более устойчивый σ-комплекс) и окисляется в нафтохинон в мягких условиях. Окисление его в жестких условиях кислородом воздуха сопровождается расщеплением одного или обоих колец с образованием фталевого и малеинового ангидридов – технически важных продуктов.
Ещё меньшей ароматичностью и большей ненасыщенностью отличаются антрацен и фенантрен, которые легко присоединяют водород, бром и окисляются.
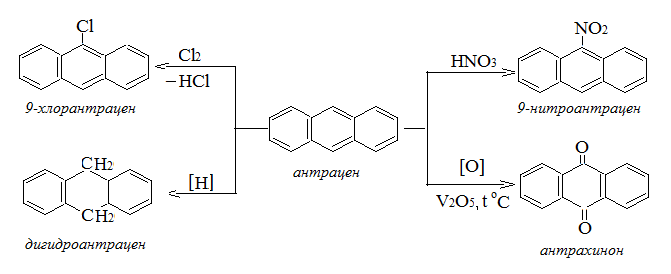
Производное антрацена – 1,2-диоксиантрахинон (ализарин) используется как краситель.
Раздел 15. Гетероциклические соединения
Циклы в молекулах гетероциклических соединений построены не только из атомов углерода, но содержат один или больше атомов других элементов, гетероатомов. Чаще всего это атомы азота, кислорода и серы. Гетероциклические соединения распространены в природе. Они входят в состав хлорофилла и гемоглобина, многих биологически активных соединений (медикаментов), красителей.
Гетероциклы могут быть насыщенными и ненасыщенными, т.е. иметь двойные и тройные связи, моноциклическими и полициклическими. Данный раздел посвящен гетероциклическим соединениям с одним гетероатомом, проявляющим, подобно бензолу, ароматический характер.
Ароматичность
пятичленных гетероциклов пиррола,
фурана, тиофена с двумя сопряженными
 -связями и гетероатомом между ними
объясняется делокализацией свободной
р-электронной
орбитали гетероатомов с образованием
ароматического секстета электронов.
При этом гетероатом значительно теряет
способность к алкилированию, окислению.
-связями и гетероатомом между ними
объясняется делокализацией свободной
р-электронной
орбитали гетероатомов с образованием
ароматического секстета электронов.
При этом гетероатом значительно теряет
способность к алкилированию, окислению.
Фуран
по своим химическим свойствам занимает
промежуточное положение между сопряженными
диенами и ароматическими соединениями.
Он легко вступает в реакции диенового
синтеза с диенофилами, например малеиновым
ангидридом, и способен окисляться легче,
чем тиофен. При действии минеральных
кислот на молекулы фурана и пиррола
протон кислоты присоединяется к
гетероатому за счет его свободной
электронной пары. Последняя при этом
выключается из сопряжения с
 –системой цикла, что приводит к нарушению
ароматичности молекул, полимеризации
и осмолению образовавшихся диенов.
Такое отношение соединений к кислотам
называется ацидофобностью. Вследствие
ацидофобности пиррола и фурана они не
могут сульфироваться и нитроваться
кислотами. Эти реакции проводятся в
особых условиях.
–системой цикла, что приводит к нарушению
ароматичности молекул, полимеризации
и осмолению образовавшихся диенов.
Такое отношение соединений к кислотам
называется ацидофобностью. Вследствие
ацидофобности пиррола и фурана они не
могут сульфироваться и нитроваться
кислотами. Эти реакции проводятся в
особых условиях.
Ароматические свойства наиболее сильно выражены у тиофена. Он заметно устойчивее к действию кислот и окислителей и не реагирует с диенофилами. Атом серы в тиофене более инертен, алкилируется лишь в жестких условиях, не проявляет ацидофобности. Тиофен способен сульфироваться на холоду серной кислотой. Эта реакция используется для очистки от примесей тиофена бензола, который в этих условиях не сульфируется.
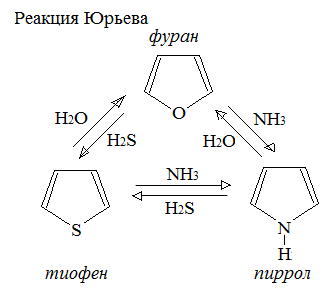
Обратите внимание на методы получения фурана, тиофена, пиррола, а также на возможность взаимных превращений этих соединений:
Структура молекулы наиболее изученного ароматического гетероцикла из шести атомов – пиридина С5Н5N – напоминает структуру бензола. У них близки длины связей в циклах, углы между связями в обеих молекулах 120о. Но в отличие от неполярного бензола кольцо пиридина представляет собой диполь с большим электрическим моментом. Отрицательный заряд в нем сосредоточен на атоме азота, а положительный – на атомах углерода.
Свободная
р-электронная
пара атома азота в образовании
ароматического кольца не участвует, и
его нуклеофильные свойства за счет этой
пары полностью сохраняются. Он способен
присоединять протон, галогеналкилы,
галогены. В этих реакциях пиридин ведёт
себя как основание – третичный амин.
Дефицит электронной плотности на атомах
углерода пиридинового кольца обуславливает
его малую активность в реакциях
электрофильного замещения ( меньшую,
чем у нитробензола) и повышенную
активность в нуклеофильном замещении.
В соответствии с распределением
электронной плотности проявляется
β-ориентация
в первом случае и α-,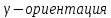 –
во втором. Электрофильное
замещение требует жестких условий и
даёт невысокие выходы продуктов. Обратите
внимание на легкость, в отличие от
бензола, раскрытия кольца пиридина.
–
во втором. Электрофильное
замещение требует жестких условий и
даёт невысокие выходы продуктов. Обратите
внимание на легкость, в отличие от
бензола, раскрытия кольца пиридина.
Применение различных ароматических гетероциклических соединений и их производных в технике весьма разнообразно; ознакомьтесь с его основными направлениями.
