
Основы физической химии_Ерёмин
.pdf
|
|
|
|
Г л а в а 3. Электрохимия |
|
|
|
|
189 |
||||
Сопоставление кристаллографических и стоксовских радиусов |
Таблица 12-1 |
||||||||||||
Ион |
rcr, Å |
|
rSt, Å |
|
Ион |
Rcr, Å |
|
rSt, Å |
|
|
|||
|
Li+ |
0.60 |
|
2.51 |
|
Zn2+ |
0.75 |
|
3.25 |
|
|
||
|
Na+ |
1.02 |
|
1.84 |
|
Al3+ |
0.53 |
|
4.38 |
|
|
||
|
K+ |
1.38 |
|
1.25 |
|
Cl– |
1.81 |
|
1.21 |
|
|
||
|
Rb+ |
1.49 |
|
1.18 |
|
Br– |
1.96 |
|
1.18 |
|
|
||
Mg2+ |
0.72 |
|
3.47 |
|
I– |
2.20 |
|
1.17 |
|
|
|||
|
Как видно из таблицы, для небольших и сильно заряженных ионов |
|
|
||||||||||
стоксовские радиусы существенно превосходят кристаллографические. |
|
|
|||||||||||
Это можно объяснить тем, что эти ионы в водном растворе обладают |
|
|
|||||||||||
большой гидратной оболочкой. Соответственно, разность объемов гид- |
|
|
|||||||||||
ратированного и негидратированного ионов равна объему гидратной |
|
|
|||||||||||
оболочки, и из нее можно рассчитать число связанных ионом молекул |
|
|
|||||||||||
воды, то есть число гидратации иона. |
|
|
|
|
|
|
|||||||
|
В то же время, из таблицы 12-1 видно, что для остальных ионов |
|
|
||||||||||
стоксовские радиусы оказываются меньше кристаллографических. Та- |
|
|
|||||||||||
кое |
расхождение |
объясняется |
|
|
|
|
|
|
|||||
тем, что закон Стокса для описа- |
|
|
|
|
|
|
|||||||
ния движения иона в растворе |
|
|
|
|
|
SO42- |
|||||||
строго не применим, поскольку |
250 |
|
|
|
|
|
|||||||
размеры |
иона |
сопоставимы |
с |
|
|
|
|
|
Cl- |
||||
размерами молекул растворителя, |
200 |
|
|
|
|
||||||||
и его можно считать однородной |
|
|
|
|
K+ |
||||||||
средой лишь приближенно. Тем |
|
|
|
|
|
Ca2+ |
|||||||
не менее, хотя уравнение (12.16) |
150 |
|
|
|
|
Mg2+ |
|||||||
не является строгим, оно полезно |
|
|
|
|
Na+ |
||||||||
для приближенных расчетов. |
|
|
|
|
|
|
Li+ |
||||||
|
Электропроводность |
раство- |
|
|
|
|
|
||||||
|
100 |
|
|
|
|
|
|||||||
ров |
электролитов |
увеличивается |
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||||
с повышением температуры. Пре- |
|
|
|
|
|
|
|||||||
дельная |
подвижность большин- |
50 |
|
|
|
|
|
||||||
ства ионов в водном растворе при |
|
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||
100 °С в 5–6 раз выше, чем при |
|
|
|
|
|
|
|||||||
0 °С. (рис. 12.3). |
|
|
|
|
0 |
|
|
|
|
|
|||
|
Такая зависимость в основном |
20 |
40 |
60 |
80 |
100 |
|||||||
|
0 |
||||||||||||
обусловлена уменьшением вязко- |
|
|
|
t, °C |
|
|
|||||||
сти воды при повышении темпе- |
Зависимость предельной |
Рис. 12.3 |
|||||||||||
ратуры. Если считать, что радиус |
|||||||||||||
подвижности некоторых ионов |
|
|
|||||||||||
гидратированного иона не зависит |
от температуры |
|
|
||||||||||
от температуры, то из уравнения |
|
|
|
|
|
|
|||||||
(12.16) следует правило Вальдена–Писаржевского, согласно которому |
|
|
|||||||||||
при любой температуре: |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
λ 0η = |
z eF |
= const . |
|
|
|
(12.17) |
||
|
|
|
|
|
|
6πr |
|
|
|
|
|
|
|
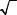
190 |
Г л а в а 3. Электрохимия |
Соотношение (12.17) выполняется в широком интервале температур только для небольшого числа ионов, что обусловлено как нестрогостью закона Стокса, так и изменением радиуса гидратированных ионов при изменении температуры. В целом при повышении температуры произведение λ0η уменьшается, но это уменьшение в интервале от 0 °С до 100 °С не превышает 25%.
При постоянной температуре, согласно соотношению (12.17), произведение λ0η для одного и того же иона в разных растворителях должно оставаться постоянным. Это соотношение приближенно выполняется только для больших и слабо сольватированных ионов, поскольку в общем случае сольватация ионов в разных растворителях различна.
Теоретически описать электропроводность разбавленных растворов сильных электролитов позволила теория Дебая–Хюккеля–Онсагера.
Отличие λ от λ0 в растворах сильных электролитов объясняется межионными взаимодействиями. Согласно теории Дебая–Хюккеля (см. § 11), каждый ион в растворе окружен ионной атмосферой. Существованием ионной атмосферы обусловлены два эффекта, которые вызывают замедление движения ионов в растворе – электрофоретический и релаксационный. Электрофоретический эффект вызывается тем, что под действием электрического поля центральный ион и окружающая его ионная атмосфера движутся в противоположные стороны. Таким образом, ион перемещается не в неподвижной среде, а в потоке ионов, движущихся ему навстречу. При движении ион смещается из центра своей ионной атмосферы, в результате чего нарушается ее симметрия, и плотность заряда позади иона оказывается больше, чем впереди него. В результате на центральный ион действует возвращающая сила, замедляющая его движение. Этот эффект называется релаксационным, или эффектом асимметрии ионной атмосферы.
Учет обоих эффектов приводит к уравнению Дебая–Хюккеля– Онсагера:
(12.18) |
λ = λ 0 − (A + Bλ 0 ) c , |
где A и B – коэффициенты, описывающие соответственно электрофоретический и релаксационный эффекты и зависящие от температуры, вязкости и диэлектрической проницаемости растворителя, а также от зарядов ионов электролита.
Уравнение (12.18) по форме аналогично эмпирическому уравнению Кольрауша (12.5) и, таким образом, дает его теоретическое обоснование. Уравнение (12.18) согласуется с опытными данными в разбавленных растворах при концентрациях до 0.001 моль л–1.
Если к раствору электролита приложить постоянное электрическое поле высокой напряженности (порядка 107 В м–1), то ионы в растворе движутся настолько быстро, что ионная атмосфера не успевает сфор-

Г л а в а 3. Электрохимия |
191 |
мироваться, в результате чего исчезают оба эффекта торможения – релаксационный и электрофоретический, и электропроводность раствора стремится к предельному значению λ0. Это явление называется эффектом Вина. В растворах слабых электролитов эффект Вина выражен значительно сильнее, что объясняется увеличением степени диссоциации слабого электролита под действием электрического поля.
Под действием переменного электрического поля достаточно высокой частоты ион не успевает сместиться на заметное расстояние от центра своей ионной атмосферы, поэтому ее симметрия сохраняется, в результате чего исчезает релаксационный эффект, что приводит к возрастанию электропроводности раствора. Это явление называется эффектом Дебая–Фалькенхагена. В то же время из-за наличия ионной атмосферы электрофоретический эффект сохраняется.
ПРИМЕРЫ
Пример 12-1. Удельная электропроводность 0.135 моль л–1 раствора пропионовой кислоты C2H5COOH равна 4.79 10–2 См м–1. Рассчитайте эквивалентную электропроводность раствора, константу диссоциации кислоты и pH раствора, если предельные подвижности H+ и C2H5COO– равны 349.8 См см2 моль–1 и 37.2 См см2 моль–1 соответственно.
Решение.
λ0 = 349.8 + 37.2 = 387.0 См см2 моль–1.
κ |
|
4.79 10−2 См м−1 |
|
|
2 |
|
|
–1 |
|
||||||
λ = c |
= |
|
|
|
|
= 3.55 См см |
моль |
|
|
. |
|||||
|
0.135 моль л−1 |
|
|
||||||||||||
|
|
|
|
α = λ/λ0 = 3.55/387.0 = 0.009. |
|
|
|
|
|
||||||
K = |
|
α2 c |
|
= |
0.0092 0.135 |
= 1.15 10 |
–5 |
(моль л |
–1 |
). |
|||||
1 − α |
1 − 0.009 |
|
|
|
|
||||||||||
[H+] = αc = 1.24 10–3(моль л–1). pH = –lg[H+] = 2.91.
Ответ. λ = 3.55 См см2 моль–1; α = 0.009; K = 1.15 10–5 моль л–1; pH = 2.91.
Пример 12-2. Удельная электропроводность насыщенного раствора BaCO3 в воде при 18 °C равна 2.540 10–3 См м–1. Удельная электропроводность воды 4.5 10–5 См м–1. Подвижности ионов Ba2+ и CO32– при 18 °C равны соответственно 55 и 66 См см2 г-экв–1. Рассчитайте растворимость BaCO3 в воде при 18 °C в моль л–1, считая соль полностью диссоциированной, а подвижности ионов равными подвижностям при бесконечном разведении.

192 |
Г л а в а 3. Электрохимия |
Решение.
κ(BaCO3) = κ(р-ра) – κ(H2O) = 2.540 10–3 – 4.5 10–5 = 2.495 10–3 См м–1.
λ0(BaCO3) = λ0 (Ba2+) + λ0 (CO32–) =
= 55 + 66 = 121 См см2 г-экв–1 = 1.21 10–2 См м2 г-экв–1.
|
κ |
|
2.495 10−3 См м−1 |
–3 |
|
–4 |
–1 |
|
c = |
|
= |
|
= 0.206 г-экв м |
|
= 1.03 10 |
|
моль л . |
λ0 |
1.21См м2 г-экв−1 |
|
|
|||||
Ответ. c = 1.03 10–4 моль л–1.
Пример 12-3. Удельная электропроводность раствора Mg(NO3)2 с массовой долей 5% при 18 °C равна 4.38 См м–1, а его плотность – 1.038 г см–3. Рассчитайте эквивалентную электропроводность раствора и кажущуюся степень диссоциации соли в растворе. Подвижности ионов Mg2+ и NO3– при 18 °C равны соответственно 44.6 и 62.6 См см2 г-экв–1.
Решение.
c = |
ω ρ |
= |
0.05 1.038 г см−3 |
|
–1 |
–1 |
||||
|
|
|
|
|
= 0.35 моль л |
= 0.70 г-экв л . |
||||
M Mg(NO3 )2 |
|
|
148 г моль−1 |
|||||||
|
|
|
κ |
|
|
4.38 См м−1 |
2 |
|
–1 |
|
|
λ = |
c |
= |
|
|
|
= 62.5 См см |
г-экв . |
||
|
|
0.70 г-экв л−1 |
||||||||
λ0 = 44.6 + 62.6 = 107.2 См см2 г-экв–1.
α = λ/λ0 = 62.5/107.2 = 0.583.
Ответ. λ = 62.5 См см2 г-экв–1, α = 0.583.
Пример 12-4. В таблице приведены результаты измерения скорости движения молекул сывороточного альбумина быка (САБ) в электрическом поле при различных значениях pH раствора (отрицательные значения скорости соответствуют изменению направления движения частиц под действием поля). Используя эти данные, определите изоэлектрическую точку САБ.
pH |
4.20 |
4.56 |
5.20 |
5.65 |
6.30 |
v, мкм с–1 |
0.50 |
0.18 |
–0.25 |
–0.60 |
–0.95 |
Решение. Электрическое поле не влияет на движение нейтральных частиц. Изменение скорости движения молекул САБ при изменении кислотности раствора свидетельствует о том, что в растворе образуются ионные формы САБ. Изоэлектрической точке отвечает нулевой суммарный заряд белка, поэтому для определения этой точки надо найти значение pH, при котором скорость v равна нулю. Строим график зави-
симости v = f(pH) и находим pH(v = 0) = 4.8.

194 |
Г л а в а 3. Электрохимия |
дящимся на расстоянии 1 см друг от друга. Сколько времени понадобится иону, чтобы пройти расстояние от одного электрода до другого?
12-10. Удельная электропроводность водного раствора KI равна 89.00 См·м–1, а раствора KCl той же концентрации – 186.53 См м–1. Удельная электропроводность раствора, содержащего обе соли, равна 98.45 См м–1. Рассчитайте долю KCl в растворе.
12-11. Эквивалентная электропроводность водного раствора сильного электролита при 25 °C равна 109.9 Смсм2 моль–1 при концентрации 6.2 10–3 мольл–1 и 106.1 Смсм2 моль–1 при концентрации 1.5 10–2 мольл–1. Какова эквивалентная электропроводность раствора при бесконечном разбавлении?
12-12. Эквивалентная электропроводность водного раствора слабой одноосновной кислоты при 25 °C равна 16.0 См см2 моль–1 при концентрации 1.0 10–2 моль л–1 и 48.4 См см2 моль–1 при концентрации 1.0 10–3 моль л–1. Рассчитайте эквивалентную электропроводность раствора при бесконечном разбавлении и константу диссоциации кислоты.
12-13. Рассчитайте радиус иона N(CH3)4+ по закону Стокса из его предельной подвижности в водном растворе при 25 °C. Вязкость воды при 25 °C равна 8.91 10–4 Па с. Оцените предельную подвижность этого иона в глицерине, вязкость которого равна 1.49 Па с.
12-14. Оцените предельную подвижность иона K+ в формамиде и метилацетате, если вязкость формамида в 3.7 раз больше, а вязкость метилацетата в 2.6 раз меньше, чем вязкость воды.
12-15. Рассчитайте удельную электропроводность 1.0 10–2 M водного раствора NaCl при 25 °C, считая, что подвижности ионов при этой концентрации равны их предельным подвижностям. Через слой раствора длиной 1 см, заключенный между электродами площадью 1 см2, пропускают ток силой 1 мА. Какое расстояние пройдут ионы Na+ и Cl– за 10 минут?
12-16. Рассчитайте эффективный радиус иона Li+ при 25 °C из его предельной подвижности, используя закон Стокса. Рассчитайте приблизительное число молекул воды, входящих в гидратную оболочку иона Li+. Кристаллографический радиус иона Li+ равен 60 пм. Вязкость воды при 25 °C равна 8.91 10–4 Па с. Собственный объем молекулы воды оцените из параметров уравнения Ван-дер-Ваальса.
12-17. Константа диссоциации гидроксида аммония равна 1.79 10–5 моль л–1. Рассчитайте концентрацию NH4OH, при которой степень диссоциации равна 0.01, и эквивалентную электропроводность раствора при этой концентрации.
Г л а в а 3. Электрохимия |
|
195 |
|
12-18. Эквивалентная электропроводность |
1.59 10–4 моль л–1 |
раствора |
|
уксусной кислоты при 25 °C равна 12.77 |
См см2 моль–1. Рассчитайте |
||
константу диссоциации кислоты и pH раствора.
12-19. Константа диссоциации масляной кислоты C3H7COOH равна 1.74 10–5. Эквивалентная электропроводность раствора при разведении 1024 л моль–1 равна 41.3 См см2 моль–1. Рассчитайте степень диссоциации кислоты и концентрацию ионов водорода в этом растворе, а также эквивалентную электропроводность раствора при бесконечном разведении.
12-20. Эквивалентная электропроводность раствора гидроксида этиламмония C2H5NH3OH при бесконечном разведении равна 232.6 См см2 моль–1. Рассчитайте константу диссоциации гидроксида этиламмония, эквивалентную электропроводность раствора, степень диссоциации и концентрацию ионов гидроксила в растворе при разведении 16 л моль–1, если удельная электропроводность раствора при данном разведении равна 1.312 10–3 См см–1.
§ 13. Электрохимические цепи
Электрохимические цепи – системы, состоящие из двух электродов, помещенных в раствор электролита или в два разных раствора, находящихся в контакте друг с другом. Электрохимические цепи, способные вырабатывать электрическую энергию, называют гальваническими эле-
ментами.
Классификация цепей
В химических цепях источником электрической энергии является энергия Гиббса протекающей в системе окислительно-восстановитель- ной («токообразующей») химической реакции. Реакции окисления и восстановления («полуреакции») в гальваническом элементе протекают на разных электродах, т.е. пространственно разделены. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, – катодом. Электроны, образовавшиеся в процессе окисления на аноде, перемещаются по внешней цепи к катоду, на котором они участвуют в процессе восстановления. Комбинируя различные окислительно-восстановительные полуреакции, можно получить большое число гальванических элементов.
Концентрационные цепи состоят из одинаковых электродов, но отличаются концентрацией веществ, участвующих в окислительновосстановительных процессах. Концентрационные цепи можно соста-

 O H
O H