
Основы физической химии_Ерёмин
.pdf
Г л а в а 2. Приложения химической термодинамики
|
|
xc x d |
|
|||
K |
x |
= |
C |
D |
|
, |
|
|
|||||
|
x a |
xb |
|
|||
|
|
|
A |
B равн. |
|
|
147
(9.11.а)
|
|
cc c d |
|
|
||
K |
c |
= |
C D |
|
. |
(9.11.б) |
|
||||||
|
c a cb |
|
||||
|
|
|
A B равн. |
|
|
|
Взаимосвязь между Kp, Kx и Kc устанавливается с помощью закона Дальтона и уравнения состояния идеального газа:
|
|
|
|
pc |
p d |
|
xc xd |
pc+d −a−b |
||||||
|
|
K |
p |
= |
C D |
|
|
= |
C D |
|
||||
|
|
|
|
|
|
|||||||||
|
|
|
p a |
pb |
|
x a xb |
|
|
||||||
|
|
|
|
|
A |
B равн. |
A B равн. |
|
||||||
|
|
|
pc |
p d |
|
cc c d |
(RT ) |
c+d −a−b |
||||||
K |
p |
= |
C D |
|
= |
C D |
|
|
||||||
|
pb |
|
|
|||||||||||
|
|
p a |
|
c a cb |
|
|
||||||||
|
|
|
|
A |
B |
равн. |
|
A B равн. |
|
|
||||
=K x pc+d −a−b ,
=Kc (RT )c+d −a−b ,
где p – общее давление газа.
Для неидеальных газов константа равновесия записывается аналогично (9.8), но вместо парциальных давлений паров используют летучести:
(9.12.а)
(9.12.б)
|
|
|
|
|
|
f |
c |
f d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
f |
= |
|
C |
D |
|
. |
|
|
|
|
|
|
|
|
|
(9.13) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
f |
a f b |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
A |
B равн. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химические потенциалы компонентов конденсированных растворов |
|
|
|
|
|
|
|||||||||||||||||
описываются выражениями (6.18) и (6.27). Если реакция (I) протекает в |
|
|
|
|
|
|
|||||||||||||||||
конденсированной фазе, то в случае идеальных растворов |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
cµ o ( p,T ) |
+ dµ o |
( p,T ) − aµ o |
( p,T ) − bµ o |
( p,T ) xc x d |
|
|
|
|
||||||||||||
K x = exp |
− |
C |
|
|
D |
|
|
|
A |
B |
|
|
= |
|
C |
|
D |
|
, |
||||
|
|
|
|
|
|
RT |
|
|
|
|
a |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
x |
b |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B равн. |
|
||||||||
|
|
|
|
|
Kx = Kx(p,T); |
|
|
|
|
|
|
|
|
|
|
(9.14.а) |
|||||||
в случае реальных растворов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
cµ o ( p,T ) |
+ dµ o |
( p,T ) − aµ o |
( p,T ) − bµ o |
( p,T ) ac a d |
|
|
|
|
||||||||||||
K a = exp |
− |
|
C |
|
|
D |
|
|
|
A |
B |
|
|
= |
|
C |
|
D |
|
, |
|||
|
|
|
|
|
|
|
RT |
|
|
|
|
a |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
a |
b |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B равн. |
|
||||||||
|
|
|
|
|
Ka = Ka(p,T). |
|
|
|
|
|
|
|
|
|
|
(9.14.б) |
|||||||
Записанные выше соотношения, связывающие парциальные давления, концентрации, мольные доли, летучести или активности участников реакции, носят название закона действующих масс.1
1 В главе 5 будет дана формулировка закона действующих масс для скорости реакции, предложенная Гульдбергом и Вааге.
148 |
Г л а в а 2. Приложения химической термодинамики |
Все константы равновесия – величины безразмерные. Введение размерности Kc в некоторых учебных пособиях связано с необходимостью указания концентрационной шкалы, выбранной за уровень отсчета свойств раствора (например, моль л–1 или моль м–3).
Выбор стандартного состояния компонентов раствора имеет свою специфику и при расчетах химических равновесий в биохимических системах. В физической химии за стандартное состояние компонентов обычно принимают состояние с единичной активностью. В биологии выбирают иные, биохимические стандартные состояния, которым со-
ответствуют:
•pH = 7 (активность ионов водорода 10−7, нейтральный раствор), активности остальных участников реакции в стандартном состоянии равны 1;
•pH = 7; активности всех участников реакции, кроме H2O, равны
0.01, у воды
a = 1; |
aO = |
pO |
2 |
= 0.2, |
aСO |
= |
pСO |
2 |
= 0.05. |
|
|
|
|
||||||
|
2 |
po |
|
|
2 |
po |
|
|
|
|
|
|
|
|
|
|
|||
Иногда стандартизуют и активности ионов кальция и магния, но широкого распространения такая система стандартов не получила.
Зависимость константы равновесия от температуры
(9.15)
(9.16.а)
(9.16.б)
150 |
Г л а в а 2. Приложения химической термодинамики |
|||||||||||
(9.19.а) |
ln Kc = − |
∆ U o |
|
|
A |
|
+ B1 , |
|||||
|
r |
+ const = |
1 |
|||||||||
|
|
|
RT |
|
|
|
T |
|
|
|
|
|
(9.19.б) |
ln |
Kc (T2 ) |
= |
∆ rU o |
1 |
− |
|
1 |
|
, |
||
Kc (T1 ) |
R |
|
|
|
|
|||||||
|
|
|
|
T1 |
|
T2 |
|
|||||
|
где Ai, Bi – некоторые параметры, определяемые при статистической |
|||||||||||
|
обработке экспериментальных данных. |
|
|
|
|
|
|
|||||
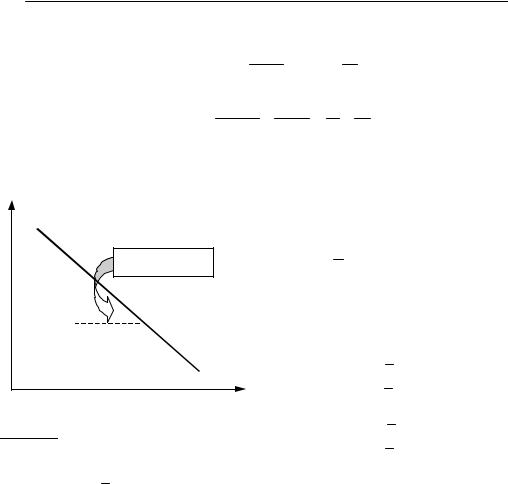
lnKp |
|
|
|
|
|
Из полученных уравнений видно, |
||||||
|
|
|
|
что если тепловой эффект реакции не |
||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
зависит от температуры, то график |
|||||||
|
tg α = –∆rHo/R |
|
|
|
ln K = f ( 1 ) |
представляет собой пря- |
||||||
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
мую линию (рис. 9.2), тангенс угла |
|||||||
|
|
|
|
|
наклона которой равен А (или А1), а |
|||||||
|
|
|
|
|
отрезок, отсекаемый прямой на оси |
|||||||
|
|
|
|
|
ординат, −B (или −B1). Следовательно |
|||||||
|
|
|
|
|
|
|
|
∆ r H o (T ) = −RA , |
||||
|
|
1/T |
|
|
|
|
|
∆ |
U o |
(T ) = −RA |
||
|
|
|
|
|
|
|
|
r |
|
|
1 |
|
Рис. 9.2 |
Зависимость логарифма |
|
|
|
|
|
∆ r S |
o |
(T ) = RB , |
|||
|
константы равновесия |
|
|
|
|
|
|
|||||
|
от температуры |
|
|
|
|
|
|
∆ r S o (T ) = RB1 , |
||||
где T – температура, соответствующая середине исследованного температурного интервала.
Этот метод вычисления термодинамических функций называют ме-
тодом расчета ∆H и ∆S по второму закону термодинамики.
Если в рассматриваемом температурном интервале нельзя пренебречь зависимостью стандартной энтальпии (или ∆ rU o ) реакции от тем-
пературы, то для установления вида зависимости Kp(T) можно воспользоваться уравнением Кирхгофа. Так, если аппроксимировать изменение теплоемкости в ходе реакции линейной зависимостью
|
|
∆ r C p = a + bT , |
|||
|
то можно показать, что |
|
|
|
|
(9.20) |
ln K p = − |
A |
+ |
B |
ln T + CT + const . |
RT |
|
||||
|
|
|
R |
||
В этом случае для нахождения значения константы равновесия при какой-либо температуре Т надо знать вид зависимости ∆rCp(T).


152 |
Г л а в а 2. Приложения химической термодинамики |
сравнения. Во втором случае за уровень отсчета свойств растворенного вещества выбран гипотетический раствор, обладающий свойствами предельно разбавленного. Очевидно, что стандартный химический потенциал этого компонента зависит от природы растворителя, поэтому константа равновесия одной и той же химической реакции может изменяться при переходе от одного растворителя к другому.
Расчеты равновесного состава
Химические реакции протекают при T = const, поэтому для расчета выхода продуктов необходимо знать энергии Гиббса (или энергии Гельмгольца при V = const) участников реакции при заданной температуре. Если эти величины известны, задача расчета равновесий сводится к решению уравнений или системы уравнений различной сложности. Современные вычислительные программы позволяют находить минимум энергии Гиббса системы при большом количестве переменных. Это дает возможность формулировать задачу расчета химических равновесий в самом общем виде, вплоть до того, что необязательно указывать, какие конкретно химические реакции протекают в системе, достаточно указать элементный состав системы и перечислить всевозможные составляющие вещества, образующиеся из этих элементов. Так как такая возможность появилась не очень давно, подобные методы расчета пока реализованы только в специализированных пакетах программ. В остальных случаях при решении задачи равновесного состава используют различные способы уменьшения размерности задачи (количества переменных). Одним из таких способов является расчет равновесного состава с помощью константы равновесия (см. Примеры).
ПРИМЕРЫ
Пример 9-1. Рассчитайте константу равновесия для реакции
CO(г) + 2H2(г) = CH3OH(г)
при 500 K. ∆fG° для CO(г) и CH3OH(г) при 500 К равны –155.41 кДж моль–1 и –134.20 кДж моль–1 соответственно.
Решение. ∆G° реакции:
∆rG° = ∆fG°(CH3OH) – ∆fG°(CO) = –134.20 – (–155.41) = 1.21 кДж моль–1.
|
|
21210 |
|
= 6.09 10 |
–3 |
. |
K p = exp |
− |
|
|
|
||
8.3145 500 |
|
|||||
|
|
|
|
|
|

154 |
Г л а в а 2. Приложения химической термодинамики |
||||||||||
|
Следовательно, |
xCH3OH |
|
|
α (4 − 2α )2 |
|
|||||
|
Kx = |
|
|
|
|||||||
|
|
|
|
= |
|
, |
|
||||
|
xCO xH2 |
2 |
(1 − α ) (2 − 2α )2 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Kp = Kx p–2 = |
|
|
α (4 − 2α )2 |
|
||||||
|
|
. |
|
||||||||
|
(1 − α ) (2 − 2α )2 p 2 |
|
|||||||||
|
Таким образом, |
|
|
|
|
α (4 − 2α )2 |
|
||||
|
6.09 10–3 = |
|
|
|
|
||||||
|
|
. |
|
||||||||
|
(1 − α ) (2 − 2α )2 (100)2 |
|
|||||||||
|
Решая это уравнение, получаем α = 0.732. Мольные доли веществ в |
||||||||||
|
равновесной смеси равны: |
|
|
|
|
|
|
|
|
||
|
xCH OH = 0.288, |
xCO = 0.106, xH |
= 0.212 и xN |
= 0.394. |
|||||||
|
3 |
|
|
|
|
|
2 |
|
|
|
2 |
Пример 9-4. Для реакции
N2(г) + 3H2(г) = 2NH3(г)
при 298 К Kp = 6.0 105, а ∆fH° (NH3) = –46.1 кДж моль–1. Оцените значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
∆rH° = 2∆fH°(NH3) = –92.2 кДж моль–1.
Согласно уравнению (9.18.б), |
|
|
|
|
|
|
|
|
|
ln K 2 = ln K1 + |
∆ |
r |
H o |
1 |
− |
1 |
|
= |
|
|
|
|
|
|
|
||||
|
|
|
T2 |
||||||
|
|
R |
T1 |
|
|
|
|||
5 |
|
−92200 Дж моль−1 |
|
1 |
|
1 |
|
|
|
= ln (6.0 10 |
) + |
|
|
|
− |
|
|
|
= –1.73, |
8.314 Дж К−1 моль−1 |
|
500 |
|
||||||
|
|
298 К |
|
К |
|
||||
откуда K2 = 0.18.
Отметим, что константа равновесия экзотермической реакции уменьшаетсясростомтемпературы, чтосогласуетсяспринципомЛеШателье.
ЗАДАЧИ
Указание: во всех задачах газы считать идеальными.
9-1. При 1273 К и общем давлении 30 атм в равновесной смеси
CO2(г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
Г л а в а 2. Приложения химической термодинамики |
155 |
9-2. При 2000 °C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитайте константу равновесия реакции
H2O(г) = H2(г) + 1/2O2(г)
при этих условиях.
9-3. Константа равновесия реакции
CO(г) + H2O(г) = CO2(г) + H2(г)
при 500 °C равна Kp = 5.5. Смесь, состоящую из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитайте мольную долю H2O в равновесной смеси.
9-4. Константа равновесия реакции
N2O4(г) = 2NO2(г)
при 25 °C равна Kp = 0.143. Рассчитайте давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N2O4 при этой температуре.
9-5. Сосуд объемом 3 л, содержащий 1.79 10–2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитайте константу равновесия при 973 K для реакции
I2(г) = 2I(г).
9-6. Для реакции
PCl5(г) = PCl3(г) + Cl2(г)
при 250 °C ∆rG° = –2508 Дж моль–1. При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250 °C составит 30%?
9-7. Для реакции
2HI(г) = H2(г) + I2(г)
константа равновесия Kp = 1.83 10–2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
9-8. Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250 °C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитайте константу равновесия при 250 °C для протекающей в сосуде реакции
PCl5(г) = PCl3(г) + Cl2(г).
156 |
Г л а в а 2. Приложения химической термодинамики |
9-9. Константа равновесия реакции
CO(г) + 2H2(г) = CH3OH(г)
при 500 K равна Kp = 6.09 10–3. Рассчитайте общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
9-10. При 25 °C ∆fG°(NH3) = –16.5 кДж моль–1. Рассчитайте ∆rG реакции образования NH3 при парциальных давлениях N2, H2 и NH3, равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
9-11. Система, в которой протекает экзотермическая реакция
CO(г) + 2H2(г) = CH3OH(г),
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы:
а) повышение T; б) повышение p;
в) добавление инертного газа при V = const; г) добавление инертного газа при p = const; д) добавление H2 при p = const?
9-12. Константа равновесия газофазной реакции изомеризации борнеола (C10H17OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитайте мольные доли и массы борнеола и изоборнеола в равновесной смеси.
9-13. Равновесие в реакции
2NOCl(г) = 2NO(г) + Cl2(г)
устанавливается при 227 °C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитайте ∆rG° этой реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
9-14. Рассчитайте общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2, чтобы получить равновесную смесь, содержащую 10% NH3 по объему при 400 °C. Константа равновесия для реакции
N2(г) + 3H2(г) = 2NH3(г)
при 400 °C равна K = 1.60 10–4.
9-15. При 250 °C и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции
PCl5(г) = PCl3(г) + Cl2(г).
