
Основы физической химии_Ерёмин
.pdf
Г л а в а 3. Электрохимия |
177 |
|
Подставляя (11.7) в (11.6), получаем: |
|
|
µ = (ν + µo+ + ν − µ o− ) + RT ln(a+ν + a−ν − ) = µ o + RT ln(a+ν + a−ν − ) |
(11.8.а) |
|
или |
|
|
µ = µ o + RT ln(γ ν++ γ ν−− m+ν + m−ν − ) . |
(11.8.б) |
|
Экспериментально определить активности катиона a+ и аниона a– |
|
|
невозможно, поэтому вводят понятие средней ионной активности a±: |
|
|
a± = (a+ν + a−ν − )1 ν , |
(11.9) |
|
где ν = ν+ + ν–.
Аналогично определяют средний ионный коэффициент активности γ±
|
|
|
|
γ ± = (γ ν++ γ ν−− )1 ν |
(11.10) |
и среднюю ионную моляльность m± |
|
||||
|
|
|
|
m± = (m+ν + m−ν − )1 ν = m(ν ν++ ν ν−− )1 ν , |
(11.11) |
где m = |
m+ |
= |
m− |
– моляльность раствора электролита. |
|
ν + |
|
|
|||
|
|
ν − |
|
||
Тогда a± = γ ± m± , и уравнение (11.8) для химического потенциала |
|
||||
электролита записывается в следующем виде: |
|
||||
|
|
|
µ = µ o + RT ln (γ ± m± )ν = µ o + RT ln (a± )ν , |
(11.12) |
|
и активность электролита равна
a = (a± )ν = (γ ± m± )ν = γ ν± mν (ν ν++ ν ν−− ).
Согласно эмпирическому правилу ионной силы, коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора:
I = 0.5∑mi zi2 , |
(11.14) |
i |
|
где zi – заряд иона (в единицах заряда протона), mi – его моляльная концентрация.
Это правило справедливо при концентрациях до 0.01 моль кг–1 и приближенно выполняется до 0.1 моль кг–1.
180 |
Г л а в а 3. Электрохимия |
метров и удовлетворительно описывает поведение многих электролитов до концентраций порядка 0.1 моль кг–1.
Для описания дальнейшего роста коэффициентов активности с увеличением концентрации раствора в уравнение (11.19) вводят слагаемое CI (C – эмпирический параметр) и получают уравнение третьего приближения теории Дебая–Хюккеля:
(11.20) |
lg γ ± = − |
z+ z− |
A |
I |
+ CI . |
||
|
|
|
|
||||
1 |
+ B |
I |
|||||
|
|
|
|||||
При соответствующем подборе параметров B и C это уравнение позволяет описать экспериментальные данные по коэффициентам активности до ионной силы порядка 1 моль кг–1.
Уравнение Харнеда и Оуэна содержит дополнительное слагаемое DI 2 (D – эмпирический параметр) и имеет вид
(11.21) |
lg γ ± = − |
|
|
z+ z− |
|
A |
I |
+ CI + DI 2 . |
|
|
|||||||
|
|
1 + B |
|
|||||
|
|
|
|
I |
||||
Оно удовлетворительно описывает экспериментальные данные по коэффициентам активности до ионной силы порядка нескольких моль кг–1.
ПРИМЕРЫ
Пример 11-1. Рассчитайте активность электролита a и среднюю ионную активность a± в 0.1 m растворе CaCl2 при 25 °C, если средний ионный коэффициент активности γ± = 0.518.
Решение.
a± = γ ± m± = γ ± (m+ν + m−ν − )1 ν = γ ± m (ν ν+ + ν ν− − )1
ν = γ ± m (ν ν+ + ν ν− − )1 ν ,
ν ,
где ν = ν+ + ν–
a± = 0.518 0.1 (11 22)1/3 = 8.223 10–2 a(CaCl2) = (a±)ν = 5.56 10–4
Ответ. a± = 8.223 10–2; a(CaCl2) = 5.56 10–4.
Пример 11-2. Рассчитайте моляльность раствора Na2SO4, имеющего ионную силу 0.24 моль кг–1.
Решение.
I = 0.5(m1 z12 + m2 z22 ),
где m1 и m2 – моляльности катиона и аниона соли, равные соответственно m1 = 2m, m2 = m, где m – моляльность раствора Na2SO4.

182 |
Г л а в а 3. Электрохимия |
11-2. Осмотическое давление крови составляет 0.811 МПа. Какова должна быть концентрация раствора NaCl, чтобы он был изотоничен с кровью? Примите степень диссоциации NaCl равной 0.950.
11-3. Водные растворы сахарозы и KNO3 изотоничны при концентрациях 1.00 и 0.60 моль л–1 соответственно. Найдите кажущуюся степень диссоциации KNO3 в растворе.
11-4. Выведите выражения для активностей NaCl, CaCl2, CuSO4 и LaCl3 через их моляльности m и средние ионные коэффициенты активности γ±.
11-5. Средний ионный коэффициент активности 0.1 M водного раствора HCl при 25 °C равен 0.796. Рассчитайте активность HCl в этом растворе.
11-6. Средний ионный коэффициент активности 0.1 M водного раствора H2SO4 при 25 °C равен 0.265. Рассчитайте активность H2SO4 в растворе.
11-7. Рассчитайте активность электролита a и среднюю ионную активность a± в 0.2 m растворе AlCl3 при 25 °C, если γ± = 0.305.
11-8. Рассчитайте ионную силу раствора, содержащего 0.10 моль кг–1
KCl и 0.20 моль кг–1 CuSO4.
11-9. Рассчитайте ионную силу раствора, содержащего 0.040 моль кг–1
K3[Fe(CN)6], 0.030 моль кг–1 KCl и 0.050 моль кг–1 NaBr.
11-10. Рассчитайте моляльность раствора Al(NO3)3, имеющего ионную силу 0.30 моль кг–1.
11-11. Раствор NaNO3 имеет ионную силу 0.30 моль·кг–1. Чему равна моляльность раствора Al2(SO4)3, имеющего такую же ионную силу?
11-12. Чему равна моляльность раствора Na3PO4, имеющего такую же ионную силу, как 0.36 моль кг–1 раствор KCl?
11-13. Рассчитайте массу Ca(NO3)2, которую нужно добавить к 0.150 моль кг–1 раствору K NO3, содержащему 500 г воды, чтобы увеличить его ионную силу до 0.250 моль кг–1.
11-14. Используя первое приближение теории Дебая–Хюккеля, рассчитайте коэффициенты активности ионов K+, Al3+ и SO42– в 1.0 10–3 моль л–1 растворе KAl(SO4)2 при 25 °C.
11-15. Используя первое приближение теории Дебая–Хюккеля, рассчитайте коэффициенты активности ионов Ca2+, Cl– и средний ионный коэффициент активности в 0.002 моль л–1 растворе CaCl2 при 25 °C.
11-16. Используя первое приближение теории Дебая–Хюккеля, рассчитайте коэффициенты активности ионов Ca2+, SO42– и средний ионный коэффициент активности в 0.001 моль л–1 растворе CaSO4 при 25 °C.
Г л а в а 3. Электрохимия |
183 |
11-17. Константа диссоциации уксусной кислоты при 25 °C равна 1.75 10–5 моль л–1. Используя первое приближение теории Дебая– Хюккеля, рассчитайте степень диссоциации кислоты, если ее моляльность равна 0.100 моль кг–1.
11-18. Средний ионный коэффициент активности в 0.500 моль кг–1 водном растворе LaCl3 при 25 °C равен 0.303. Какова ошибка в определении этой величины по первому приближению теории Дебая–Хюккеля?
11-19. Растворимость Ag2CrO4 в воде при 25 °C равна 8.00 10–5 моль л–1, а в 0.04 моль л–1 растворе NaNO3 8.84 10–5 моль л–1. Рассчитайте средний ионный коэффициент активности Ag2CrO4 в 0.04 моль л–1 растворе
NaNO3.
11-20. Растворимость AgCl в воде при 25 °C равна 1.33 10–5 моль л–1. Рассчитайте растворимость AgCl в 0.1 моль кг–1 водном растворе KCl, в котором γ± = 0.770.
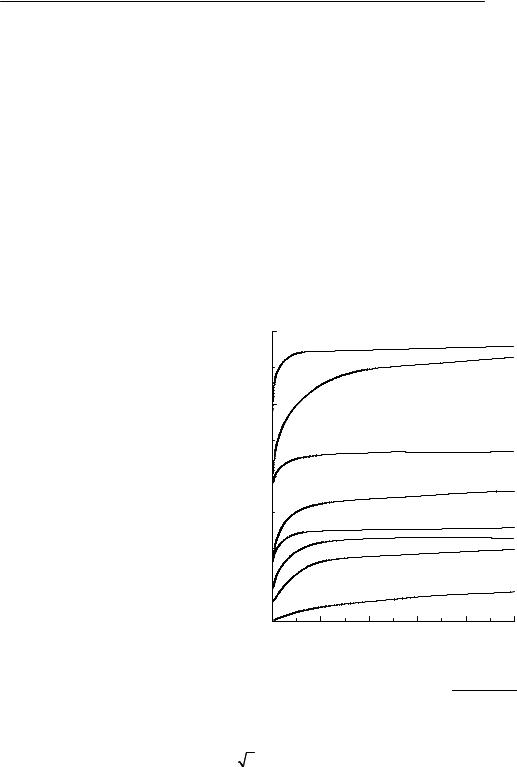
§ 12. Электропроводность растворов электролитов
Способность растворов электролитов проводить электрический ток обусловлена ионами, образующимися при диссоциации электролитов. Экспериментальное изучение электропроводности растворов (кондуктометрия) является одним из важных направлений физико-химиче- ского анализа и позволяет получать информацию о различных свойствах растворов – определять степени и константы диссоциации электролитов, растворимость труднорастворимых солей и т.п. Применяют также кондуктометрическое титрование, в котором точки эквивалент-
ности определяют по изменению электропроводности раствора. Электропроводность Κ раствора – величина, обратная его сопро-
тивлению R:
Κ = |
1 |
= |
1 |
|
S |
= κ |
S |
, |
(12.1) |
|
R |
ρ |
l |
l |
|||||||
|
|
|
|
|
|
где ρ – удельное сопротивление; S – площадь электродов; l – расстояние между электродами; κ – удельная электропроводность (величина, обратная удельному сопротивлению).
В системе СИ электропроводность имеет размерность сименс
(См = Ом–1).
Удельной электропроводностью κ («каппа») раствора называется электропроводность объема раствора, находящегося между параллельными электродами площадью 1 м2 каждый, расположенными на расстоянии
1 м друг от друга. В системе СИ удельная электропроводность измеряется вОм–1 м–1 илиСмм–1. ИспользуюттакжеединицыОм–1 см–1 илиСмсм–1.

|
|
|
|
|
|
Г л а в а 3. Электрохимия |
|
|
|
|
185 |
||
Используют также понятие эквивалентной электропроводности λ, |
|
|
|||||||||||
которая получается, если в формуле (12.4) вместо молярной использо- |
|
|
|||||||||||
вать эквивалентную концентрацию (нормальность). Эквивалентную |
|
|
|||||||||||
электропроводность обычно измеряют в Ом–1см2г-экв–1; используют |
|
|
|||||||||||
также единицы См м2г-экв–1 и См см2г-экв–1. Молярная электропро- |
|
|
|||||||||||
водность равна произведению эквивалентной электропроводности на |
|
|
|||||||||||
число эквивалентов в одном моле вещества. |
|
|
|
|
|
||||||||
Эквивалентной электропроводностью называется электропровод- |
|
|
|||||||||||
ность объема раствора, содержащего 1 г-экв растворенного электролита |
|
|
|||||||||||
и находящегося между параллельными электродами, расположенными |
|
|
|||||||||||
на расстоянии 1 м друг от друга. Таким образом, между электродами |
|
|
|||||||||||
при любой концентрации раствора находится 1 г-экв растворенного |
|
|
|||||||||||
электролита, поэтому изменение эквивалентной электропроводности |
|
|
|||||||||||
при изменении концентрации раствора обусловлено изменением степе- |
|
|
|||||||||||
ни диссоциации (для слабых |
|
|
|
|
|
|
|
||||||
электролитов) |
или межионными |
|
400 |
|
|
|
|
|
|||||
взаимодействиями (для сильных |
|
|
HCl |
|
|
|
|||||||
|
|
|
|
|
|
||||||||
электролитов). |
|
|
|
|
|
|
|
|
|
|
|
||
Эквивалентная |
|
электропро- |
|
|
|
H2SO4 |
|
|
|
||||
водность λ растворов электроли- |
|
|
|
|
|
|
|||||||
|
300 |
|
|
|
|
|
|||||||
тов возрастает с ростом разбав- |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||
ления раствора и при бесконеч- |
|
|
|
KOH |
|
|
|
||||||
ном |
разбавлении |
(то |
есть при |
–1 |
|
|
|
|
|
||||
бесконечно |
малой |
концентра- |
-экв |
|
|
|
|
|
|
||||
2 г |
200 |
|
|
|
|
|
|||||||
ции) асимптотически приближа- |
|
|
|
|
|
||||||||
Смсм |
|
(COOH)2 |
|
|
|
||||||||
|
|
|
|
|
|||||||||
ется к предельному значению λ0, |
|
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||
которое называется |
предельной |
λ, |
|
|
CaCl2 |
|
|
|
|||||
|
|
|
|
|
|
||||||||
эквивалентной |
электропровод- |
|
100 |
|
KCl |
|
|
|
|||||
ностью раствора при бесконеч- |
|
|
|
|
|
||||||||
|
|
CuSO4 |
|
|
|
||||||||
ном разведении, соответствую- |
|
|
|
|
|
|
|||||||
щем |
отсутствию |
|
межионного |
|
|
|
CH3COOH |
|
|
|
|||
взаимодействия. |
Для |
слабых |
|
0 |
|
|
|
|
|
||||
электролитов |
|
предельного зна- |
|
200 |
400 |
600 |
800 |
1000 |
|||||
чения λ0 экспериментально дос- |
|
0 |
|||||||||||
|
|
|
V, л г-экв–1 |
|
|
||||||||
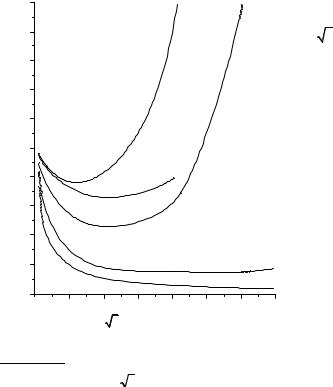
тичь не удается (рис. 12.2). |
|
|
|
|
|
||||||||
|
Зависимость эквивалентной |
|
|
|
|||||||||
В |
разбавленных |
растворах |
|
|
Рис. 12.2 |
||||||||
электропроводности от разбавления |
|||||||||||||
сильных электролитов выполня- |
|
для некоторых электролитов |
|
|
|||||||||
ется эмпирический закон Коль- |
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||
рауша (закон квадратного корня): |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
λ = λ 0 |
− A |
c , |
|
|
|
(12.5) |
|
где λ и λ0 – эквивалентная электропроводность раствора при концен- |
|
|
|||||||||||
трации c и при бесконечном разведении, A – константа (при данной |
|
|
|||||||||||
температуре) для данного электролита и растворителя. |
|
|
|
|
|||||||||

