
- •Загальна хімічна технологія
- •Охорона праці та техніка безпеки в хімічних лабораторіях
- •Основні вимоги техніки безпеки під час виконання лабораторних робіт
- •Отримання гідроксиду натрію
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис лабораторної установки
- •Аналіз технічної соди на вміст Na2co3 таNaHco3
- •Приготування робочого розчину соди
- •Розрахунок кількості вапна
- •Каустифікація содового розчину
- •Аналіз лужного розчину на вміст NaОНтаNa2co3
- •Матеріальний баланс процесу каустифікації за натрієм
- •Розрахунок ступеня каустифікації та використання натрію
- •Експериментальна частина
- •Опис лабораторної установки і порядок виконання роботи
- •Методика хімічного аналізу
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Пом’якшення води
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Визначення загальної твердості заданої проби води
- •Визначення карбонатної твердості води
- •Пом’якшення води іонообмінним способом
- •Пом’якшення води реагентним способом
- •Визначення залишкової твердості
- •Обробка і представлення результатів
- •Експериментальна частина
- •Опис схеми установки
- •Аналіз проби технічного хлориду натрію (метод Мора)
- •Аналіз аміачної води (водного розчину аміаку)
- •Приготування амонізованого розсолу заданої концентрації
- •Визначення NаClв амонізованому розсолі
- •Карбонізація амонізованого розсолу
- •Фільтрування суспензії гідрокарбонату натрію
- •Визначення вмісту NaHco3в отриманому осаді
- •Результати хімічного аналізу
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Каталітичне окиснення оксиду сульфуру (IV)
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис експериментальної установки
- •Порядок виконання роботи
- •Визначення концентрації so2 у вихідній газовій суміші
- •Визначення концентрації so2 у газовій суміші після реактору
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Каталітичне окиснення аміаку
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис схеми установки
- •Порядок виконання роботи
- •Методика аналізу газових сумішей
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Коксування кам’яного вугілля
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис схеми установки
- •Порядок виконання роботи
- •Методика аналізу
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Одержання вапна
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис схеми установки
- •Випалювання вапняку (крейди), визначення об’єму со2 та його вмісту
- •Визначення активного СаО у вапні
- •Визначення температури та часу гасіння вапна
- •Техніка безпеки
- •8.4 Контрольні запитання
- •3 3
Визначення NаClв амонізованому розсолі
5 см3амонізованого розсолу (Vрозс) під витяжкою переносять в мірну колбу місткістю 250 см3(Vкол) і розбавляють дистильованою водою до половини об’єму. Потім доводять до мітки (поза витяжкою).
Відбирають піпеткою 5 см3приготованого розчину (Vал) в конічну колбу об’ємом до 100 см3. На титрувальному стенді підкислюють пробу нітратною (азотною) кислотою (5 см3, концентрація 2 моль/дм32 М), додають індикатор2÷3 см3залізо-амонійного галуну [FeSO4·(NH4)2SO4]. Ретельно перемішуючи додають точно (із бюретки) 10 см3розчинуAgNO3(VAgNO3) концентрацією 0,05 M, після чого титрують розчином роданіду амоніюNH4CNSконцентрацією 0,05 M до появи червоно-бурого забарвлення (VNH4CNS).
Маса NаCl у приготованому розсолі (V = 100 см3), г:
 (4.13)
(4.13)
Карбонізація амонізованого розсолу
Після відстоювання із колби з розсолом(Увага! Не використовувати розчини, що готуються для аналізу згідно 4.2.2 і 4.2.3!) під витяжною шафою відміряють циліндром 80 см3рідини (Vrid) і заливають у карбонізаційну колонку. Відкривають вентиль балону і через барботер рівномірно пропускають оксид вуглецю (IV). Карбонізацію продовжують до випадання осаду гідрокарбонату натрію у всьому об’ємі розчину.
Фільтрування суспензії гідрокарбонату натрію
Осад гідрокарбонату натрію відділяють від фільтрату на лійці Бюхнера. Колонку промивають фільтровою рідиною і промивають нею осад на фільтрі. Вологий осад гідрокарбонату натрію віджимають фільтрувальним папером, зважують на технічних терезах – G, г.
Визначення вмісту NaHco3в отриманому осаді
На
технічних терезах зважують 2 ÷ 3 г вологого
осаду NaHCO3(![]() ),
переносять до конічної колби для
титрування (V = 250 см3), додають 80 ÷
100 см3дистильованої води та 1÷2
краплі індикатора метилоранжу і титрують
1 М (1 моль/дм3) розчиномHClпри
інтенсивному перемішуванні до переходу
забарвлення розчину з жовтого до
рожевого.
),
переносять до конічної колби для
титрування (V = 250 см3), додають 80 ÷
100 см3дистильованої води та 1÷2
краплі індикатора метилоранжу і титрують
1 М (1 моль/дм3) розчиномHClпри
інтенсивному перемішуванні до переходу
забарвлення розчину з жовтого до
рожевого.
Вміст NaHCO3в отриманому осаді розраховують за формулою, %мас.:
 (4.14)
(4.14)
де
![]() -
об’єм розчинуНClз молярною
концентрацієюСHCl= 1
моль/дм3, що витрачено на титрування
наважки осаду, cм3;
-
об’єм розчинуНClз молярною
концентрацієюСHCl= 1
моль/дм3, що витрачено на титрування
наважки осаду, cм3;![]() -
молярна маса еквівалентаNaHCO3,
що дорівнює 84 г/моль;
-
молярна маса еквівалентаNaHCO3,
що дорівнює 84 г/моль;![]() - маса осаду, який взято для титрування,
г.
- маса осаду, який взято для титрування,
г.
Наприклад,
на титрування 2,2 г (![]() )
осаду гідрокарбонату натрію знадобилося
17,7 см3розчину хлоридної кислоти
з молярною концентрацією еквіваленту
1 моль/дм3, тоді:
)
осаду гідрокарбонату натрію знадобилося
17,7 см3розчину хлоридної кислоти
з молярною концентрацією еквіваленту
1 моль/дм3, тоді:
![]()
загальна кількість NaHCO3у осаді становитиме, г:
![]() .
.
Результати хімічного аналізу
В процесі виконання роботи заповнити наступну таблицю.
Таблиця 4.1– Результати титрування
|
№ |
пункт |
Реагент |
V реагенту, см3 |
Показник, що визначається |
Значення та розмірність | ||
|
1 |
2 |
Середнє | |||||
|
1 |
4.2.2 |
|
|
|
|
|
|
|
2 |
4.2.4 |
|
|
|
|
|
|
|
3 |
4.2.7 |
|
|
|
|
|
|
Обробка і представлення результатів
За рівнянням (4.12) обчислити ступінь перетворення за натрієм, %:
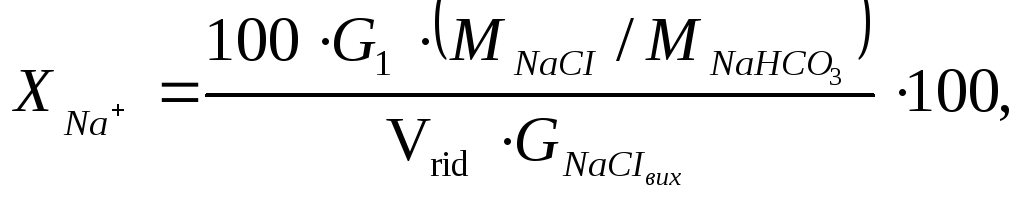 (4.15)
(4.15)
де
![]() загальна масаNaHCO3в
отриманому осаді, г (п. 4.2.8);
загальна масаNaHCO3в
отриманому осаді, г (п. 4.2.8);![]() молярні масиNaCl(58,5 г/моль) iNaHCO3(84 г/моль);
молярні масиNaCl(58,5 г/моль) iNaHCO3(84 г/моль);![]() розрахована наважка хлориду натрію,
необхідна для приготування 100 см3
амонізованого розсолу, г (п. 4.2.4, А),Vrid= 80 – об’єм розсолу, що
відібрано на карбонізацію, см3(п. 4.2.6) – за вказівкою викладача.
розрахована наважка хлориду натрію,
необхідна для приготування 100 см3
амонізованого розсолу, г (п. 4.2.4, А),Vrid= 80 – об’єм розсолу, що
відібрано на карбонізацію, см3(п. 4.2.6) – за вказівкою викладача.
Ступінь перетворення аміаку розрахувати за рівнянням (4.6):
 % (4.13)
% (4.13)
де
![]() молярні масиNH3(17 г/моль)
іNaHCO3(84 г/моль),
молярні масиNH3(17 г/моль)
іNaHCO3(84 г/моль),![]() розрахована кількість 100%-гоNH3,
потрібного для приготування 100 см3амонізованого розсолу (п. 4.2.4, Б).
розрахована кількість 100%-гоNH3,
потрібного для приготування 100 см3амонізованого розсолу (п. 4.2.4, Б).
Зробити висновок щодо глибини використання вихідних компонентів.
