
- •Загальна хімічна технологія
- •Охорона праці та техніка безпеки в хімічних лабораторіях
- •Основні вимоги техніки безпеки під час виконання лабораторних робіт
- •Отримання гідроксиду натрію
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис лабораторної установки
- •Аналіз технічної соди на вміст Na2co3 таNaHco3
- •Приготування робочого розчину соди
- •Розрахунок кількості вапна
- •Каустифікація содового розчину
- •Аналіз лужного розчину на вміст NaОНтаNa2co3
- •Матеріальний баланс процесу каустифікації за натрієм
- •Розрахунок ступеня каустифікації та використання натрію
- •Експериментальна частина
- •Опис лабораторної установки і порядок виконання роботи
- •Методика хімічного аналізу
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Пом’якшення води
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Визначення загальної твердості заданої проби води
- •Визначення карбонатної твердості води
- •Пом’якшення води іонообмінним способом
- •Пом’якшення води реагентним способом
- •Визначення залишкової твердості
- •Обробка і представлення результатів
- •Експериментальна частина
- •Опис схеми установки
- •Аналіз проби технічного хлориду натрію (метод Мора)
- •Аналіз аміачної води (водного розчину аміаку)
- •Приготування амонізованого розсолу заданої концентрації
- •Визначення NаClв амонізованому розсолі
- •Карбонізація амонізованого розсолу
- •Фільтрування суспензії гідрокарбонату натрію
- •Визначення вмісту NaHco3в отриманому осаді
- •Результати хімічного аналізу
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Каталітичне окиснення оксиду сульфуру (IV)
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис експериментальної установки
- •Порядок виконання роботи
- •Визначення концентрації so2 у вихідній газовій суміші
- •Визначення концентрації so2 у газовій суміші після реактору
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Каталітичне окиснення аміаку
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис схеми установки
- •Порядок виконання роботи
- •Методика аналізу газових сумішей
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Коксування кам’яного вугілля
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис схеми установки
- •Порядок виконання роботи
- •Методика аналізу
- •Обробка і представлення результатів
- •Техніка безпеки
- •Контрольні запитання
- •Одержання вапна
- •Стислі теоретичні відомості
- •Експериментальна частина
- •Опис схеми установки
- •Випалювання вапняку (крейди), визначення об’єму со2 та його вмісту
- •Визначення активного СаО у вапні
- •Визначення температури та часу гасіння вапна
- •Техніка безпеки
- •8.4 Контрольні запитання
- •3 3
Експериментальна частина
Опис схеми установки
Процес карбонізації амонізованого розсолу відбувається на установці (рисунок 4.1), що включає карбонізаційну колонку (поз.4), яка працює у барботажному режимі, котрий забезпечується рівномірною подачею оксиду вуглецю (IV) із балона (поз. 1) через барботер (поз. 5). Витрату газу регулюють вентилем (поз. 2) на редукторі (поз. 3).
Бризки розсолу, що відносяться потоком газу, ловлять уловлювачем (поз. 6), не поглинений розчином газ викидається до витяжної шафи.
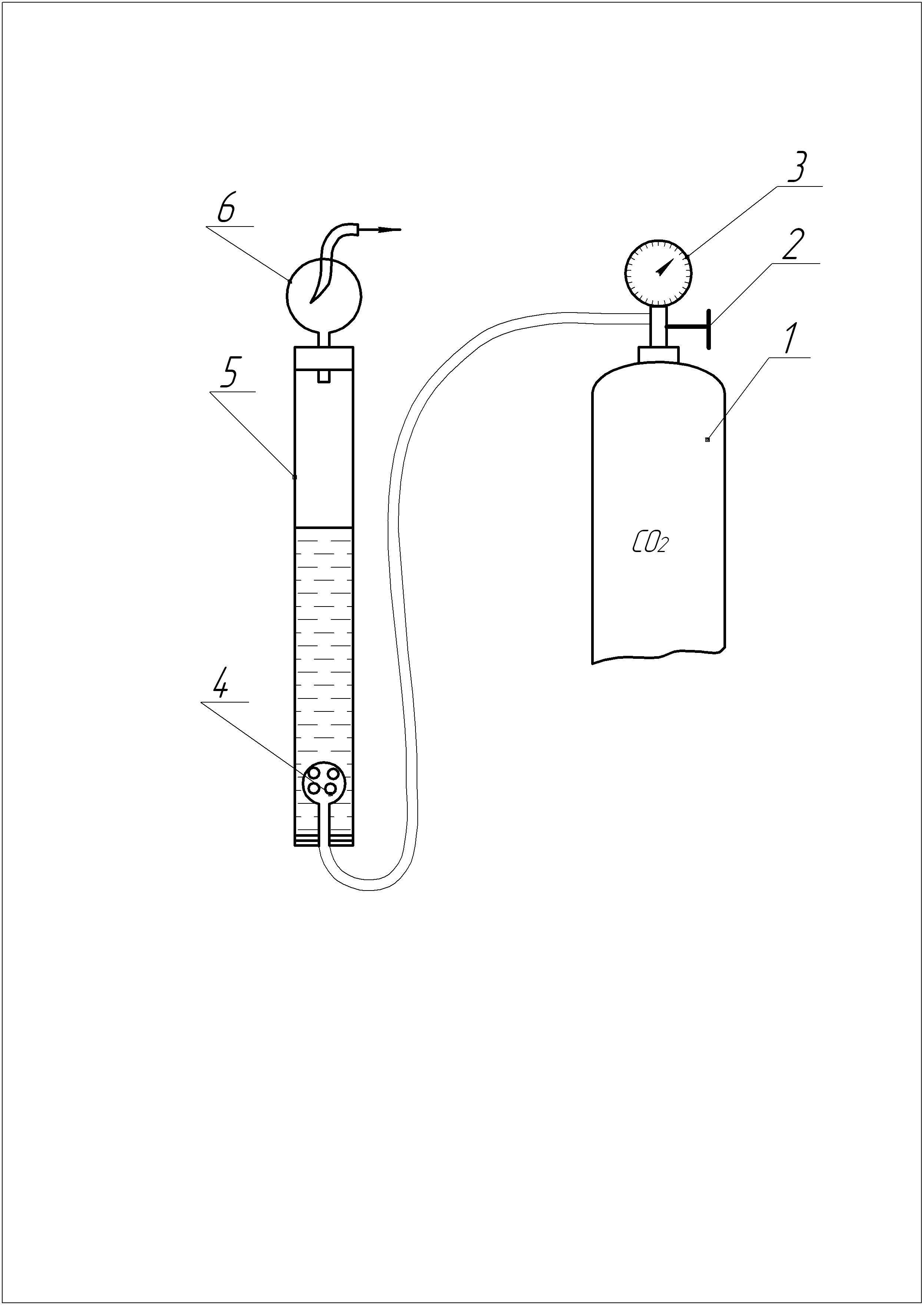
1 балон; 2вентиль; 3редуктор; 4карбонізаційна колонка;
5 барботер; 6 – уловлювач
Рисунок 4.1 Схема лабораторної установки.
Аналіз проби технічного хлориду натрію (метод Мора)
Розрахувати наважку проби NaClдля приготування 250 см3розчину з молярною концентрацією С(NaCl) = 0,05 моль/дм3:
![]() г,
г,
де 250 – об’єм колби, см3; 0,05 – концентраціяNaCl, моль/дм3; 58,5 – молярна масаNaClг/моль.
Зважену на аналітичних терезах наважку проби солі перенести в мірну колбу на 250 см3, ретельно перемішати, довести до позначки дистильованою водою, відібрати піпеткою аліквоту 5 см3і титрувати за методом Мора розчином нітрату срібла з молярною концентрацією еквівалента С(AgNO3) = 0,05 моль/дм3в присутності індикатора (розчинуK2CrO4) до появи оранжевого забарвлення. Титрування протікає за схемою:
![]() ; (4.9)
; (4.9)
![]() . (4.10)
. (4.10)
Вміст NaClв пробі визначають за формулою:
![]() , (4.11)
, (4.11)
де
![]() – об’єм нітрату срібла, що пішов на
титрування, см3;
– об’єм нітрату срібла, що пішов на
титрування, см3;![]() – молярна концентрація еквівалента
нітрату срібла, моль/дм3; 58,5 –
молярна масаNaCl,
г/моль; 250 – об’єм колби, см3; 5 –
об’єм аліквоти, см3;
– молярна концентрація еквівалента
нітрату срібла, моль/дм3; 58,5 –
молярна масаNaCl,
г/моль; 250 – об’єм колби, см3; 5 –
об’єм аліквоти, см3;![]() – маса наважки технічного хлориду
натрію (увага!в даному розрахунку
треба використовувати масу реальної
наважки, а не розрахованої вище).
– маса наважки технічного хлориду
натрію (увага!в даному розрахунку
треба використовувати масу реальної
наважки, а не розрахованої вище).
Аналіз аміачної води (водного розчину аміаку)
Отримати у викладача завдання, де вказується номер проби технічного NaClі аміачної води.
Для аналізу аміачної води треба відібрати із вказаної проби 10 см3(піпеткою) аміачної водиVp. Пробу відбирати обов’язково у витяжній шафі і за допомогою пробовідбірника. В мірну колбу місткістю 250 см3(Vк) перенести 100 см3дистильованої води, 10 см3 досліджуваної проби аміачної води, довести вміст колби дистильованою водою до мітки, закрити пробкою, перемішати. Вміст аміаку визначають прямим титруванням розчином хлоридної (соляної) кислоти. Піпеткою відбирають 25 см3приготованого розчину (аліквотаVa), переносять до конічної колби (V = 250 см3), додають 2÷3 краплі індикатора метилоранжу і титрують 1 М (моль/дм3) розчином хлоридної кислоти при безперервному перемішуванні до переходу забарвлення розчину із жовтого до рожевого. Вміст аміаку (CNH3) визначають із виразу, г/дм3:
![]() (4.12)
(4.12)
де VHCl об’єм хлоридної кислоти, що знадобився на титрування (замірювання за бюреткою), см3;СHCl- концентраціяHCl - 1 М (1 моль/дм3);Vк– об’єм мірної колби, см3;Емолярна маса еквіваленту аміаку, г/моль,Е=17;Va– об’єм аліквоти, см3;Vpоб’єм проби (нерозбавленого розчину аміачної води), см3.
Приклад розрахунку. На титрування визначеної проби аміаку пішло 12,5 см3(VHCl) 1 М соляної кислоти, тоді:
![]() г/дм3.
г/дм3.
Приготування амонізованого розсолу заданої концентрації
Завдання.Приготувати 100 см3(V) амонізованого розсолу з вмістомNaClу розчині CNaCl= 230 ÷ 260 г/дм3(за завданням викладача). ПробаNaCl№ 1: вмістNaClу даній технічній пробі солі становить 95% мас. СпіввідношенняNH3 :NaCl= (1,1 - 1,2):1.
А) Приклад розрахунку кількості технічної солі NaCl.
Для
приготування V = 100 см3розсолу з
концентрацією CNaCl240 г/дм3і з вмістомNaCl(![]() )
у пробі солі 95% мас. (0,95 мас. частки)
необхідно:
)
у пробі солі 95% мас. (0,95 мас. частки)
необхідно:
![]() г.
г.
Б) Приклад розрахунку кількості аміачної води.
Приготування розсолу із співвідношенням NH3:NaCl= 1,2 : 1.
У 100 см3розcолу міститься 100%-гоNH3:
![]() =
=![]() г;
г;
з урахуванням відомої концентрації аміаку в аміачній воді, об’єм аміачної води становитиме:
 см3,
см3,
де 17 і 58,5 - молярні маси еквівалентів NH3іNaCl, відповідно; 1,2 - надлишокNH3від стехіометрії реакції (4.1).
В) Порядок приготування розсолу.
На технічних терезах зважують розраховану кількість проби технічної солі NaCl. У мірну колбу місткістю 100 см3через суху лійкупереносять невеликими порціями зважену сіль, слідкуючи за тим, щоб не забився носик лійки. Під витяжкою відміряють циліндром розраховану кількість вихідної проби аміачної води і повільно доливають у колбу, де знаходитьсяNaCl(працювати у витяжній шафі!). Потім вміст колби доводять дистильованою водою до мітки. Колбу закривають пробкою і ретельно і обережно перемішують. Розсолу дають відстоятися на протязі 5÷10 хв.
