
u_sem
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Федеральное государственное образовательное учреждение высшего профессионального образования
«Сибирский федеральный университет»
Авторы:
Т.И. Когай, А.В. Голоунин, Л.В. Фоменко
МЕХАНИЗМЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
ОРГАНИЧЕСКАЯ ХИМИЯ
Учебное пособие по циклу семинарских занятий
Красноярск
2008
МЕХАНИЗМЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
МЕХАНИЗМЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
УЧЕБНОЕ ПОСОБИЕ ПО ЦИКЛУ СЕМИНАРСКИХ ЗАНЯТИЙ
по дисциплине: ОПД. Ф. 03 – органическая химия, по направлению «020100.62 – химия»
пособие составлено в соответствии с Федеральным государственным образовательным стандартом высшего профессионального образования
Составители: профессор А.В. Голоунин доцент Т.И. Когай доцент Л.В. Фоменко
Красноярск
2008
3
ПРЕДИСЛОВИЕ АВТОРОВ
Несмотря на то, что в XXI-м веке, как и в предыдущем столетии, органическая химия остаётся наукой экспериментальной, постепенно усиливается её «теоретизация». Современный подход к огромному количеству мало связанных между собой фактов состоит в изучении механизмов органических реакций.
Успехи, достигнутые в области изучения механизмов органических реакций, действительно очень велики. Они обусловлены в основном использованием электронных теорий, которые не только дали возможность систематизировать и объяснить большое количество уже известных фактов, но позволили также предсказать условия проведения новых важных реакций.
Изучение механизмов реакций освобождает студентов от необходимости заучивания большого числа не связанных, на первый взгляд, между собой фактов. Новый подход к осмыслению материала органической химии, основанный на изучении механизмов реакций, положен в основу ряда современных учебников по органической химии.
Наличие этих учебников, в которых наряду с теоретическими представлениями, большой объём занимает фактический материал, что тоже очень важно, не исключает потребности со стороны студентов в небольшом пособии, которое помогло бы сразу войти в курс теоретических представлений.
Главная цель данного пособия состоит в том, чтобы научить студентов понимать пути химических превращений органических соединений, поскольку наиболее важная задача при обучении любой науке состоит в том, чтобы научить человека ориентироваться в новой для него ситуации.
Исходя из существования трёх основных типов реагентов − электрофилов, нуклеофилов и радикалов, в пособии излагаются механизмы реакций с их участием − замещения, присоединения, отщепления.
Пособие «Механизмы органических реакций» предназначено для студентов 3-его курса по дисциплине ОПД. Ф. 03органическая химия по направлению «020100.62 – химия».
3
ВВЕДЕНИЕ
Современный подход к огромному числу на первый взгляд мало связанных между собой фактов, из которых состоит предмет органической химии, основан на изучении механизмов реакций. Преимущество этого подхода заключается в том, что, опираясь на сравнительно небольшое число основополагающих принципов, удаётся объяснить и связать между собой разрозненные факты. Более того, удаётся предсказать результаты ещё не изученных реакций, проследить связь между строением органических соединений участвующих в этих реакциях и их реакционной способностью.
1. СТРУКТУРА И РЕАКЦИОННАЯ СПОСОБНОСТЬ
1.1. Связи в органических соединениях
При химических реакциях разрушаются и образуются связи, поэтому рассмотрение химических свойств молекулы всегда следует начинать с рассмотрения свойств её химических связей. Наиболее важным видом связи в органических соединениях является ковалентная связь.
В 1916 г. электронную теорию ковалентной связи предложил Дж. Н. Льюис (Калифорнийский университет). Согласно этой теории ковалентная связь образуется в результате обобществления двух электронов. Льюис основывал свои представления на следующей концепции атома: положительно заряженное ядро атома окружено электронами, находящимися на концентрических орбитах или энергетических уровнях. На каждом энергетическом уровне может находиться определённое число электронов: два на первом, восемь на втором, восемь или восемнадцать на третьем и т. д. Наиболее стабильны соединения, в которых внешняя оболочка заполнена, как в инертных газах. Согласно теории Льюиса в молекуле водорода каждый атом водорода приобретает устойчивую оболочку атома гелия: Н• + •Н → Н−Н.
Атом углерода в молекуле тетрафторметана, обобществляя четыре своих валентных электрона с валентными электронами четырёх атомов фтора, заполняет свою внешнюю электронную оболочку до октета.
Связь, образованная двумя обобществлёнными электронами, представляет собой наиболее важный тип связи; он определяет строение молекулы и является обычной связью в классической структурной химии.
|
|
|
|
|
|
F |
4 F |
|
|
|
C |
|
F C F |
|
|
|
|
|||
|
|
|
|
|
|
F |
Современные представления о ковалентной связи основаны на квантовомеханической теории, изложенной в 1926 г. Э. Шредингером. Он вывел математические выражения для описания движения электрона в зависимости от его энергии. Эти математические выражения называются волновыми уравне-

4
ниями, так как в их основе лежит представление о том, что электрон проявляет волновые свойства.
Для одноэлектронной системы уравнение Шредингера имеет вид:
(h2/8π2m)  2 ψ + En ψ = E ψ,
2 ψ + En ψ = E ψ,
где 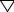 2 сумма вторых производных по координатам x, y, z; ψ – волновая функция электрона; h – постоянная Планка; Е – полная энергия системы; En –
2 сумма вторых производных по координатам x, y, z; ψ – волновая функция электрона; h – постоянная Планка; Е – полная энергия системы; En –
потенциальная энергия системы. В физическом смысле функция ψ – это амплитуда стоячей волны. Квадрат волновой функции – (ψ2) –это вероятность нахождения электрона в данной точке трёхмерного пространства. Трёхмерное изображение электронной плотности носит название орбиталей.
Некоторые следствия из основных положений квантовой механики кратко могут быть сформулированы таким образом:
а) энергия электрона определяется главным квантовым числом n, где
(n = 1,2,3…),
б) форма и ориентация орбиталей в пространстве определяются орбитальным квантовым числом- l (l = n –1 = 0, 1,2,3 …);
в) положение орбиталей относительно друг друга и относительно ядра определяет магнитное квантовое число m (m = -2, -1, 0, + 1, +2);
г) s- орбиталь (n = 1, l = 0) имеет сферическую симметрию относительно ядра атома;
д) 2p-орбитали (n = 2, l = 1) имеют форму гантели и располагаются взаимно перпендикулярно вдоль осей x, y, z.
Атом углерода (n = 2) имеет на внешнем слое четыре электрона, которые располагаются на орбиталях таким образом: 2s22p12p12p0. В возбуждённом состоянии (энергия возбуждения около 300 кДж/моль) электронная конфигурация такая: 2s12p12p12p1. В возбуждённом состоянии атом углерода четырёхвалентен, но связи, образующиеся таким углеродом, не идентичны. Три 2p-орбитали и одна 2s – орбиталь не могут образовать четыре эквивалентные связи. Однако в результате гибридизации орбиталей (энергия гибридизации около 100 кДж/моль) образуются 4 эквивалентные орбитали
+ (~Ю0 кДж-моль"1)
5
Рис. 1.1 Орбитали атома углерода в возбуждённом состоянии (а); атом углерода в sp3 – гибридном состоянии - (б).
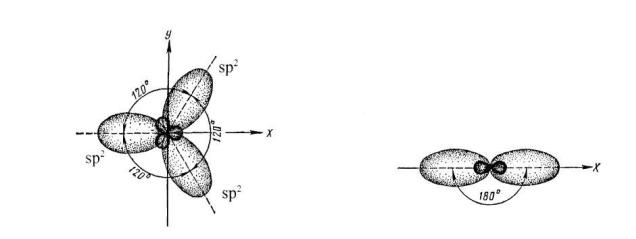
В зависимости от комбинации гибридизованных и не гибридизованных орбиталей атом углерода может находиться в состоянии sp3-, sp2-, spгибридизации:
а) |
б) |
Рис. 1.2 Расположение орбиталей при sp2 (а) и sp -гибридизации (б) атома углерода.
Гибридизованные орбитали при образовании связи способны к более сильному перекрыванию, чем не гибридизованные.
1.2.Метод молекулярных орбиталей.
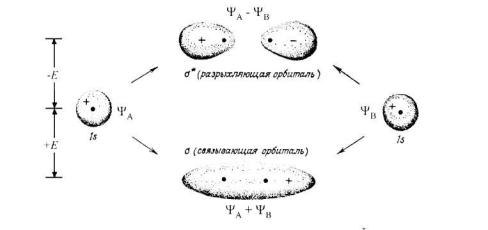
Вметоде молекулярных орбиталей (МО) постулируется, что молекулярная орбиталь является линейной комбинацией атомных орбиталей – их сложением или вычитанием. Связь образуется в результате сложения атомных орбиталей. В физическом смысле это соответствует перекрыванию орбиталей двух атомов. Образующаяся при этом новая орбиталь, называется связывающей молекулярной орбиталью. Связывающая молекулярная орбиталь окружает ядра атомов, образовавших связь. Линейная операция вычитания атомных орбиталей приводит к образованию разрыхляющей молекулярной орбитали. Разрыхляющая орбиталь имеет узел между ядрами (электронная плотность между ядрами практически равна нулю). Разрыхляющая орбиталь всегда выше по энергии, чем связывающая.
Образовавшуюся орбиталь называют сигма (σ )-орбиталью, а связь – σ - связью, если перекрывание орбиталей осуществляется вдоль оси связывания
атомов. Так, например, при образовании связей с атомами водорода в метане четыре sp3-гибридных орбитали атома углерода перекрываются с 1sорбиталями четырёх атомов водорода, образуя четыре одинаковых прочных σ
–связи под углом 109°28´ (тетраэдрический угол). Сходная тетраэдрическая
6
структура возникает также при образовании CCl4. Сигма-разрыхляющая орбиталь обозначается - σ٭.
При перекрывании атомных орбиталей вне оси связывания атомов образуется так называемая π-молекулярная орбиталь, а связи называются π - связями (π и π٭). При заполнении молекулярных орбиталей электронами, первыми заполняются орбитали с более низкой энергией. Разрыхляющие орбитали в основном состоянии молекулы остаются незаполненными. Кроме связывающих и разрыхляющих орбиталей в структуру МО могут входить несвязывающие орбитали, принадлежащие неподелённым парам электронов гетероатомов.
Рис. 1.3. Перекрывание двух 1s –орбиталей, дающее σ- и σ٭-орбитали
1.3. Характеристика ковалентных связей
Основными параметрами, определяющими свойства ковалентной связи,
являются длина, направленность в пространстве, энергия, полярность и поляризуемость.
Длина связи. Длина связи определяется суммой ковалентных радиусов. Энергия связи. Для определения величины энергии связи используют различные методы. Наиболее широко используют термический и масс-
спектрометрический методы.
Энергия диссоциации связи. Количество энергии, затрачиваемое для разрыва связи или выделяющееся при её образовании, называется энергией диссоциации связи. Эта величина характерна для каждой связи.
Полярность связи. Ковалентная связь между двумя одинаковыми атомами является неполярной, в том случае, если электронная плотность распределена равномерно между ядрами атомов, образующих связь. Например, С-С связи в молекулах этана, этилена, бензола являются ковалентными неполярными связями.
7
|
Энергия образования и длины связей |
Таблица 1.1. |
|||
|
|
||||
|
|
|
|
|
|
|
Энергия |
|
|
Энергия |
|
Связь |
Образования связи, |
Длина связи, |
Связь |
Образования связи, |
Длина связи, |
|
кДж/моль |
нм |
|
кДж/моль |
нм |
C-H |
415 |
0,112 |
C-S |
272 |
0,182 |
|
|
|
|
|
|
C-C |
347 |
0,154 |
C-Li |
200 |
0,219 |
|
|
|
|
|
|
C-Cl |
326 |
0,177 |
Cl-Cl |
234 |
0,199 |
|
|
|
|
|
|
C-Br |
286 |
0,191 |
Br-Br |
188 |
0,228 |
|
|
|
|
|
|
C-I |
213 |
0,231 |
H-Cl |
427 |
0,127 |
|
|
|
|
|
|
C-O |
335 |
0,143 |
H-H |
436 |
0,074 |
|
|
|
|
|
|
C ≡ C |
803 |
0,121 |
C = C |
607 |
0,133 |
|
|
|
|
|
|
C - N |
285 |
0?147 |
C = N |
615 |
0?127 |
|
|
|
|
|
|
Если ковалентная связь образована атомами с разной электроотрицательностью, то электроны связи сдвинуты к атому, имеющему большее её значение. В этом случае связь является ковалентной полярной.
Электроотрицательность элемента (χ) – это его относительная способность притягивать валентные электроны. Значения электроотрицательностей лежат в интервале от 0,7 для цезия до 4,0 для фтора. Количественно это выражается или в шкале электроотрицательности Малликена (χм), или в шкале электроотрицательности Полинга (χп) Чем больше разность в электроотрицательности элементов, тем более полярна связь. Сдвиг электронов связи обозначают стрелкой, остриё которой направленно к атому, имеющему большую электроотрицательность. Электроотрицательность галогенов изменяется в таком по-
рядке: F > O > Cl, N > Br > C, H.
Полярность связи определяет тип реакции, которая может произойти по этой связи, а также влияет на реакционную способность соседних связей.
1.4. Семиполярная связь
Семиполярная связь образуется при взаимодействии р-орбитали (или n- орбитали), занятой двумя электронами, одного атома с вакантной р- орбиталью другого атома. При этом происходит полное разделение заряда. Таким образом, атомы связаны ковалентной и ионной связью. Например,

8
связь между кислородом и азотом в оксидах третичных аминов (R3N→O) является семиполярной.
1.5. Простые углерод-углеродные связи
Связывание атомов углерода в этане возникает в результате перекрывания двух атомных sp3 – орбиталей, которое осуществляется вдоль их осей и приводит к образованию прочной σ-связи. Длины углерод-углеродных связей во всех насыщенных соединениях более или менее одинаковы и равны 1,54
А° (0,154 нм).
а) б)
Рис. 1.4. Молекула этана: σ-связь углерод – углерод (а); форма и размеры (б)
Однако, длина простой углерод-углеродной связи между двумя sp2- гибридизованными атомами углерода =СН–СН= , составляет около 1,47 А°, а между двумя sp-гибридизованными атомами углерода – 1,38 А°. Укорочение связи при переходе от sp3 к sp – состоянию обусловлено возрастанием доли более короткой s-орбитали в гибридизованной орбитали.
1.6.Двойные углерод-углеродные связи
Вэтилене каждый атом углерода образует три σ-связи (две связи с атомами водорода и одна – с другим атомом углерода) за счёт sp2-орбиталей. Эти связи лежат в одной плоскости. Показано экспериментально (методом дифракции электронов и спектральными исследованиями), что углы между связями Н–С–Н и Н–С–С составляют соответственно 116,7° и 121,6°. Расстояние С–С в этилене равно 1,34 А°. У каждого атома углерода в молекуле этилена остаётся по одной негибридизованной 2р орбитали, которые расположены перпендикулярно плоскости σ-связей. Эти две атомные 2p -орбитали перекрываются с образованием π-связи, которая располагается над и под плоскостью σ-связей этилена.
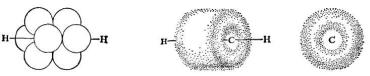
9
а) б)
Рис. 1.5. Молекула этилена: перекрывание р-орбиталей – (а); π-электронное облако – (б).
Боковое перекрывание орбиталей значительно менее эффективно, чем перекрывание вдоль оси, связывающей ядра атомов, поэтом π-связь оказывается значительно менее прочной, чем σ-связь. Энергия π -связи в этилене составляет 60 ккал/моль. Тот факт, что π -электроны распределены над и под плоскостью молекулы, означает существование области отрицательного заряда, готовой для взаимодействия с любыми соединениями, акцепторами электронов, например окислителями. Реакции с акцепторами электронов характерны для двойной углерод-углеродной связи.
1.7.Тройные углерод-углеродные связи
Вмолекуле ацетилена для образования связей с двумя другими атомами углерод использует две эквивалентные sp-гибридные орбитали, образованные комбинацией одной s- и одной p-орбиталей. Эти sp-гибридные орбитали расположены на прямой линии, проходящей через ядра атомов углерода. Таким образом, угол между орбиталями составляет 180°. Ацетилен – линейная молекула, в которой все четыре атома, расположенные на одной прямой, связаны σ-связями. Кроме гибридизованных spорбиталей каждый атом углерода имеет две негибридизованные р- орбитали, которые перекрываются во взаимно перпендикулярных плоскостях, образуя, таким образом две π-связи. Однако и между π-связями существует перекрывание, так, что две π-связи сливаются, образуя одно цилиндрическое π-электронное облако вокруг линии, соединяющей ядра атома (рис.1.6.)
Таким образом, тройная углерод-углеродная связь построена из прочной σ-связи и двух менее прочных π-связей. Длина связи С–С в ацетилене равна 1,2 А°. Линейное расположение связей делает невозможной геометрическую изомерию алкинов.
а) |
б) |
Рис. 1.6. Молекула ацетилена: перекрывание π-орбиталей – (а); π-электронное облако имеет цилиндрическую форму – (б).
2.Электронные эффекты в органических молекулах
2.1.Общие представления.
