
u_sem
.pdf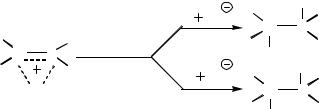
110
|
Br |
|
Br |
|
|
C |
C |
||
|
|
|||
C C |
|
Br |
Cl |
|
|
Cl |
|
||
Br |
C |
C |
||
|
||||
|
|
Br |
|
Эти данные свидетельствуют в пользу образования положительно заряженной промежуточной частицы, атакуемой хлорид-анионом, и исключают возможность присоединения недиссоциированной молекулы брома.
Б. С ионным механизмом реакции согласуется зависимость скорости реакции электрофильного присоединения от полярности растворителя, табл. 10.1.
Таблица 10.1.
Зависимость скорости реакции электрофильного присоединения от полярности растворителя.
Растворитель |
H2O |
CH3OH 50% |
CF3CH2OH |
CH3OH |
CH3COOH |
Константа |
2,5 107 |
9,1 105 |
6,8 104 |
3,8 102 |
|
скорости |
1,13 |
||||
k л/(моль с) |
|
|
|
|
|
|
|
|
|
|
|
ЕтN |
1.0 |
0,97 |
0,89 |
0,79 |
0,65 |
10.3. Влияние природы реагента на скорость реакций электрофильного присоединения к алкенам
Скорость реакции электрофильного присоединения по двойной связи зависит от электроотрицательности элемента, имеющего положительный заряд. Чем больше электроотрицательность элемента, тем выше скорость реакции. Для соединений типа Х-Х′ наблюдается следующий ряд изменения их способности присоединяться к этилену в уксусной кислоте: I2< IBr < Br2 < ICl < BrCl
Реакционная способность многих электрофильных реагентов может быть усилена путём взаимодействия с кислотами Льюиса:
HF + BF3 = H+ + BF4
CH3−Cl + AlCl3 = CH3+ + AlCl4

111
Cl2 + FeCl3 = Cl+ + FeCl4
Лёгкость присоединения галогеноводородов связана с увеличением их кислотных свойств: HI >HBr > HCl > HF
Присоединение воды к алкенам протекает в присутствии кислых катализаторов:
|
|
|
|
H2SO4 |
98% |
|
|
|
|
|
H O, t |
|
|
|
|
||
CH |
|
CH |
|
|
|
|
CH3CH2OSO3H |
2 |
|
CH CH OH |
|||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
2 |
|
CH3-CH2 |
C H2 |
|
H2SO4 |
CH3 |
|
CHCH3 |
|
H2O, t |
CH3 |
|
CHCH3 |
||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OSO3H |
|
|
OH |
|
|||||
Проявление общего кислотного катализа при гидратации исключает альтернативный механизм гидратации алкенов, а именно, атаку водой комплекса алкен − протон.
10.4.Реакционная способность двойной связи
инаправление электрофильного присоединения
Лимитирующей стадией реакции электрофильного присоединения является образование положительно заряженной частицы (бромониевый ион или карбокатион). Следовательно, электронодонорные заместители, стабилизирующие их, будут стабилизировать переходное состояние, предшествующее образованию этих катионов, что приведёт к уменьшению энергии активации реакции и, следовательно, к увеличению скорости реакции. Этому благоприятствуют +I и +М-эффекты заместителей при двойной связи
Увеличение числа алкильных групп при двойной связи (увеличение +I- эффекта) приводит к увеличению скорости реакции, табл 9.2.
Таблица 10.2.
Относительные скорости присоединения электрофильных реагентов
Соединение |
этилен |
бромэтилен |
бутен-1 |
пентен-2 |
|
|
|
|
|
Относительная |
1,0 |
0,03 |
96 |
4600 |
скорость |
|
|
|
|
|
|
|
|
|
Наличие рядом с двойной связью гетероатома, имеющего неподелённую пару электронов (+М-эффект), повышает чувствительность субстрата к
электрофильной атаке:

112
R |
O |
C |
C |
R |
|
|
|
N C C > |
|
|
>> R C C |
R |
|
|
|
H |
O |
C |
C |
Противоположный эффект будет наблюдаться при наличии электроноакцепторных заместителей. Электроотрицательные эффекты (–I или –М- эффекты) дестабилизируют переходное состояние реакции образования карбокатиона, повышают энергию активации реакции и, следовательно, понижают её скорость. Именно таково влияние –I-эффекта, присутствующего в структурах:
|
|
|
|
|
C |
|
|
C |
|
|
|
|
CF3 |
|||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
C |
|
|
|
H >> C |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
C |
|
|
|
|
|
|
N-(R)3 |
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
C |
|
|
S |
|
|
|
R |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Аналогичное влияние оказывают –М-группы связанные с двойной свя-
зью:
 C C
C C  C O R
C O R
C C H >
C C C
C N
N
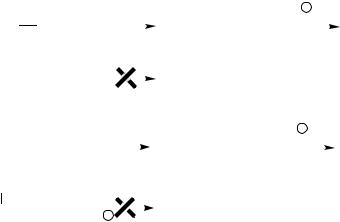
Для несимметричных алкенов направление присоединения электрофильной частицы зависит от устойчивости образующегося карбокатиона.
Известно, что при присоединении хлористого водорода к пропилену образуется в основном 2-хлорпропан (1), а при присоединении к изобутилену – 2- хлор-2-метилпропан (3):
113
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
(1) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
CH3-CH2 |
|
C H2 |
|
|
|
|
|
|
|
CH3CHCH3 |
|
|
|
|
|
CH3 |
|
CHCH3 |
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|||||||||||
CH -CH |
|
|
|
|
C H |
|
|
|
|
|
CH3CH2CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2) |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
3 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
CH |
3 |
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|||||||||||||
CH - |
CH |
|
|
|
C H |
|
|
|
|
|
|
|
|
|
|
|
CH3- C |
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3- C |
|
|
CH |
|
(3) |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
3 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
CH3- |
CH |
|
|
|
|
|
C H2 |
|
|
|
|
|
|
CH3- C |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(4) |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Направление присоединения определяется относительными скоростями конкурирующих реакций образования двух различных карбокатионов. Тот факт, что пропилен превращается в изопропильный карбокатион, а не в пропильный означает, что изопропильный карбокатион образуется быстрее, чем пропильный. Аналогично, трет-бутильный карбокатион образуется быстрее изобутильного. Изучение присоединения многих кислот к алкенам показывает, что направление присоединения определяется скоростью образования карбокатиона и изменяется в следующей последовательности: третичный > вторичный > первичный.
Скорость образования карбокатионов изменяется в том же порядке, что и их устойчивость. Устойчивость карбокатионов: третичный > вторичный >
первичный.
С учётом присутствия различных функциональных групп при атомах углерода, связанных двойной связью, общее правило направления присоединения электрофильных реагентов следующее: электрофильное присоединение к двойной углерод-углеродной связи протекает через стадию образования наиболее устойчивого карбокатиона.
10.5. Реакций электрофильного присоединения: перегруппировки
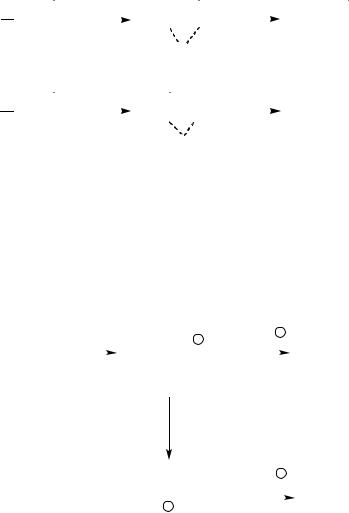
В ходе реакций электрофильного присоединения к алкенам наблюдаются перегруппировки углеродного скелета. Перегруппировки согласуются с механизмом электрофильного присоединения. Поскольку данный тип реакций сопровождается образованием более устойчивого карбокатиона, то более устойчивый карбокатион образуется из первоначально возникшего в ходе пе-
регруппировки. В общем случае, к углероду, несущему положительный заряд, мигрирует атом водорода или алкильная группа с парой электронов. Углерод, от которого уходит эта группа или атом водорода приобретает положительный заряд:
114
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
C |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
C |
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
C |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Например, в ходе реакции хлористого водорода с 3,3-диметилбутеном- 1 образуется не только 2-хлор-3,3-диметилбутан, но также и 2-хлор-2,3- диметилбутан. В нижеприведённом примере образование третичного карбокатиона из вторичного происходит в результате 1,2-сдвига метильной группы с парой электронов к положительно заряженному атому углерода:
|
|
CH3 |
|
|
HCl |
|
|
CH3 |
|
|
Cl |
|
|
|
|
CH3 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH |
|
C |
|
CH |
|
C H |
|
CH |
|
C |
|
CHCH3 |
|
|
|
|
|
|
CH |
|
C |
|
CHCH3 |
|||||||
3 |
|
|
|
3 |
|
|
|
|
|
|
|
3 |
|
|||||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
Cl |
||||||||||
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|||||||||||
CH |
|
|
Cl |
CH |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
C |
|
|
|
CHCH3 |
|
|
|
|
C |
|
|
CHCH3 |
|||||||
3 |
|
|
|
|
|
|
|
|
3 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl CH3 |
|||||||||||||
Если при 1,2-сдвиге атома водорода или алкильной группы может образоваться более устойчивый карбокатион, то происходит перегруппировка. Новый карбокатион присоединяет анион и образует продукт присоединения.
10.6.Стереохимия реакций электрофильного присоединения
калкенам
Реакции электрофильного присоединения к алкенам стереоспецифичны. Так при присоединении брома к циклопентену образуется только транс- 1,2-дибромциклопентан:
Образование свободного карбокатиона в данном случае не согласуется со стереохимией присоединения, так как вакантная p-орбиталь должна была бы стать объектом равновероятной атаки с обеих сторон. В результате этой атаки должны были бы образоваться и цис- и транс- изомеры:
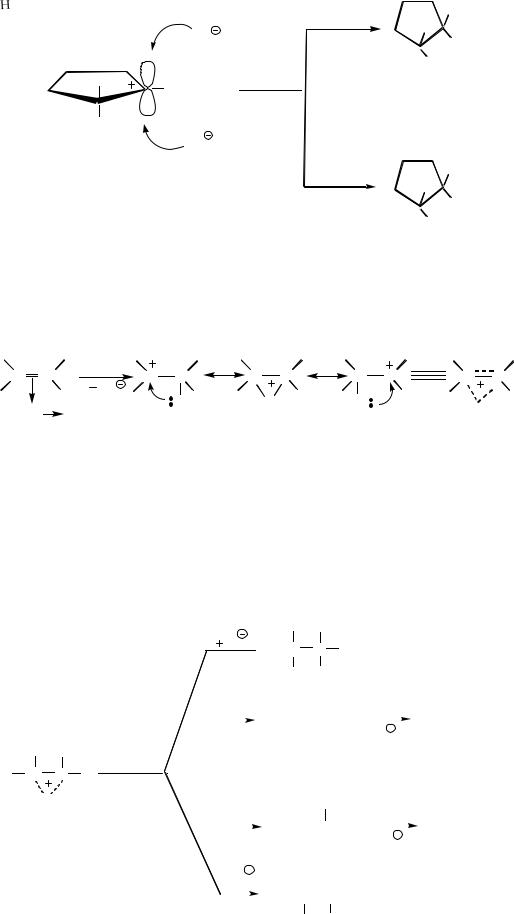
115
|
a |
|
a |
Br |
|
|
H |
||
|
|
|
||
|
|
|
|
|
|
|
Br |
|
H |
H |
|
|
|
Br |
H |
|
|
|
|
|
|
|
|
|
Br |
b |
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
b |
H |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
Br |
Исключительно анти-присоединение согласуется только с образованием промежуточной циклической структуры, которая, вероятно, возникает в результате взаимодействия неподелённой пары электронов присоединившегося брома с карбокатионным центром:
C C |
Br |
C C |
C C |
C C |
C C |
|
Br |
Br |
Br |
|
|
Br |
Br |
Br |
|||
|
|
|
|
Такой мостиковый ион получил название бромониевого иона. Последующая нуклеофильная атака бромониевого катиона бромид-анионом проис-
ходит только с тыльной стороны, что приводит к образованию продукта анти - присоединения.
Кинетические данные свидетельствуют о том, что скорость всего процесса в целом лимитируется образованием карбокатиона или ониевого катиона, а атака бромом происходит очень быстро.
Br
Br 
 C C
C C
Br
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
OH2 |
|
|
|
|
OH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
Br |
||||||||||||||||
C C
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3OH |
|
|
|
|
|
HOCH 3 |
|
|
|
|
|
OCH 3 |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Br
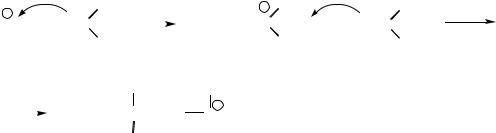
116
На вышеприведённой схеме показано образование смешанных продуктов при проведении реакции присоединения брома в присутствии других нуклеофилов.
Количество продуктов реакции будет определяться количеством нуклеофильного реагента и его относительной нуклеофильностью.
10.7. Катионная полимеризация алкенов
Образующийся при первичном протонировании двойной связи карбокатион, также является электрофилом. Он может присоединиться к двойной связи другой молекулы алкена с образованием димерного карбокатиона, который в свою очередь присоединится к третьей молекуле и т.д. Такие последовательные реакции присоединения могут приводить к образованию нежелательных побочных продуктов, как это наблюдается, в частности, при простом присоединении галогеноводородов. Но это свойство карбокатионов можно специально использовать для получения полимеров, применяя в качестве катализаторов кислоты Льюиса, например, AlCl3, BF3, SnCl4.
В частности, катионная полимеризация применяется для получения полиизобутилена.
Полимеризация изобутилена начинается с реакции кислоты Льюиса с изобутиленом. Начальная стадия процесса полимеризации аналогична электрофильному присоединению по двойной связи. Взаимодействие катиона с изобутиленом, а, следовательно, рост цепи продолжается до тех пор, пока в реакционной смеси достаточно алкена. В структуре полиизобутилена отражается механизм роста цепи с наиболее стабильным катионом на растущем её конце. Этот вид присоединения каждой следующей молекулы мономера известен как присоединение «голова к хвосту»:
|
|
|
|
|
|
|
|
|
|
CH |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
E CH2 |
|
|
C |
|
|
|
|
|
|
|
E |
|
|
|
|
|
CH2 |
|
C |
|
CH |
|
|
C |
3 |
||||||||||
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
2 |
CH3 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
E |
|
|
CH2 |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
CH2 |
|
C |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
||||||||||||
Простые алкены не присоединяют анионы и не образуют устойчивыекарбанионы, следовательно, простые алкены не полимеризуются по анионному механизму.

117
10.8.Реакции электрофильного присоединения
ксопряженным диенам
Реакции присоединения галогенов, галогеноводородов и некоторых других реагентов к сопряженным диенам (1,3-диенами) могут протекать по типу 1,2 – присоединения (прямое присоединение) и по типу 1,4- присоединения (сопряжённое присоединение).
CH2 |
|
|
CH |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
HBr |
CH2 |
CH |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
CH |
|
|
CH |
|
|
CH |
|
|
CH |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
H |
|||||
CH |
|
|
CH |
|
|
CH |
|
|
|
CH |
|
|
|
|
|
Br2 |
|
CH2 |
|
CH |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|
CH2 |
CH |
|
|
CH |
|
|
|
CH2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|||||||
Механизм реакций электрофильного присоединения к сопряженным диенам в основном аналогичен механизму реакций присоединения к алкенам, но имеется ряд отличий, например, присоединение брома к 1,3-бутадиену состоит из трёх стадий.
Первая стадия – образование π-комплекса происходит быстро:
CH |
|
CH |
|
CH |
|
CH |
2 |
|
|
|
Br2 |
|
CH |
|
|
|
CH |
|
CH |
|
CH |
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
Br |
|||||
Вторая стадия – образование аллильного катиона происходит медленно:
CH2 |
|
|
CH |
|
CH |
|
CH2 |
|
|
|
|
|
CH2 |
|
|
|
|
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
Br |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Br |
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Br |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Третья стадия – взаимодействие аллильного катиона с нуклеофилом:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
CH |
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
||
CH |
|
|
|
CH |
|
|
|
CH |
|
|
|
CH |
|
|
|
|
|
|
|
|
|
CH2 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
CH2 |
|
CH |
|
|
CH |
|
|
|
|
|
|
|
|
|
|||||||
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
||||||||||||
|
|
|
CH |
|
|
CH |
|
|
|
CH |
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
Br |
|
|
|
|
|
|
|
|
|
2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Br |
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
||||||||||||||||
118
Образовавшийся аллильный катион мезомерно стабилизирован. В аллильном катионе положительный заряд вследствие эффекта сопряжения катионного центра с π-электронами оставшейся двойной связи делокализован между С2 и С4-атомами углерода. При этом бромид-ион атакует С2 и С4-атомы углерода с образованием продуктов соответственно 1,2- и 1,4-присоединения:
Очень важный вопрос возникает при рассмотрении относительных количеств продуктов 1,2- и 1,4-присоединения. Так при присоединении бромистого водорода к бутадиену-1,3 образуются оба продукта: как 1,2-, так и 1,4- присоединения. Соотношение же этих продуктов зависит от температуры проведения реакции. При −80 °С образуется смесь, содержащая 80% продукта 1,2-присоединения (3-бромбутен-1) и 20% продукта 1,4-присоединения (1- бромбутен-2). При температуре 40°С образуется 80% продукта 1,4- присоединения и только 20% продукта 1,2-присоединения. При промежуточных температурах образуются смеси промежуточного состава. Продолжительное нагревание любого из продуктов присоединения даёт равновесную смесь. Следовательно, эта смесь является равновесной смесью двух изоме-
ров. Преобладание продукта 1,4-присоединения в равновесной смеси говорит о его большей устойчивости. Так как при −80 °С образуется больше продукта 1,2-присоединения, то значит, что этот продукт образуется быстрее. Если поднимать температуру реакции, то продукт 1,2-присоединения постепенно превращается в аллильный катион, который даёт больше термодинамически более устойчивого продукта 1,4-присоединения.
Количество веществ низкотемпературного 1,2-присоединения опреде-
ляется скоростями присоединения (кинетически контролируемый продукт),
а количество веществ высокотемпературного 1,4-присоединения определяет-
ся равновесием между двумя изомерами (термодинамически контролируемый продукт).
11.СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1.Реутов, О.А. Органическая химия. Т. 2 / О.А. Реутов, А.Л. Курц, К.П.
Бутин. – М.: Изд. МГУ, 1999. – 623 с.
2.Реутов, О.А. Органическая химия. Т. 3 / О.А. Реутов, А.Л. Курц, К.П. Бутин. – М.: Бином. Лаборатория знаний, 2003. – 544 с.
3.Березин, Б.Д. Курс современной органической химии / Б.Д. Березин.– М.: Высшая школа, 1999. – 768 с.
4.Артеменко, А.И. Органическая Химия / А.И. Артёменко – М.: Высшая школа, 2000. – 559 c.
5.Травень, В.Ф. Органическая химия. Т. 1 / В.Ф. Травень – М.: Академ-
книга, 2006. – 728 с.
6.Травень, В.Ф. Органическая химия. Т. 2 / В.Ф. Травень – М.: Академ-
книга, 2006. – 582 с.
119
7.Титце, Л. Препаративная органическая химия / Л. Титце, Т. Айхер. –
М.: Мир, 2004. – 704 с.
8.Сайкс, П. Механизмы реакций в органической химии. / П. Сайкс– М.:
Химия, 2000. – 449 с.
9.Илиел, Э. Основы стереохимии /Э. Илиел.– М.: Бином. Лаборатория знаний, 2005. – 745 с.
10.Бакстон, Ш., Робертс С. Введение в стереохимию органических соединений / Ш. Бакстон, С. Робертс – М.: Мир, 2005. – 256 с.
11.Смит, В. Органическая химия. Наука и искусство /В. Смит, А. Боч-
ков, Р. Кейпл. – М.: Мир, 2001. –573 с.
СОДЕРЖАНИЕ |
|
Предисловие авторов |
3 |
1. Структура и реакционная способность |
4 |
1.1. Связи в органических соединениях |
4 |
1.2. Метод молекулярных орбиталей |
6 |
1.3. Характеристика ковалентных связей |
7 |
1.4. Семиполярная связь |
8 |
1.5. Простые углерод-углеродные cвязи |
9 |
1.6. Двойные углерод-углеродные связи |
9 |
1.7. Тройные углерод-углеродные связи |
10 |
2. Электронные эффекты в органических молекулах |
10 |
2.1. Общие представления |
10 |
2.2. Эффект поля и индуктивный эффект |
12 |
2.3. Эффект сопряжения |
14 |
2.4. Эффект сверхсопряжения |
19 |
2.5 Эффект обратного сверхсопряжения |
21 |
3. Типы реакций и классификация реагентов |
24 |
3.1. Классификация реакций |
24 |
3.2. Классификация реагентов |
28 |
4. Кинетика и термодинамика органических реакций |
29 |
4.1. Кинетическое уравнение |
29 |
4.2. Молекулярность реакции |
30 |
4.3. Понятие о лимитирующей стадии реакции |
31 |
4.4 Тепловой эффект реакции |
32 |
4.5. Переходное состояние |
32 |
4.6. Катализ и скорость реакции |
34 |
4.7. Термодинамический и кинетический контроль реакции |
35 |
5. Характеристика интермедиатов реакции |
36 |
5.1. Интермедиаты в многостадийных реакциях |
36 |
5.2. Карбокатионы |
39 |
