
u_sem
.pdf
40
пример, при гидролизе 1-хлорбутена-2 образуется как бутен-2-ол, так и продукт перегруппировки – бутен-3-ол-2.
В большей степени, чем бензильный карбокатион, устойчивы диарилметил - и триарилметил-катионы.
Наличие гетероатома, несущего неподелённую пару электронов в соседнем положении с электронодефицитным центром, заметно увеличивает устойчивость карбокатиона:
CH3 |
|
C |
|
O |
|
CH2 |
CH3 CH3 |
|
C |
|
CH2 |
O |
|
CH3 |
||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|||||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|||||
При отсутствии резонансной стабилизации устойчивость карбокатионов намного меньше. Низкой устойчивостью обладают винил- и фенил-катионы.
Химические свойства карбокатионов. Независимо от способа образо-
вания и типа карбокатионы представляют собой короткоживущие промежуточные частицы, которые вступают в реакции, приводящие к образованию устойчивых продуктов, например, присоединяют анион или электронодонорную молекулу. В ходе реакции карбокатион может перегруппироваться. Движущей силой перегруппировки карбокатиона является образование более устойчивого карбокатиона , чем первоначально образующегося. Перегруппи-
ровки осуществляются за счёт 1,2-сдвига атома водорода с электронной парой:
|
|
H |
|
|
|
|
|
|
|
|
H |
||||||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
CH |
|
CH3 |
|
CH |
|
|
CH2 |
|||||||||
|
|
|
|
|
|
||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
||||||||
или за счёт 1,2-сдвига алкильной или фенильной группы.
5.3. Карбанионы
Карбанионы – это частицы, имеющие неподелённую пару электронов. Они образуются при отщеплении протона от атома углерода органической молекулы. Карбанионы являются основаниями Бренстеда. Принимая протон, карбанион превращается в сопряжённую кислоту, поэтому образование карбанионов, их устойчивость и реакционная способность связаны с силой со-
пряжённой кислоты. Чем слабее кислота, тем сильнее сопряжённое основание и тем менее устойчив карбанион.
Так как большинство СН-кислот являются очень слабыми, и для осуществления их диссоциации необходимы очень сильные основания, то для опре-
41
деления кислотности используют специальные методы. Найдено, что между скоростью отрыва протона (кинетическая кислотность) и термодинамической устойчивостью карбаниона (термодинамическая кислотность) очень часто существует корреляция. Основываясь на этом положении, для установления порядка кислотности углеводородов применяют кинетические измерения. Например, скорость тритиевого обмена для серии родственных углеводородов линейно зависит от их равновесной кислотности.
В табл.5.1 приведены значения отрицательных логарифмов констант кислотности ряда углеводородов
|
|
Кислотность ряда углеводородов |
Таблица 5.1 |
||
|
|
|
|||
|
|
|
|
|
|
соединение |
циклогексан |
толуол |
дифенилметан |
трифенилметан |
фенилацетилен |
|
|
|
|
|
|
рКа |
45 |
40,9 |
33,4 |
31,4 |
26,5 |
|
|
|
|
|
|
Присутствие функциональных групп, которые способствуют делокализации отрицательного заряда карбаниона на более электроотрицательные атомы, такие как кислород, вызывает сильное увеличение кислотности связи С-Н.
Значения рК ряда органических соединений |
Таблица 5.2 |
|||
|
|
|||
|
|
|
|
|
Соединение |
рК |
Соединение |
|
рК |
|
|
|
|
|
CH3NO2 |
17,2 |
CH3SO2Ph |
|
29,0 |
CH3COPh |
24,7 |
CH3SO2CH3 |
|
31,1 |
CH3COCH2 |
26,5 |
CH3CN |
|
31,3 |
|
|
|
|
|
Из данных табл. 5.2 следует, что к функциональным группам оказывающим сильное стабилизирующее влияние на карбанионы принадлежат карбонильная, нитро-, сульфонил- и цианогруппы.
Строение карбанионов. Знание структуры карбанионов важно для понимания стереохимии их реакций. Теоретические расчёты ab initio указывают на пирамидальную геометрию метильного аниона. Вычисленный оптимальный угол Н–С–Н составляет 97–100º.
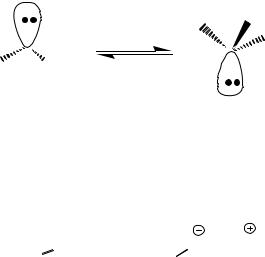
42
R R

 R
R
R




 R
R
R
Рис.5.4. Строение алкильного карбаниона.
Способы получения. Карбанионы получаются в растворах в результате гетеролитического расщепления связи С–Н:
 C
C  H
H 

 C
C  H
H
Лёгкости гетеролиза связи будут способствовать делокализация образующегося заряда и сольватация карбаниона. В качестве оснований для отщепления протона используют спиртовые растворы гидроокисей щелочных металлов, амид натрия в жидком аммиаке, диизопропиламид лития и фениллитий и другие соединения. Ещё одним источником карбанионов являются металлоорганические соединения с ионной связью углерод – металл.
Лёгкость отрыва протона тем больше, чем более устойчив образующийся карбанион.
Чем меньше константа кислотности С-Н-кислоты, тем больше основность сопряжённого этой кислоте основания (карбаниона) и тем выше его реакционная способность. Очень высокой реакционной способностью обладает карбанион CH3 .
5.4. Радикалы
Радикалы были открыты в 1900 г. Мозесом Гомбергом. Он получил трифенилметильный радикал (С6Н5)3С• при взаимодействии трифенилхлорметана с серебром в растворе бензола. Радикал (С6Н5)3С•, с атмосферным кислородом образовывал перекись (С6Н5)3С–О–О–С(С6Н5)3, строение которой было подтверждено встречным синтезом. Образование этой перекиси в реакционной среде можно было объяснить только появлением радикала (С6Н5)3С•.
К середине ХХ века были получены неоспоримые доказательства возможности протекания радикальных реакций в растворах. Этому в значительной мере способствовало развитие хроматографических и спектроскопических методов анализа продуктов реакции. Применение метода ЭПР позволило обнаружить свободные радикалы во многих реакциях.
Радикалы – это атомы или группы атомов с неспаренным электро-
ном. Алкильные радикалы R•, как правило, имеют плоскую структуру с неспаренным электроном на рz-орбитали, расположенной перпендикулярно

43
плоскости sp2-орбиталей. Физико-химическими методами (ИК-, УФ-, и ЭПР) установлено что метильный радикал имеет плоскую структуру.
H |
p |
sp2 |
|
C |
H |
||
|
H
Рис.5.5. Строение метильного радикала: неспаренный электрон находится на р-орбитали, расположенной перпендикулярно плоскости С – Н-связей.
При анализе спектра ЭПР трет-бутильного радикала установлена его пирамидальная геометрия. Очевидно, что на геометрию радикала очень сильное влияние оказывают заместители, и тенденция к непланарности увеличивается с числом и π-донорным характером заместителей. Исследования показали, что радикальные центры не представляют собой жёсткие пирамиды. Наоборот, они либо плоские, либо имеют геометрию уплощенных пирамид. Радикалы, по-видимому, могут также испытывать незначительные геометрические искажения, возникающие в напряженных циклах, без значительного повышения их энергии.
В большинстве своём радикалы существуют лишь короткое время и присутствуют в незначительных количествах. Тем не менее, протекание реакции по радикальному механизму можно установить исходя из природы реагентов, продуктов реакции и условий её проведения. Свободнорадикальные реакции можно затормозить ингибиторами или ускорить введением инициаторов.
Инициаторы радикальных реакций – это соединения, которые легко подвергаются гомолизу, например: ди-(трет-бутилпероксид) и азо-бис- изобутиронитрил очень часто используют в качестве инициаторов радикальных реакций
|
|
CH3 |
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
|
|
|
CH3 |
||||||||
|
|
|
|
|
||||||||||||||||||||||
CH3 |
C |
|
O |
|
O |
|
C |
|
CH3 |
CH3 |
C |
|
N |
|
N |
|
C |
|
CH3 |
|||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
CH3 |
|
|
|
CH3 |
|
CH3 |
|
|
|
CH3 |
|||||||||||||||
|
|
|
|
|
I |
|
|
|
|
|
|
II |
||||||||||||||
Эффективным инициатором радикальных реакций является тетраэтил-
свинец Pb(C2H5)4 .
Ингибиторы радикальных реакций – это вещества, активно взаимодей-
ствующие с радикалами, в результате чего образуются новые более устойчивые (менее реакционноспособные) радикалы. Обычными ингибиторами яв-

44
ляются кислород, йод, полифенолы, амины и другие соединения. Так, кислород образует с алкильными радикалами более устойчивые перекисные ради-
калы R-O-O•
Способы получения. Существует два способа образования свободных радикалов: а) гомолитический разрыв ковалентной связи; б) перенос электрона на ион или с иона
A B A
A
 B
B 
Энергия, необходимая для разрыва связи, может передаваться молекуле при термолизе, фотолизе и радиолизе. Одноэлектронный перенос осуществляется с помощью неорганических ионов или электрохимическим путём.
Свободные радикалы могут образоваться из других свободных радикалов при реакции между радикалом и молекулой или при расщеплении радикала:
R |
|
|
CH2 |
|
CH2 |
|
R |
|
CH2 |
|
CH2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
C |
H |
|
|
C |
O |
|
C H |
|
|
|
CO2 |
5 |
|
|
|
5 |
|
|
|||||
|
|
||||||||||
|
|
|
|
|
|||||||
6 |
|
|
|
O |
6 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
Стабильность радикалов. Стабильность радикалов определяется тремя факторами: а) делокализацией неспаренного электрона, б) пространственными эффектами, в) конформационным фактором.
Стабилизация алкильных радикалов может обеспечиваться за счёт эффекта гиперконъюгации. При этом наибольшее влияние оказывают электроны β- С – Н связей соседних алкильных групп. В трет-бутильном радикале девять С – Н связей участвуют в стабилизации радикала, в изопропильном – шесть, в метильном – ни одного. Поэтому трет-бутильный радикал устойчивее, чем изопропильный, а изопропильный радикал устойчивее, чем метильный. В общем, устойчивость алкильных радикалов увеличивается в ряду: первичный < вторичный < третичный.
Электронодонорные и электроноакцепторные заместители способствуют стабилизации электрона в радикале:
CH3
 C
C 
 CH3
CH3
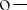 C
C 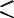
O
CH3 |
|
C |
|
C |
|
CH |
|
C |
|
C |
|
|
|
|
|
||||||
|
|
|
|
|
3 |
|
|
|
||
45
Вследствие делокализации неспаренного электрона на бензольное кольцо, бензильный радикал более устойчив, чем трет-бутильный, а феноксильный радикал устойчивее алкоксильного. Делокализация неспаренного электрона на системы сопряжённых двойных и тройных связей также приводят к стабилизации радикалов.
На стабильность радикалов оказывают сильное влияние пространст-
венные факторы, которые могут затруднить бимолекулярные реакции димеризации или диспропорционирования. Стабильность феноксильных радикалов повышается при введении заместителей в ортоположение. Например, стерическое экранирование радикального центра, в 2,4,6-три-трет- бутилфеноксильном радикале (1) приводит к исключительно высокой его устойчивости и, соответственно, низкой реакционной способности. Очень высокой устойчивостью обладает радикал 2,2-дифенил-1-пикрилгидразил (2). В нём наряду со стерическим экранированием радикального центра объёмными заместителями, стабильность придаёт высокая степень делокализации неспаренного электрона по ароматическим кольцам молекулы:
(CH3)3C |
|
|
|
C(CH3)3 |
|
NO2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
(C6H5)2N |
|
N |
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
C(CH3)3 |
|
NO2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
(1) |
|
|
(2) |
|
|
|
|
|
|
||||
Роль стерического фактора несущественна в реакциях радикалов с малыми молекулами. Конформационный эффект существенен, главным образом, для углеводородных радикалов. Он связан со способностью радикального центра принимать плоскую конформацию. Отклонение от плоской структуры обычно понижает стабильность радикала.
Химические свойства радикалов. Вследствие дефицита одного электрона, радикалы обладают электрофильным характером. Поэтому радикалы склонны атаковывать электронные пары π-, n- и даже С–Н связей.
Реакции присоединения радикалов. Радикалы присоединяются к не-
насыщенным субстратам − алкенам, алкинам, аренам и другим ненасыщенным соединениям. Большое значение реакций присоединения связано с их участием в процессах роста цепи при радикальной полимеризации: стадия инициирования цепи – (1); стадия роста цепи (2), (разд. 6.7).
R |
|
|
CH2 |
|
CH |
|
RCH |
|
|
CH |
( ) |
||
|
|
|
|
|
|||||||||
|
|
2 |
|||||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
R |
1 |
||
|
|
|
|
|
R |
|
|
|
|
|
|
||
46
RCH |
|
|
CH |
|
|
|
CH |
|
|
CH |
|
RCH |
|
|
CH |
|
CH2 |
|
CH |
|
( ) |
||||
|
2 |
|
R |
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
R |
|
|
|
|
|
2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
R |
|
|
||||
Реакции диспропорционирования. Эти реакции включают перенос атома водорода от одного радикала к другому:
|
|
CH |
|
|
CH3 |
|
|
|
|
CH |
|
|
|
|
CH |
|
|
|||||||||||
CH |
|
|
|
3 |
|
|
|
|
|
CH3 |
|
CH |
|
|
|
|
3 |
H |
|
|
CH |
|
|
|
|
|
3 |
CH3 |
|
|
|
C |
|
|
C |
|
|
|
C |
|
|
|
|
|
C |
|
|||||||||||
3 |
|
|
|
|
|
3 |
|
|
|
|
|
2 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
CH3 |
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
||||||||
Реакции рекомбинации. Реакции соединения радикалов с образованием новой связи:
|
|
CH3 |
|
|
|
CH3 |
|
|
|
|
CH |
CH |
|
||||||||||
CH |
|
|
C |
|
|
|
|
|
|
CH3 |
|
CH |
|
3 |
3 |
CH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
3 |
|
|
|
|
|
|
C |
|
|
|
3 C |
|
C |
3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH |
|
|
|
|
CH |
CH |
|
||||||||||
|
|
|
|
|
3 |
|
|
|
3 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|||
Реакции радикалов с переносом электрона.
Радикалы могут окисляться или восстанавливаться в результате переноса электрона. Реакции этого типа протекают с участием металла переменной валентности:
Реакции фрагментации. Реакции фрагментации протекают в растворах и в газовой фазе. Например, трет-бутоксильный радикал распадается на метильный радикал и молекулу ацетона:
CH3 |
|
|
|
|
CH3 |
|||||||
CH3 |
|
C |
|
O |
|
CH |
|
|
CH3 |
C |
|
O |
|
|
|
|
|||||||||
|
||||||||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
||||
5.5. Карбены
Карбены – нестабильные соединения двухвалентного углерода. Они участвуют во многих химических реакциях. С их участием протекают такие важные процессы, как реакция Фишера-Тропша, полимеризация циклоолефинов с раскрытием цикла, синтез оптически активных производных циклопропана.
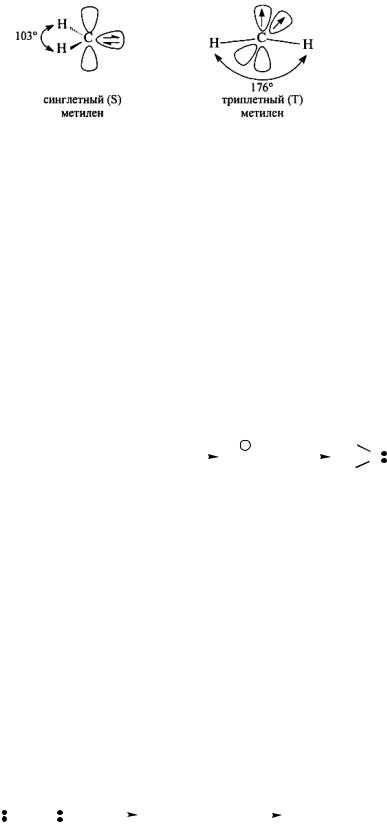
47
Общая формула карбенов RR'C:. Простейший карбен (метилен) имеет строение – :СН2. Карбены могут существовать в двух электронных состояниях, отличающихся своей мультиплетностью:.
Рис. 4.3. Строение метилена: синглетный метилен (S), триплетный метилен (T)
В более богатом энергией синглетном состоянии несвязанные электроны занимают одну орбиталь и имеют противоположные спины. В более стабильном триплетном состоянии эти электроны занимают разные орбитали и имеют параллельные спины. Состояние карбена определяется способом его получения. Разность энергии для двух состояний простейшего карбена (:СН2) составляет 37,7 − 41,8 кДж/моль
Способы получения. Синглетный метилен образуется при фотолизе диазометана CH2N2 или кетена СН2=С=О:
Сталкиваясь с окружающими молекулами, синглетный метилен отдаёт свою энергию и превращается в более устойчивый триплетный метилен.
Дигалокарбены получают при обработке галоформов (СНХ3) щёлочью:
HCCl3 |
|
|
|
|
KOH (C2H5OH) |
|
|
|
|
|
|
Cl |
|
||
|
|
|
|
CCl3 |
|
|
|
C |
|||||||
|
|
|
|
|
|
H2O |
|
|
KCl |
Cl |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Химические свойства карбенов. Независимо от способа получения карбены представляют собой короткоживущие промежуточные частицы, которые невозможно выделить и которые вступают в дальнейшие превращения.
Вследствие дефицита электронов карбены относятся к электрофильным частицам, способным атаковывать электронные пары π- и σ-связей. В то же время, реакционная способность синглетных карбенов двойственна: дважды занятая МО придаёт им нуклеофильные свойства, а вакантная МО ─ электрофильные свойства. Наиболее характерными реакциями карбенов являются четыре типа реакций: реакции ди- и полимеризации, реакции присоединения, реакции внедрения и перегруппировки. Рассмотрим наиболее важные из них.
1. Димеризация триплетного метилена. Димеризация триплетного метилена вследствие высокого теплового эффекта приводит к дегидрированию промежуточного продукта − этилена:
CH |
|
|
CH |
|
[CH |
|
CH |
] |
|
|
|
CH |
|
|
CH |
2 |
|
2 |
2 |
2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
H2 |
|
|
|
|
48
2. Димеризация синглетного дифторкарбена. Димеризация синглетно-
го дифторкарбена в газовой фазе лежит в основе промышленного метода получения тетрафторэтилена:
CF2 |
|
|
CF2 |
|
CF2 |
|
CF2 |
|
|
|
|
||||
|
|
3. Взаимодействие карбенов с непредельными соединениями. Взаи-
модействие карбенов с непредельными соединениями, приводящая к образованию циклопропанов и циклопропенов – самая распространённая реакция карбенов. Когда фотолиз происходит в жидкой фазе, образующийся синглетный метилен быстро присоединяется к алкену. Например, цис-бутен-2 в жидкой фазе даёт только цис-1,2-диметилциклопропан, а транс-алкен – только транс-1,2-диметилциклопропан:
H |
|
|
H |
|
|
|
|
h |
CH |
3 |
CH3 |
|||||
|
|
|
|
|
|
|
|
|
|
|||||||
C |
|
|
|
|
CH2N2 |
H |
|
|
|
H |
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
CH3 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
||||
H |
|
|
CH3 |
|
|
|
|
h |
CH3 |
|
H |
|||||
|
|
|
|
|
|
|
||||||||||
C |
|
|
|
|
|
|
|
CH2N2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
||
Нестереоспецифичность реакции присоединения триплетного метилена к алкенам объясняется ступенчатым характером реакции:
H |
C |
|
H |
|
|
CH2N2 |
h |
CH3 |
H |
|
|
CH3 CH3 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
|
CH3 |
|
|
|
H |
|
|
H |
H |
|||
|
|
|
|
|
|
|
|
||||||
4. Внедрение в С-Н связи. Синглетный метилен может внедряться в связи С–Н алканов, образуя его гомолог. Реакционная способность синглетного карбена так велика, что реакции его внедрения не избирательны. Например, реакция пентана с синглетным карбеном приводит к трём продуктам:
|
|
|
H |
|
H H |
|
|
CH2N2 |
|
|
H H |
|
H |
|||||||||||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
C |
|
C |
|
C |
|
CH3 |
|
CH3 |
|||||||||||||||||
|
|
|
|
|
C |
|
C |
|
C |
|
||||||||||||||||
|
|
|
|
h |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
H |
|
H |
|
H |
|
|
|
|
CH2 H |
|
H |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
||||
49
|
|
H |
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
H |
|
|
|||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
CH |
|
C |
|
C |
|
|
|
|
CH |
|
CH |
|
|
|
|
C |
|
C |
|
C |
|
|||||||||
|
|
|
C |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|||
|
|
H |
|
H |
|
H |
|
|
|
|
|
|
|
|
|
CH2 H |
|
H |
|
|
|||||||||
H
5. Перегруппировки. Алкилкарбены могут подвергаться перегруппировкам с миграцией алкила или водорода. В отличие от перегруппировок карбокатионов, перегруппировки карбенов сразу приводят к устойчивым молекулам:
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|||||||
CH3 |
|
CH2 |
|
|
|
|
CH |
|
CH |
|
|
CH3 |
|
CH2 |
|
CH |
|
CH2 |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
||||||||||||||||||||||
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
CH |
|
|
|
O = C = CH |
|
R |
||||||||||
|
|
|
CH |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
O
Так перегруппировка пропилкарбена приводит к бутену-1, а в результате перегруппировки ацилкарбена образуется алкилкетен.
6. ЦЕПНЫЕ РАДИКАЛЬНЫЕ РЕАКЦИИ
Определённые свойства радикальных реакций являются уникальными в сравнении с другими типами реакций. Основное различие состоит в том, что многие свободнорадикальные реакции являются цепными. Это означает существование механизма, благодаря которому множество молекул превращается в продукт с помощью повторяющегося процесса, инициируемого созданием одной реакционноспособной частицы.
Реакции, в которых превращение исходных веществ в продукты осуществляется путём регулярного чередования нескольких стадий с участием свободных радикалов, называются цепными радикальными реакциями.
6.1. Реакции радикального замещения
Рассмотрение механизма радикального цепного замещения целесообразно провести на примере некоторых химических свойств алканов.
Многие реакции алканов, такие как галогенирование, нитрование, окисление протекают в условиях, способствующих гомолизу ковалентных связей (облучение, термолиз, радиолиз) или в присутствии инициаторов – веществ, гомолитически распадающихся при сравнительно низких температурах.
Замещение водорода на галоген – одна из наиболее изученных реакций алканов.
