
u_sem
.pdf
50
Механизм любой реакции должен объяснять особенности её протекания. Особенности галогенирования алканов заключаются в том, что, например, несмотря на экзотермический характер, реакции хлорирования, она начинается или при нагревании реакционной системы выше 200 ºС, или при облучении её ультрафиолетовым светом. Если реакция инициируется светом, то на каждый фотон поглощённого света образуется несколько тысяч молекул продукта реакции. Реакция замедляется в присутствии небольшого количества кислорода, причём длительность этого периода зависит от количества присутствующего кислорода. Для объяснения вышеперечисленных экспериментальных фактов был предложен следующий механизм реакции.
На первой стадии реакции происходит гомолиз связи в молекуле хлора с образованием двух атомов хлора. Для разрыва этой связи требуется энергии 242,83 кДж/моль. Такое количество энергии достигается нагреванием или облучением (энергия синего света с длиной волны 400ммк составляет 299 кДж/моль):
Первая стадия. Реакция инициирования:
h
Cl2  2Cl
2Cl 
На второй стадии реакции атом хлора, имеющий неспаренный электрон, атакует молекулу алкана, вырывает атом водорода с его электроном, образуя молекулу хлористого водорода и алкильную группу с неспаренным электроном (алкильный радикал). Для алкильных радикалов энергетически благоприятным процессом является взаимодействие с молекулой хлора с образованием молекулы хлористого алкила и новым радикалом хлора. Таким образом, вторая стадия в данном случае состоит из двух реакций. Эта стадия называется стадией роста цепи.
Вторая стадия. Реакции роста цепи:
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
H |
|
|
|
Cl |
|
R |
|
C |
|
|
|
HCl |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
C |
|
|
|
Cl2 |
|
R |
|
|
C |
|
|
|
|
Cl |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||||||
На стадии роста цепи образуется не только продукт реакции, но и возникает новая реакционноспособная частица, это типично для цепных процессов. В реальных условиях проведения реакции, возможно возникновение многих других стадий роста цепи, приводящих к другим продуктам.

51
Образовавшийся хлористый алкил накапливается в ходе реакции и может прореагировать дальше с радикалом хлора с образованием продукта дизамещения и т.д.
Процесс роста цепи не может продолжаться бесконечно. Длина цепи ограничена конкурирующими реакциями стадии обрыва цепи. Эти реакции включают рекомбинацию радикалов, распад и диспропорционирование.
Третья стадия. Реакции обрыва цепи:
а) рекомбинация радикалов:
Cl
 Cl
Cl
 Cl2
Cl2
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
C |
|
R1 |
|
R |
|
C |
|
|
C |
|
R1 |
|||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||||||
б) распад радикалов:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
C |
|
|
C |
|
H |
|
C = C |
|
|
HCl |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в) диспропорционирование:
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
C |
|
|
C |
|
H |
|
H |
|
|
C |
|
R |
|
|
C = C |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С учётом того, что и на стадии роста цепи и в результате рекомбинации образуется большое количество продуктов реакции, галогенирование даже простейшего алкана сопровождается образованием высших алканов и полизамещённых алкилгалогенидов.
6.2. Лимитирующая стадия реакции
Для более детального рассмотрения механизма реакции наибольшую ценность представляет та информация, которую можно получить об энергетических, структурных и стереохимических параметрах лимитирующей стадии реакции.
Лимитирующей стадией, которая контролирует скорость реакции алканов с галогенами и влияет не только на реакционную способность алканов, но и галогенов, является реакция взаимодействия алкана с радикалом галогена на стадии роста цепи.
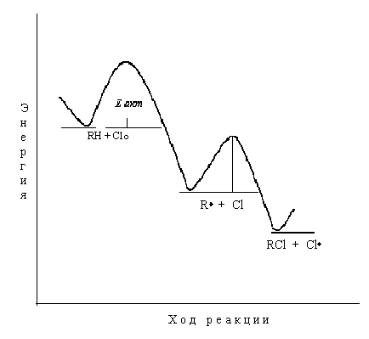
52
Рис. 6.1. Изменение потенциальной энергии в ходе реакции хлорирования алканов.
На рис. 6.1. изображено изменение потенциальной энергии галогенирования алканов. Лимитирующая стадия реакции – это самая медленная стадия. Лимитирующей стадии соответствует максимальная энергия активации на энергетической диаграмме реакции. Из рис. 6.1. видно, что лимитирующей стадией реакции является стадия образования алкильного радикала.
Важным доказательством тому, что лимитирующей стадией реакции является реакция образования алкильного радикала, является высокий первичный изотопный эффект реакции хлорирования метана и дейтерометана: kН
/kD= 12,1.
6.3.Лимитирующая стадия и селективность в реакции хлорирова-
ния алканов.
При хлорировании 2-метилбутана газообразным хлором при комнатной температуре количество каждого изомера составляет: 27% – 1-хлор-2- метилбутана; 23% –2-хлор-2-метилбутана; 36% –3-хлор-2-метилбутана и 14% 3-метил-1-хлорбутана. Фактор вероятности (определяется как количество атомов водорода, при замещении которых образуется данный продукт галогенирования) благоприятствует образованию 1-хлор-2-метилбутана, однако больше всего образуется 3-хлор-2-метилбутана и довольно много (23%) 2- хлор-2-метилбутана– продукта с самым низким фактором вероятности. Это означает, что энергия активации для отщепления третичного атома водорода меньше, чем для отщепления первичного атома водорода. Исследование хлорирования большого числа алканов привело к таким же результатам.
53
С учётом фактора вероятности скорость отщепления атомов водорода изменяется в следующем порядке: третичный > вторичный > первичный. При комнатной температуре относительные скорости замещения водорода на хлор в расчёте на один атом водорода составляют 5,0: 3,8: 1,0.
Отщепление атомов водорода от алканов с образованием алкильных радикалов происходит на лимитирующей стадии процесса галогенирования,
следовательно, чем меньше энергия активации этой реакции, тем быстрее она протекает. Энергия активации реакции является энергией переходного состояния (см. разд. 3.5). Любые факторы, способствующие стабилизации переходного состояния, снижают энергию активации реакции и, следовательно, увеличивают её скорость. Алкильная группа в переходном состоянии имеет характер образующегося свободного радикала в той степени, в какой разо-
рвана связь, поэтому факторы, стабилизирующие свободный радикал, будут стабилизировать возникающий свободный радикал в переходном состоянии.
Так как третичный радикал образуется быстрее, чем вторичный или первичный, то энергия активации образования третичного радикала меньше,
чем вторичного или первичного. Порядок расположения радикалов по лёгкости их образования соответствует изменению их устойчивости. Чем устойчивее свободный радикал, тем быстрее он образуется. Это очень важное обобщение. Устойчивость радикалов определяет направление реакции и реакционную способность во многих реакциях, в которых образуются радикалы.
6.4. Галогенирование алканов другими галогенами.
Отщепление водорода реакционноспособным фтором имеет низкую энергию активации. Переходное состояние достигается очень быстро, поэтому связь С–Н только слегка растянута. В таком случае избирательность реагента низкая. Состав и количество продуктов реакции определяются только фактором вероятности.
Отщепление водорода менее реакционноспособным атомом брома, напротив, имеет очень высокую энергию активации. Переходное состояние достигается только тогда, когда образуется новая связь H–Br, а связь С–Н уже почти разорвана. Поэтому переходное состояние быстрее достигается тогда, когда образуется более устойчивый радикал. В этом случае избирательность (селективность) реагента достаточно высокая. В табл. 6.1 представлена относительная реакционная способность атомов галогенов.
Йодирование является высоко эндотермическим процессом даже для устойчивых радикалов, поэтому реакция идёт в обратном направлении. Известно, что алкилиодиды под действием йодистого водорода легко превращаются в углеводороды и йод.
54
Таблица 6.1.
Относительная реакционная способность первичной (1º), вторичной (2º) и третичной (3º) С–Н связи в н-бутане и 2-метилпропане по отношению к галоген-радикалам (газо-
вая фаза)
Радикал |
1º |
2º |
3º |
|
|
|
|
F• |
1 |
1,2 |
1,4 |
Cl• |
1 |
3,9 |
5,1 |
Br• |
1 |
82 |
1600 |
|
|
|
|
Из данных табл. 6.1 видно, что селективность от фтора к брому очень сильно повышается, так что в 2-метилпропане замещается только третичный атом водорода. Свободнорадикальное бромирование углеводородов, вследствие высокой селективности является важным методом введения функциональных групп в инертные в химическом отношении соединения. Так, например, бромирование о-ксилола бромом при облучении даёт 1,2- дибромметилбензол с выходом 53%.
6.5. Инициирование и ингибирование цепных радикальных реакций.
Многие цепные радикальные реакции, представляющие интерес для органической химии зависят от присутствия инициатора, являющегося источником свободных радикалов. Инициатор даёт толчок цепному процессу при гораздо более низких температурах, чем это возможно для реакционной смеси, содержащей только реагенты. В качестве инициаторов используют вещества, которые легко распадаются на радикалы, например, органические пероксиды, такие как ди-трет-бутилпероксид, пероксид бензоила.
Ингибиторы радикальных цепных реакций – это вещества, замедляющие цепные радикальные реакции. Например, реакция галогенирования алканов замедляется, если в реакционной системе присутствует кислород. Кислород взаимодействует с алкильными радикалами, образуя мало реакционноспособный перекисный радикал, который обрывает цепь:
СН3 • + О2 → СН3 – О–О•
Вещество, которое замедляет или останавливает реакцию, даже присутствуя в небольших количествах, называется ингибитором. Ингибирова-
ние реакции небольшим количеством добавленного вещества характерно для

55
цепных реакций любого типа и часто является одним из признаков, позволяющих предположить цепной характер реакции.
Ингибиторы имеют значительную практическую ценность. Термин «антиоксидант» применяют к ингибиторам, замедляющим свободнорадикальное окисление. Действие антиоксидантов особенно важно в случае таких органических материалов, как смазочные масла, мономеры и продукты питания. В качестве антиоксидантов используют ароматические амины, фенолы, соединения двухвалентной серы и трёхвалентного фосфора.
6.6. Реакции радикального присоединения
Ряд веществ легко присоединяется в форме радикалов к двойным и тройным связям. Это галогены, бромистый водород, хлороформ, четырёххлористый углерод, альдегиды и меркаптаны.
Присоединение бромистого водорода к пропену в присутствии перекисей или на свету не подчиняется правилу Марковникова. Реакция протекает по радикальному цепному механизму. Стадия инициирования цепи включает образование атома брома в результате взаимодействия инициатора с молекулой бромистого водорода рис. 6.2, (1). Стадия роста цепи включает две реакции – реакцию присоединения брома к алкену с образованием алкильного радикала и реакцию отщепления алкильным радикалом водорода от молекулы бромистого водорода рис. 6.2, (2,3).
Так как данная реакция протекает с образованием более устойчивого вторичного радикала, то присоединение происходит против правила Марковникова:
R + HBr |
|
|
|
|
|
|
RH + Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
(2) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
C = C |
|
|
|
|
|
|
|
|
|
|
|
C |
C |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C C |
|
|
|
|
|
HBr |
|
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
Br |
(3) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
H |
|
|
|
|
|
|
|||||||
Рис. 6.2. Механизм реакции радикального присоединения бромистого водорода к алкенам: реакция 1- стадия инициирования; реакции 2, 3 – стадия роста цепи.
Среди реакций радикального присоединения особенно интересны реакции полигалогенметанов и альдегидов. Реакция алкенов с тетрахлорметаном протекает в присутствии инициаторов при температуре 60 – 100 ºС. Механизм реакции может быть представлен следующим образом:

56
R + Cl:CCl3  RCl
RCl  Cl3C
Cl3C
Cl3C
 R-CH = CH2
R-CH = CH2  R-CH-CH2-CCl3
R-CH-CH2-CCl3
R-CH-CH2-CCl3  Cl:CCl3
Cl:CCl3 R-CHCl-CH2-CCl3
R-CHCl-CH2-CCl3  Cl3C
Cl3C
Для пентена-1 выход в этой реакции составляет 72%. В случае бутадие- на-1,3 имеет место 1,4-присоединение, так как в ходе реакции образуется более устойчивый аллильный радикал. При радикальном присоединении ацетальдегида к пропену образуется метилпропилкетон с выходом 11%.
6.7. Радикальная цепная полимеризация
При присоединении инициатора к алкену образуется алкильный радикал. Этот радикал способен присоединять с постоянной, часто очень высокой скоростью множество других молекул алкена, так как для разрыва π–связи требуется сравнительно небольшая энергия:
R |
|
|
R-CH = CH2 |
|
R-CH2- |
|
CH |
|
|
|||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|||
R-CH -CH |
|
|
|
R-CH = CH |
2 |
|
|
|
R-CH2- |
CH-CH CH |
||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|||
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
R |
R |
|||
Длина цепи достигает часто очень большой величины (103 – 105). Для того чтобы получились длинные цепи, необходимо вводить в реакцию очень чистые вещества и тщательно удалять кислород воздуха (ингибитор). Обрыв цепи происходит в результате рекомбинации или диспропорционирования макрорадикалов. В случае несимметричных олефинов минимум пространственных препятствий обеспечивает только присоединение молекул мономера «голова к хвосту». Например, бутадиен полимеризуется практически исключительно в 1,4-положение:
R
 CH2 = CH-CH=CH2
CH2 = CH-CH=CH2  CH2 = CH-CH=CH2
CH2 = CH-CH=CH2  CH2 = CH-CH=CH2
CH2 = CH-CH=CH2
 R-CH 2-CH=CH-CH2-CH2-CH=CH-CH2-CH2-CH=CH-CH2
R-CH 2-CH=CH-CH2-CH2-CH=CH-CH2-CH2-CH=CH-CH2
Все реакции радикальной цепной полимеризации протекают с выделением тепла. При полимеризации выделяется от 40 до 100 кДж/моль. К наиболее важным и легко полимеризующимся по радикальному механизму моно-

57
мерам относятся этилен, винилхлорид, акрилонитрил и эфиры акриловой кислоты, стирол, бутадиен, хлоропрен, тетрафторэтилен.
7. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ У НАСЫЩЕННОГО АТОМА УГЛЕРОДА
Реакции нуклеофильного замещения в алифатическом ряду имеют исключительно большое синтетическое значение. Создание механизма этих реакций базировалось на множестве экспериментальных фактов и наблюдений.
Развитие теории нуклеофильного замещения является заслугой американских и английских химиков К. Ингольда и Э. Хьюза.
7.1. Нуклеофильное замещение. Общие положения
Реакции нуклеофильного замещения (SN) можно представить в виде общего уравнения:
R X  Z
Z 
 R Z
R Z  X
X 
Как видно из приведённого уравнения связь R–X гетеролитически разрывается, а новая связь образуется за счёт пары электронов :Z.
В результате нуклеофильного замещения у насыщенного атома уходя-
щая группа Х в органическом субстрате RХ, содержащем связь C−Х, замещается нуклеофильным реагентом :Z таким образом, что неподеленная пара нуклеофила в продукте реакции RZ становится электронной парой σ-связи С−Z, а электронная пара σ-связи С−X становится неподеленной парой отщепившейся уходящей группы.
Уходящую группу Х: часто называют нуклеофугом («подвижный в виде нуклеофила»). Хорошие уходящие группы имеют высокую нуклеофугность, плохие уходящие группы — низкую нуклеофугность. К хорошим нуклеофугам относятся, в частности, трифлатная (OTf), уходящая в виде аниона CF3S03 , фторсульфонатная FS03 , пара-толуолсульфонатная или тозилатная (n-СН3С6Н5SO3 )- и др. К слабым нуклеофугам можно отнести, карбоксилатион (RCOO ), а также F .
К числу реакций нуклеофильного замещения относятся многие хорошо известные реакции. Некоторые из них представлены в табл.7.1.
Из данных табл. 7.1 следует, что по механизму нуклеофильного замещения протекают различные типы гофмановского разложения, кислотный или щелочной гидролиз и алкоголиз алкилгалогенидов, а также гидролиз сложных эфиров − алкилсульфатов, алкилнитратов, алкилсульфонатов. По типу нуклеофильного замещения протекают процессы превращения алкилга-

58
логенидов в нитрилы, алкилирование фенолов и тиолов, алкилирование эфиров малоновой кислоты и ацетоуксусного эфира.
Чтобы подойти к пониманию механизма таких реакций, необходимо рассмотреть предельные случаи, как их определили Хьюз и Ингольд.
Таблица 7.1.
Некоторые реакции нуклеофильного замещения
Реагент |
Субстрат (атакуемая частица) |
Продукт реакции |
|
|
AlkHal |
Hal |
AlkHal′ |
|
OR , OHR |
AlkHal |
AlkOR |
SR2 |
AlkHal |
AlkSR2+ |
NHR2 |
AlkHal |
AlkNR2 |
NR3 |
AlkHal |
AlkNR3+ |
CN |
AlkHal |
AlkCN |
HHal |
AlkOR |
AlkHal |
Hal |
AlkSR2+, AlkNR3+ |
AlkHal |
OR , OHR |
AlkSR2+, AlkNR3+ |
AlkOR |
NR3 |
AlkSR2+ |
AlkNR3+ |
NOHal |
AlkNH2 |
AlkHal |
NOOR |
AlkNH2 |
AlkOR |
|
|
|
Существует два предельных случая нуклеофильного замещение: бимо-
лекулярное нуклеофильное замещение, обозначаемые символом SN2 (substitution nucleophilic bimolecular) и мономолекулярные нуклеофильное замещение -
SN1 (substitution nucleophilic monomolecular).
Анализ этих предельных случаев наиболее удобно провести на примере реакций очень важного в синтетическом отношении класса органических соединений – алкилгалогенидов.
Химические свойства алкилгалогенидов в значительной мере определяются поляризуемостью связи С−Hal, поэтому галоген, связанный с углеродом (Hal), можно легко заменить в виде галогенид-аниона на другой анион (нуклеофил). Вследствие легкости, с которой происходит замещение слабоосновных ионов галогена, их называют хорошими уходящими группами.
Типичными реакциями алкилгалогенидов являются реакции нуклеофильного замещения.
Алкилгалогениды реагируют со многими нуклеофильными реагентами, как органическими, так и неорганическими, образуя большое число важных соединений. К этим реагентам относятся не только отрицательно заряженные ионы, например окси-, алкокси- и цианид-ионы, но и такие нейтральные соединения, как вода и аммиак. Характерная особенность этих реагентов — на-
личие свободной пары электронов.
59
В табл. 7.1 представлены реакции алкилгалогенидов, протекающие по механизму нуклеофильного замещения.
Как правило, при переходе от иодпроизводных к бром- и хлорпроизводным, реакционная способность падает. Это связано с укорочением связи С−Hal в указанном ряду и увеличением энергии этой связи. Фторалканы по своим свойствам значительно отличаются от соединений других галогенов.
По сравнению с галогеналканами гетеролиз связи С−Hal в аллил- и бензилгалогенидах облегчен из-за того, что образующиеся в реакции нуклеофильного замещения карбокатионы мезомерно стабилизован за счет электро-
нов двойной связи или за счёт ароматической -системы бензольного кольца соответственно:
CH2 X |
CH2 |
CH2 |
CH2 |
|
X |
|
|
7.2. Бимолекулярное нуклеофильное замещение (SN2)
Существуют два основных типа реакций ионного замещения алифатических соединений. Один из них известен как бимолекулярное нуклеофильное замещение
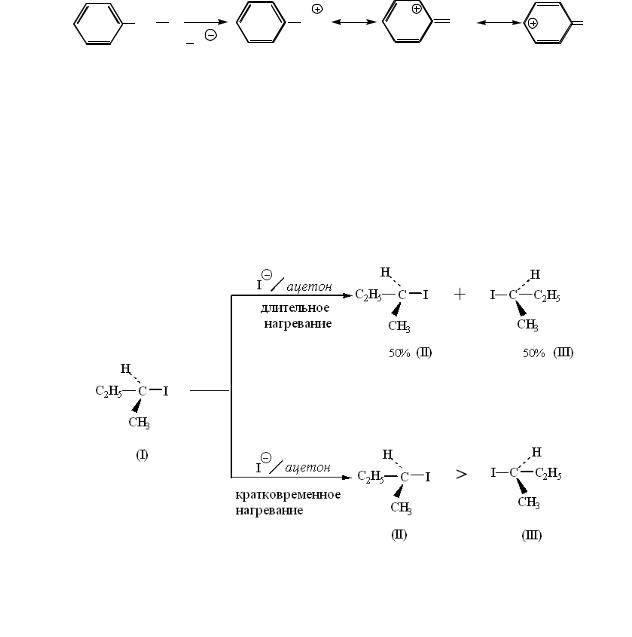
Известно, что если нагревать (+)-2-иодбутан достаточно долго в ацетоне, содержащем иодид натрия, то образуется рацемический 2-иодбутан, т. е. продукт состоит из эквимолярной смеси (+)- и (−)-2-иодбутанов:
Если нагревание прекратить до завершения рацемизации, то реакционная смесь будет обогащена (+)-2-иодбутаном. Действительно, ни в одном случае в реакционной смеси не удалось обнаружить избыток (−)-2-иодбутана.
