
u_sem
.pdf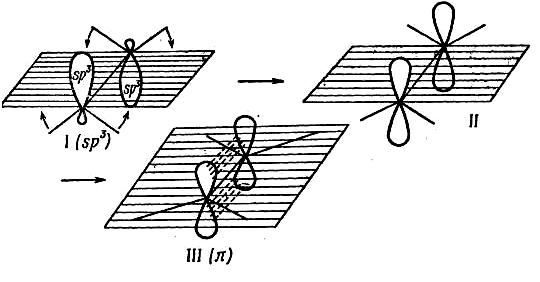
80
Рис. 10.1. Схематическое изображение процесса перекрывания орбиталей при образовании π-связи в ходе элиминирования
С другой стороны, хорошая уходящая группа в сильно ионизирующем растворителе может привести к Е2-переходному состоянию со значительным расщеплением связи по уходящей группе, что очень похоже на Е1-процесс.
Природа переходного состояния контролирует направление β- элиминирования в соединениях, в которых новая кратная связь может вводиться в одно из нескольких положений.
Механизм Е2 подтверждается:
1.Кинетическими данными (реакция второго порядка). Первый порядок по субстрату и первый порядок по основанию.
2.Проявлением кинетического изотопного эффекта. При замене атома водорода, являющегося уходящей группой, на дейтерий наблюдается кинетический изотопный эффект с величиной от 3 до 8.
Так, например, дегидробромирование немеченого 2-бромпропана этилатом
натрия происходит в 7 раз быстрее, чем меченого соединения (CD3)2CHBr. Такой значительный изотопный эффект свидетельствует о разрыве связи уг- лерод-водород в переходном состоянии на стадии, определяющей скорость реакции.
3.Отсутствием перегруппировок углеродного скелета в ходе элиминирования.
4.Стереохимия Е2-реакций. Самое убедительное доказательство найдено при изучении стереохимии. Реакция Е2 стереоспецифична.
8.2.2. Е2реакции: влияние природы основания на механизм элиминирования
Реакции Е2 вызываются следующими основаниями (В ): H2O, R3N, CH3COO , C6H5O , OH , RO , H2N , CO32- и др.

81
При бимолекулярном отщеплении реагирующее основание отщепляет протон от молекулы субстрата на стадии определяющей скорость реакции и в этом случае имеет значение реакционная способность основания по отношению к ионам водорода, собственно основность. Некоторые основания можно расположить по убывающей величине основности в таком порядке: RO >HO
>C6H5O > CH3COOH > Br .
Вприсутствии очень слабого основания, например воды, отщепление
по механизму Е1 гораздо более вероятно, чем по механизму Е2. Поэтому, чтобы осуществить элиминирование по Е2-механизму, следует ввести в реакцию сильное основание, например, щелочь или алкоголят. В этом случае также удаётся подавить конкурирующую реакцию сольволиза. Например, при взаимодействии изопропилбромида с этилатом натрия продукт SN2-реакции (этилизопропиловый эфир) составляет лишь 20% от общего продукта реакции. Остальное — пропен, который образовался в результате Е2элиминирования:
SN |
2 |
|
CH3CH2OCH(CH3)2 |
(20%) |
|||
|
|
|
|
|
|
||
|
|
Br |
|
||||
|
|
|
|||||
CH3
CH3CH2O  H C Br C2H5OH
H C Br C2H5OH
CH3
E2 |
CH3 C CH2 |
(70%) |
HBr |
В случае Е2-элиминирования практическое значение имеют лишь реакции, протекающие под действием ионного основания.
8.2.3. Влияние природы уходящей группы на скорость Е2-реакций
Вкачестве уходящей группы (Х) в соединении рассматривают:
Х= -NR3+, -PR3+, -SR2+ (расщепление солей аммония, фосфония и сульфония по Гофману)
Х= -Cl, -Br, -I (дегидрогалогенирование алкилгалогенидов)
Х= –OSO2R (образование олефинов из эфиров серной кислоты)
Наблюдается определённая корреляция между реакционной способностью R-Х и силой кислоты HХ, где группа Х, соответствующая наиболее сильной кислоте, одновременно является наилучшей уходящей группой. Для органических галогенидов с данной группой R скорость отщепления изменяется в следующем порядке: I > Br > Cl > F.
Дегидратация спиртов протекает в присутствии кислых катализаторов. Присутствие кислоты создаёт условия для отщепления H2O, которая является лучшей уходящей группой, чем ОН
82
8.2.4. Е2 реакции: влияние природы растворителя
Влияние природы растворителя на скорость реакции является результатом различий энергий сольватации начального и переходного состояний, поэтому такие различия влияют на величину энергии активации. Сольватация в любом состоянии зависит от электрических зарядов. Она увеличивается с увеличением заряда и уменьшается при его рассредоточении. Кроме того, сольватирующая способность растворителя возрастает с увеличением его дипольного момента
Е2-реакции характеризуются меньшей полярностью переходного со-
стояния по сравнению с исходным состоянием, так как ионный заряд основания распределяется на большую область. Поэтому полярные растворители вызывают уменьшение скорости реакции; так как в переходном состоянии заряд более делокализован. В табл. 10.1. приведены данные, показывающие влияние природы растворителя на скорости бимолекулярного элиминирования Е2. В качестве растворителей использованы смеси этилового спирта с водой, в которых вода является наиболее полярным компонентом.
Таблица 8.1
Влияние природы растворителя на скорость бимолекулярного элиминирования (Е2)
|
|
|
|
|
|
|
|
Реакция элиминирования: |
Темпера- |
Константа скорости (л*моль-1* с-1) с |
|||||
|
тура, |
содержанием воды в этаноле , % |
|||||
Реагент + субстрат |
ºС |
0 |
10 |
20 |
30 |
40 |
100 |
|
|
|
|
|
|
|
|
OH + изо-C3H7Br |
55 |
1,46 |
|
0,71 |
|
0,47 |
|
OH + (C2H5)2S+ |
100 |
|
|
2050 |
|
210 |
2,4 |
H2O + Ar(CH2)2N+(CH3)3 |
100 |
|
2,1 |
|
1,4 |
|
0,39 |
|
|
|
|
|
|
|
|
Из данных табл. 8.1. видно, что с увеличением полярности растворителя, скорость всех приведённых реакций элиминирования уменьшается. В случае отщепления бромистого водорода от изо-C3H7Br константа скорости уменьшается только в 3,1 раза, а в случае элиминирования алкилсульфониевых солей с увеличением полярности растворителя константа скорости уменьшается в 854 раза.

83
8.2. 5. Направление элиминирования и влияние пространственных факторов
Из первичных соединений всегда образуется лишь алкен-1, тогда как в случае вторичных и третичных соединений может образоваться несколько изомерных алкенов:
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
C1 |
|
C2 |
|
|
C3 |
|
C4 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
H |
|
X |
|
H |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
C |
|
|
|
|
|
|
HX |
|
|
|
|
C |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
C1 |
|
C2 |
|
C3 |
|
C4 |
|
|
|
|
|
|
C1 |
|
C2 |
|
C3 |
|
C4 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||||||||||
элиминирование |
|
|
|
|
|
|
|
|
|
|
|
|
элиминирование |
|||||||||||||||||
по Зайцеву |
|
|
|
|
|
|
|
|
|
|
|
|
|
по Гофману |
||||||||||||||||
Оба направления элиминирования известны уже давно и послужили основой для эмпирических правил.
В соответствии с правилом Зайцева (1875 г.) из вторичных или третичных галогенидов и спиртов преимущественно образуется олефин с наибольшим числом алкильных групп, или другими словами протон отщепляется от того атома углерода, который имеет наименьшее число атомов водорода.
Правило Зайцева можно проиллюстрировать на примере реакции 2- бромбутана с основанием. В молекуле 2-бромбутана имеются два различных типа β-атомов водорода. При отщеплении атомов водорода, принадлежащих к одному типу, образуется 1-бутен (Сβ'— Н), в то время как отщепление атома водорода второго типа приводит к 2-бутену (Сβ— Н).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
CH |
|
|
CH |
|
CH3 |
(81%) |
||
|
H |
|
H |
H |
|
|
|
|
|
|
|
|
|
|
H Br |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
CH3CH2O |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
H |
|
C |
|
C |
|
C |
|
CH |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
C2H5OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
H |
|
Br |
H |
|
|
|
|
|
|
CH |
|
|
CH2CH3 |
(19%) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H Br |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Эта реакция следует правилу Зайцева, поскольку основной продукт представляет собой наиболее замещенный алкен. Известно, что увеличение

84
числа алкилъных групп при двойной связи увеличивает стабильность этой связи. Поэтому в тех случаях, когда выполняется правило Зайцева, следует ожидать образования наиболее замещенного алкена.
Гофман установил (1851 г.), что при термическом разложении четвертичных аммониевых оснований предпочтительно возникает алкен с наименьшим числом алкильных групп.
Превращение гидроксида тетраэтиламмония в триэтиламин, этилен и воду может служить характерным примером реакции Гофмана:
|
|
|
C |
2H5 H |
|
H |
|
|
|
|
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
C2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
N |
|
C |
|
C |
|
H |
OH |
|
|
C |
H |
|
|
N |
|
|
|
CH |
|
|
|
|
|
H O |
||||||||||
|
|
|
|
|
|
|
|
|
2 |
5 |
C2H5 |
|
|
|
|
2 |
|
2 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
C2H5 H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Из |
экспериментальных |
данных |
|
|
|
|
по |
|
|
|
ионному |
отщеплению 2- |
||||||||||||||||||||||||
алкилзамещённых этильных соединений была выведена такая закономерность: правило Зайцева соблюдается всегда при Е1-элиминировании, а при Е2, в случае алкилгалогенидов и алкиловых эфиров сульфокислот. Правило Гофмана соблюдается при Е2-элиминировании в случае алкиаммониевых, алкилсульфониевых и алкилфосфониевых соединений.
Причина, по которой положительно заряженные группы отщепляются по правилу Гофмана, а галогены − по правилу Зайцева, связана с тем обстоятельством, что положительно заряженные уходящие группы значительно больше по размеру, чем галогенид-ионы. Влияние размера уходящих групп на соотношение реакций элиминирования по Зайцеву и по Гофману можно продемонстрировать и другими способами. Например, увеличение объема основания или размера заместителей при Сα и Сβ повышает количество гофмановского продукта, даже если уходящая группа является анионом. Приведенные ниже примеры и данные табл. 10.2 показывают, что для получения значительного количества продукта элиминирования по Гофману необходимы большие стерические изменения:
CH3CH2O |
CH3CH2 |
|
CH |
|
CH2 |
(19%) |
|
C2H5OH |
|
|
|
||||
|
|
|
|
|
|
||
H
CH3 CH2 C CH3
Br |
|
|
|
|
|
|
|
|
|
|
(CH3)3CO |
||||||||
|
|
||||||||
|
|
|
|
|
CH3CH2 |
|
CH |
|
CH2 (53%) |
|
|
|
|
|
|
|
|||
|
(CH3)3COH |
||||||||
85
|
|
CH3 CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 CH |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
CH3CH2O |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
(21%) |
||||||
CH |
|
C |
|
|
C |
|
|
|
CH3 |
|
CH |
|
C |
|
|
C |
|
|
|
|
CH |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5OH |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||||||
|
|
H |
Br |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
CH3 |
|
|
H |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
H |
CH3 |
|
|
||||||||||||||||
|
|
|
|
|
CH3 |
CH3CH2O |
|
|
|
|
(86%) |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
CH |
C |
|
|
C |
|
|
|
C |
|
|
|
|
|
|
|
CH |
C |
|
C |
|
C |
|
CH |
2 |
|||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5OH |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
CH3 |
|
H |
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
H |
|
|
|
|
|
|
||||||||||||||
Таблица 8.2.
Влияние заместителей на направление элиминирования
№ |
|
|
Выход алкена, % |
|
|
|
|
|
|
п.п. |
Субстрат |
Х |
Алкен-1 |
Алкен-2 |
|
|
|
(элиминирование |
(элиминирование |
|
|
|
по Гофману) |
по Зайцеву) |
1 |
СН3СН2CH(X)CH3 |
Br |
19 – 25 |
81 – 75 |
2 |
CH3CH2CH2CH(X)CH3 |
(CH3)2S+ |
74 |
26 |
3 |
Br |
29 |
71 |
|
4 |
СН3СН2C(X)(CH3)2 |
(CH3)3N+ |
98 |
2 |
5 |
Br |
30 |
70 |
|
6 |
|
(CH3)2S+ |
86 |
14 |
|
|
|
|
|
В табл. 8.2. показано влияние объёма и количества алкильных групп при Сα на направление элиминирования: с увеличением числа алкильных групп при Сα увеличивается количество продукта элиминирования по Гофману. Из данных табл. 8.2. также следует, что преимущественное отщепление по Гофману достигается лишь в случае соединений с трудно отщепляющимися группами в присутствии сильных оснований.
Таблица 8.3.
.
Доля продукта элиминирования по Зайцеву, (%)
Субстрат |
Х = I |
Br |
Cl |
n-O2NC6H4SO2O |
n-H2NC6H4SO2O |
|
|
|
|
|
|
СН3СН2C(X)(CH3)2 |
– |
66,5 |
56,9 |
– |
– |
СН3СН2CH(X)CH3 |
80,4 |
75,3 |
63,2 |
59,3 |
57,9 |
|
|
|
|
|
|

86
Изменение относительной скорости для α-алкил и β-алкил замещённых соединений тесно связано со склонностью заместителей Х к отщеплению: α- алкил-замещённые соединения реагируют тем быстрее, чем меньше склонность Х к отщеплению. Наоборот, β-алкил замещённые соединения реагируют тем быстрее, чем больше склонность Х к отщеплению, табл. 8.3.
Реакция Е2 стереоспецифична: пять атомов, участвующих в реакции, включая атом основания, в переходном состоянии должны лежать в одной плоскости. Это может быть достигнуто двумя путями. Группы Н и Х могут находиться в транс-положении по отношению друг к другу и тогда двугранный угол между ними составляет 180º (А)
H H
X
Если же они находятся в цис-положении, двугранный угол равен нулю (Б). Конформация А называется анти-перипланарной. Элиминирование из такой конформации, при которой Н и Х уходят в противоположных направлениях называется анти-элиминированием или транс-элиминированием. Конформация Б – син-перипланарная. Элиминирование из этой конформации, когда Н и Х уходят в одном и том же направлении, называют син-элиминированием или цис-элиминированием.
Бимолекулярное отщепление протекает гладко лишь тогда, когда четыре центра, участвующие в реакции, лежат в одной плоскости, т.е. когда отщепляющиеся заместители находятся в транс-конформации.
Транс-элиминирование обычно гораздо предпочтительнее цисэлиминирования. Например, при элиминировании HBr из мезо-1,2-дибром- 1,2-дифенилэтана образуется цис-2-бромстильбен. Такое взаимодействие указывает на механизм транс-Е2 элиминирования:
|
Br |
Br |
C6H5 |
|
H |
|
Br |
|||
|
|
|
|
|
|
|
||||
H |
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
|
|
|||
|
C |
H |
H |
|
|
H5C6 |
|
C |
H |
|
|
6 |
5 |
|
|
|
6 |
5 |
|||

87
Анти-элиминирование также протекает при отщеплении HBr от правовращающего или левовращающего 1,2-дибром-1,2-дифенилэтана:
Br |
H5C6 |
Br |
|
Br |
Br |
|
C6H5 |
|
H |
|
C6H5 |
|||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
H |
|
|
H |
H |
|
|
|
|
|
|
|
|||
C |
H |
|
C |
H |
H |
|
|
H5C6 |
|
Br |
||||
|
|
6 |
5 |
|
|
6 |
5 |
|
|
|
|
|
|
|
8.3. Мономолекулярное элиминирование
Мономолекулярный механизм Е1 был впервые предложен Хьюзом в 1935 г. в качестве общего механизма образования олефинов. Механизм мономолекулярного элиминирования имеет ряд отличий от Е2-механизма. Основные закономерности протекания реакций по данному механизму будут рассмотрены далее.
8.3.1. Механизм реакций мономолекулярного элиминирования (Е1)
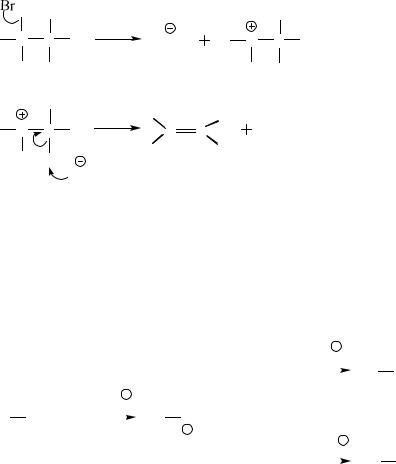
Главная особенность механизма мономолекулярного элиминирования состоит в образовании карбокатиона, в результате отрыва электрофильной группы Х вместе с парой электронов под влиянием сил сольватации, но без взаимодействия Х с реагентом, акцептором протонов; карбокатион затем отдаёт протон растворителю или другому акцептору протонов. Таким образом, реакция протекает в две стадии, из которых первая – гетеролитический разрыв связи С–Х определяет скорость реакции. Поэтому скорость всей реакции не зависит от концентрации основания. Группа Х до реакции может быть либо формально нейтральной, либо положительно заряженной и становиться в результате реакции соответственно либо отрицательно заряженной, либо нейтральной.
К настоящему времени этот механизм установлен для многих случаев образования алкенов из солей сульфония, галогенидов и эфиров сульфокислот, т.е. для следующего ряда электрофильных групп: Х = R2S+, Cl , Br ,
RO2SO .
Кинетика реакции отражает независимость Е1-реакции от наличия основания. Этот процесс характеризуется уравнением реакции первого порядка:
v = k [HCR2CH2X]
Так, например, было показано, что скорость образования изобутилена при добавлении этилата натрия в этанольный раствор изобутана почти не изменяется.
88
Механизм Е1 можно представить следующим образом:
X |
|
|
|
|
C |
C |
X |
C C |
(1) |
|
H |
|
H |
|
C |
C |
C C |
HB |
(2) |
|
H |
|
|
|
E1-Реакции конкурируют с SN1-реакциями. El-Реакции не только конку-
рируют с SN1-реакциями, они имеют одну и ту же лимитирующую стадию − образование карбокатиона. Конкуренция между SN1- и El-реакциями иллюстрируется ниже на примере реакции 2-бромпропана:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nu |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
|
CH3 |
||||||
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
SN1 |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nu |
|
|
|||||||||
CH3 |
C |
|
CH3 |
|
|
|
|
|
CH3 |
C |
|
CH |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
H |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
CH2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E1 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Константа скорости суммарной мономолекулярной реакции (k1) соответствует скорости гетеролиза субстрата:
k1 = k(SN1) + k(E1)
Однако соотношение: k(E1)/ k1 равное доле образующегося олефина, определяется долей участия карбокатиона в каждой из этих реакций.
Относительные количества продуктов замещения и отщепления почти не зависят от растворителя и от характера добавляемого основания.
Поэтому для каждого образующегося катиона относительное количество образующегося алкена должно быть приблизительно постоянным. Из данных табл. 10.4. следует, что вышеназванная закономерность реализуется довольно точно:
89
Таблица 8.4. Относительные количества образующегося алкена (в процентах)
при мономолекулярном замещении
Алкильный |
Растворитель: |
Температура, |
|
Уходящая группа |
||
радикал |
(Н2О + С2Н5ОН), |
° С |
|
|
|
|
|
% С2Н5ОН |
|
-Cl |
-Br |
-I |
-(CH3)2S+ |
|
|
|
|
|
|
|
2-октил |
60 |
100 |
13 |
14 |
− |
− |
Трет-бутил |
80 |
25 |
17 |
13 |
13 |
− |
|
60 |
65 |
36 |
− |
− |
36 |
Трет-амил |
80 |
25 |
33 |
26 |
26 |
− |
|
80 |
50 |
40 |
− |
− |
48 |
|
|
|
|
|
|
|
Из данных табл.10.4. следует, что повышение температуры приводит к увеличению выхода алкена. Увеличение выхода алкена при повышении температуры является общей чертой для всех реакций элиминирования.
8.3.2. Е1-реакции: влияние строения молекулы на скорость элиминирования
Относительное количество продукта элиминирования зависит от строения молекулы. Из данных табл. 10.4. видно, что при переходе от вторичного радикала к третичному радикалу количество продукта элиминирования возрастает. Это согласуется с устойчивостью соответствующих карбокатионов.
Практически важный пример отщепления Е1 – кислотная дегидратация первичных, вторичных или третичных спиртов. Она протекает под действием протонных кислот (серная кислота, ортофосфорная кислота, щавелевая кислота и др.) или кислот Льюиса.
В образующемся в результате протонирования ОН-группы ионе оксония связь настолько поляризована, что делается возможным мономолекулярный распад до карбокатиона и воды. Карбокатион стабилизируется превращением в алкен:
Третичный карбокатион обладает более низкой энергией, чем вторичный или первичный, поэтому тенденция к отщеплению воды уменьшается при переходе от третичных спиртов к первичным.
