
u_sem
.pdf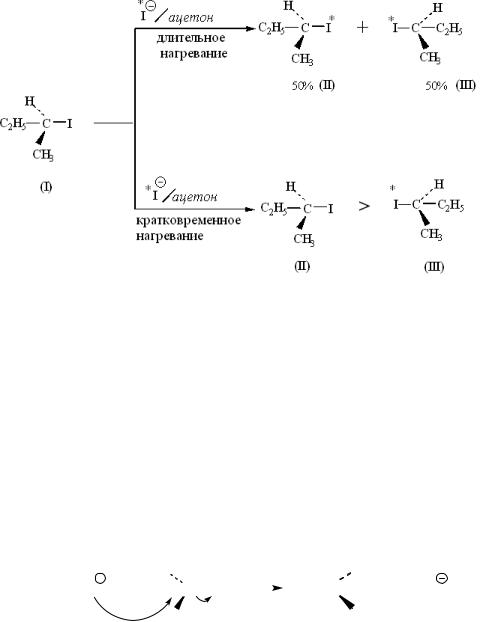
60
Никакие другие органические соединения (называемые побочными продуктами) не образуются в этой реакции.
При нагревании (+)-2-иодбутана в ацетоне, содержащем меченый иодид натрия (это означает, что молекула NaI содержит радиоактивный изотоп 131I), он частично становится радиоактивным. При кратковременном нагревании реакционной смеси радиоактивный изотоп включается только в (−)2- иодбутан:
Продолжительное нагревание этой же смеси дает рацемический продукт, в котором метка равномерно распределена между обоими энантиомерами 2-иодбутана. И, наконец, если в смеси имеется большой избыток Na*I, то после продолжительного нагревания рацемический продукт оказывается полностью меченным.
Все эти факты можно понять, если объяснить механизм взаимодействия иодид-иона с 2-иодбутаном.
В этой реакции иодид-ион атакует связь углерод–иод и вытесняет (выталкивает) атом иода, который был связан с атомом углерода. Этот атом иода уходит, забирая с собой пару электронов, осуществлявшую связь углерод −иод в исходном соединении. Таким образом, он уходит в виде иодид-иона, что показано ниже:
*I |
|
H |
|
*I |
|
|
H |
|
|
|
|||||
|
C2H5 |
|
C |
|
I |
|
|
C |
|
C2H5 |
|
|
I |
||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|||||
Более точно можно сказать, что иодид-ион атакует меньшую долю С−I- связывающей молекулярной орбитали. Поскольку в действительности атака иодид-иона представляет собой атаку одной из несвязывающих электронных пар иодида на атом углерода, можно сказать, что иодид-ион действует как
61
нуклеофил. (Нуклеофилом называется атом (или частица), который может отдать пару электронов любому элементу, иному, чем водород.) Йодид-ион,
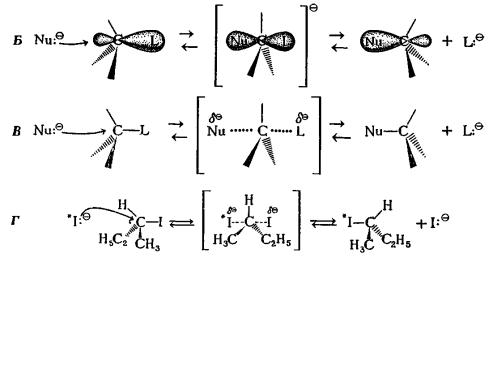
который вытесняется (замещается), называется уходящей группой. В результате реакции нуклеофил оказывается связанным с тем атомом углерода, который был связан с уходящей группой. Поскольку образование связи с нуклеофилом и разрыв связи с уходящей группой происходят одновременно, эту реакцию называют согласованным процессом. Движение пары электронов изображается изогнутой стрелкой. Переходное состояние в этой SN 2- реакции достигается тогда, когда связи двух атомов галогена с атомом углерода становятся эквивалентными.
A |
Nu |
C L |
Nu C |
L |
|
|
|
|
Рис.7.1. Механизм SN2-замещения.
Реакция начинается с атаки электронной пары нуклеофила Nu: на тыльную сторону связи углерод – уходящая группа (С–L) (обозначена изогнутой стрелкой). Атом углерода в переходном состоянии имеет форму тригональной бипирамиды. Схема А – простейший путь обозначения SN2-процесса. В схеме В можно видеть атаку электронной парой нуклеофила связи углерод уходящая группа и разрыв этой связи. Это наиболее общий способ обозначения процессов SN2. Б – перекрывание орбиталей в переходном состоянии. В – разрыв и образование связей (пунктирные линии). Г– представлена конкретная обсуждаемая реакция.
Частичное связывание между нуклеофилом, уходящей группой и атакуемым атомом обозначается пунктирной линией. В целом реакция проходит
62
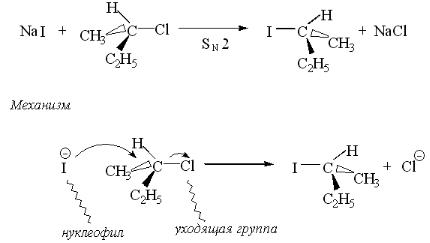
с обращением относительной конфигурации. Иногда это обращение называют вальденовским. Именно для объяснения обращения конфигурации в SN2- реакциях впервые выдвинута идея об атаке нуклеофилом с тыла. По мере приближения нуклеофила к атому углерода три связи начинают раздвигаться, пока не достигнут в переходном состоянии плоского расположения, затем по мере отхода замещаемой группы они снова занимают тетраэдрическое расположение, но противоположное исходному (схема В)
Описанная выше реакция является реакцией замещения, так как нуклеофил вытесняет уходящую группу, кроме того, она является и бимолекуляр-
ным процессом (т. е. переходное состояние образуют две частицы).
Почему в результате реакции (+)-2-иодбутаиа с иодид-ионом получается (±)-2-иодбутан, а не исключительно (–)-2-иодбутан? В начальный момент времени, когда в реакционной смеси находятся только молекулы (+)-2- иодбутана, каждый SN2-aкт ведет исключительно к молекуле (–)-2-иодбутана. Однако по мере того, как количество (+)-2-иодбутана уменьшается, количество (– )-2-иодбутана увеличивается и, следовательно, возрастает вероятность взаимодействия иодид-иона с одной из образовавшихся молекул (–)-2- иодбутана (продукт реакции). И наконец, когда в реакционной смеси окажется эквимолярное количество (+)- и (−)2-иодбутанов, взаимодействие иодидиона с (+)- и (−)-энантиомерами станет равновероятным. С этого момента и далее состав реакционной смеси будет оставаться неизменным, т. е. рацемическим.
Описанные реакции представляют собой частный случай SN2- замещения. В общем случае, когда нуклеофил и уходящая группа неодинаковы, в результате SN2-реакций действительно происходит обращение конфигурации. В реакции одного из энантиомеров 2-хлорбутана с иодидом натрия с образованием 2-иодбутана происходит полное обращение конфигурации.

63
7.3.Оценка влияния изменения условий на протекание реакции
На скорость реакций бимолекулярного нуклеофильного замещения влияют следующие факторы:
1.изменение концентрации исходных соединений,
2.строение субстрата,
3.природа растворителя,
4.реакционная способность нуклеофила.
Кинетика. На рис. 7.2 представлен энергетический профиль реакций бимолекулярного нуклеофильного замещения. Как видно из рис.7.2, стадия, на которой появляется продукт реакции, совпадает с лимитирующей (определяющей общую скорость процесса) стадией. (Это означает, что реакция является одностадийным, т. е. согласованным, процессом.)
Из кинетических измерений следует, что скорость SN2-реакции реакций прямо пропорциональна концентрациям как алкилгалогенида, так и нуклеофила:
v= k[Rhal][Х:] ,
где v − скорость реакции, к − константа скорости реакции (коэффициент пропорциональности), [Rhal] и [Z:]− молярные концентрации алкилгалогенида и нуклеофила.
Рис.7. 2. Энергетический профиль SN2-замещения.
Исходя этого уравнения, можно ожидать, что увеличение вдвое концен-
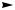
64
трации либо исходного соединения, либо нуклеофила будет увеличивать скорость реакции в 2 раза. Если же удвоить концентрации обоих компонентов, то скорость реакции увеличится в 4 раза.
Молекулярность многостадийного процесса условно определяется как число молекул, претерпевающих ковалентные изменения на лимитирующей стадии. Поэтому нет причин для совпадения молекулярности и порядка реакции, хотя это часто имеет место. Примером различия между порядком и молекулярностью является реакция псевдопервого порядка.
Если концентрация нуклеофила очень высока, то небольшие изменения его концентрации практически не окажут влияния на скорость реакции. Вместо уравнения − v= k[Rhal][Х:] − реакция будет подчиняться уравнению:
v= k[Rhal]. Этот тип реакций называют реакциями псевдопервого порядка. Например, можно ожидать, что реакции, в которых растворитель в то же время является нуклеофилом, будут подчиняться кинетике псевдопервого порядка:
CH3 |
|
I |
|
|
|
H2O |
|
CH3OH |
|
|
|
HI |
|
|
|
|
|
|
|
|
Иллюстрацией этого является гидролиз метилиодида (субстрат) в водном растворе (вода является нуклеофилом).
7.4. Влияние природы заместителей, связанных с атакуемым атомом, на реакционную способность субстрата
Так как в SN2-реакциях атаке подвергается тыльная сторона связи С − Hal, то наличие большого числа групп, связанных с атомом углерода, несущим уходящую группу, должно мешать нуклеофильной атаке. Существование стерических затруднений в SN2-peaкциях подтверждается данными, приведенными в табл. 7.3 по скорости замещения ряда алкилбромидов в 80% этаноле при температуре 55 ºС
Из данных табл. 7.3. следует, что в SN2-peaкциях реакционная способность галогеналканов уменьшается в следующем порядке: CH3X > первичный > вторичный > третичный.
SN2-peaкции протекают с высоким выходом в случае первичных субстратов (например, метилбромид) и со средним выходом − в случае вторичных субстратов (например, изопропилбромид). SN2-Peaкции осуществляются с очень низкими выходами (<1%).в случае третичных субстратов (например, R3C-Hal). В общем случае, уменьшение скорости SN2-peaкциях приводит к тому, что с основной реакцией начинают конкурировать побочные процессы
Так, например, при взаимодействии 3-хлор-3-метилпентана с иодидом натрия в ацетоне, не происходит реакции замещения хлора на иод и 3-иод-3- метилпентан не образуется. Исключением из этого правила являются реакции SN2-замещения в ряду неопентилгалогенидов. Хотя неопентильная группа и
65
является первичной алкильной группой (типа RCH2-), неопентилгалогениды в условиях осуществления реакций SN2 подвергаются замещению с очень малой скоростью.
|
|
|
|
|
|
|
|
Скорости замещения алкилбромидов |
|
|
|
|
|
|
Таблица 7.2. |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Константа скорости реак- |
Константа скоро- |
|
Относительная ско- |
||||||||||||||||||||||||||
Алкилбромид |
|
|
|
|
|
ции |
|
|
|
|
|
|
сти |
|
|
|
|
|
рость |
|||||||||||
|
|
|
второго порядка |
|
|
|
|
|
реакции |
|
|
|
в 0,01 н. NaOH |
|||||||||||||||||
|
|
|
|
|
|
л*моль*с-1 |
|
|
|
|
первого порядка |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с-1 |
|
|
|
|
|
|
|
|
||||
CH3Br |
|
|
2140 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21,4 |
||||||||||||
C2H5Br |
|
|
170 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,7 |
|||||||||||
изо-C3H7Br |
|
|
4,7 |
|
|
|
|
|
|
|
|
0,24 |
|
|
|
|
|
0,29 |
||||||||||||
трет-C4H9B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1010* 10-5 |
|
|
|
1010*10-5 |
||||||||||
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Это |
объясняется стерическими |
препятствиями для |
нуклеофильной ата- |
|||||||||||||||||||||||||||
ки, создаваемыми метильными группами неопентильного радикала: |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
S N2 |
|
|
|
CH3 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
C |
|
CH2 |
|
|
|
|
|
|
|
||
|
I |
|
|
|
CH |
|
|
C |
CH |
|
|
Cl |
|
|
|
|
|
I |
|
|
Cl |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
3 |
|
2 |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
CH2 |
|
|
CH3 |
|
|
CH2 |
|
|
|
CH3 |
|||||||
|
|
|
|
|
|
|
||||||||||||||
I |
|
C |
|
CH3 |
|
|
C |
|
CH3 |
|
|
Cl |
||||||||
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
Cl |
CH3 |
|
I |
CH3 |
||||||||||||||
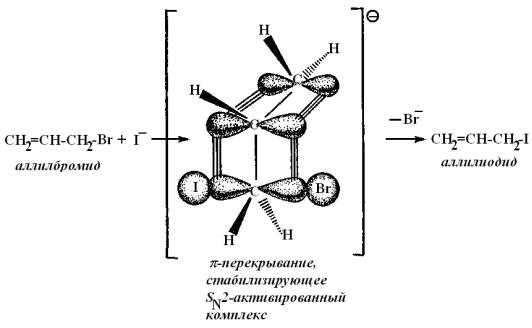
Аллилбромид СН2 = СН-СН2-Вг − первичный галогенид, реагирует несколько быстрее этилбромида и гораздо быстрее неопентилбромида.
Реакция ускоряется вследствие стабилизации переходного состояния SN2-пpoцесса (понижение энергии переходного состояния и соответственно уменьшение энергии активации процесса). Переходное состояние SN2- реакции в случае аллилбромида обладает меньшей энергией потому, что стабилизация переходного состояния в реакциях с участием аллилбромида осуществляется благодаря взаимодействию (перекрыванию) π-электронной системы с образующимися и разрывающимися в этом комплексе связями.
66
Электронные эффекты можно обнаружить в тех случаях, когда пространственные факторы остаются неизменными; однако показано, что эти эффекты сравнительно малы. Некоторые SN2-реакции немного ускоряются при наличии электронодонорных, а другие — электроноакцепторных заместителей.
Таким образом, имеется три доказательства SN2-механизма: кинетика, стереохимия и влияние строения радикала на реакционную способность.
7.5.Влияние природы растворителя на протекание SN2-реакций
Сольватация представляет собой в основном электростатическое явление. Когда ион или полярная молекула попадает в полярный растворитель, они ориентируют и притягивают молекулы растворителя, тем самым, производя электростатическую работу. В результате энергия системы понижается.
Решающее значение имеет ионизирующая сила растворителя. Ионизирующая сила растворителя зависит: а) от его диэлектрической проницаемости, т. е. от способности изолировать заряды, и б) от способности сольватировать ионы вследствие образования ион-дипольных связей.
В табл. 7.6 представлены диэлектрические проницаемости наиболее важных растворителей. Чем выше диэлектрическая проницаемость, тем больше способность растворителя изолировать заряды.
Энергия сольватации иона в полярном растворителе может быть очень большой; часто того же порядка, что и энергия ковалентной связи. Протонные растворители, в которых протон гидроксильной или амидной групп слабо экранирован, например серная кислота, вода, метанол и формамид составляют класс наиболее сильно сольватирующих растворителей. Посредством

67
образования водородных связей такие растворители сольватируют в основном анионы. Поэтому протонные растворители сильно понижают реакционную способность нуклеофилов.
Новые возможности в области синтеза и изучения механизмов реакций открылись при использовании полярных апротонных растворителей − рас-
творителей с высокой диэлектрической проницаемостью, но не способных к образованию водородных связей.
Там, где в свое время этанол, диоксан, водный спирт и ацетон являлись традиционными растворителями для SN2-реакций, сейчас доминирующее значение имеют диметилсульфоксид (ДМСО), сульфолан, гексаметилфосфотриамид (ГМФТ) и диметилформамид.
Преимущество апротонных растворителей можно увидеть на примере превращения 1,3-дихлорпропана в 1,3-дицианпропан, протекающего по SN2- мexaнизму: скорость этой реакции в ДМСО примерно в 1000 раз больше, чем в водном этаноле.
|
Свойства некоторых растворителей |
Таблица 7.3. |
|
|
|
||
|
|
|
|
|
|
Диэлектрическая |
Температура |
Растворитель |
Формула |
проницаемость |
кипения, °С |
|
|
|
|
Вода |
H2O |
80 |
100 |
Муравьиная кислота |
HCO2H |
59 |
100 |
Диметилсульфоксид |
(CH3)2SO |
45 |
189 |
N,N-диметилформамид |
(CH3)2NCHO |
38 |
153 |
Ацетон |
(CH3)2CO |
25 |
57 |
Этанол |
C2H5OH |
24 |
79 |
Уксусная кислота |
(CH3)CO2H |
6 |
118 |
Диэтиловый эфир |
(C2H5)2O |
4 |
35 |
Бензол |
C6H6 |
3 |
80 |
Диоксан |
O(CH2CH2)2O |
2 |
101 |
|
|
|
|

68
Вреакциях SN2 влияние растворителя зависит от того, к какому из четырёх (I – IV) зарядовых типов принадлежит реакция, табл. 7.7.
Для типов I и IV первоначальный заряд делокализуется в переходном состоянии, поэтому полярные растворители ещё более затрудняют эту реакцию. Для типа III в переходном состоянии первоначальные заряды уменьшаются, поэтому полярные растворители ещё более затрудняют реакцию. И только реакции типа II, реагенты в которых не заряжены, а заряд возникает в переходном состоянии, ускоряются в полярных растворителях.
Например, увеличение полярности растворителя несколько понижает скорость обмена галоген − галоген (реакция Финкельштейна). Чтобы объяснить этот факт, следует оценить влияние растворителя, как на исходное соединение, так и на переходное состояние.
Висходном соединении имеется полный отрицательный заряд, локализованный на анионе, и этот заряд стабилизируется в значительной мере взаимодействием с растворителем.
|
|
|
Таблица 7.4. |
|
|
Переходное состояние в SN2-реакциях четырёх типов |
|||
|
|
|
|
|
|
|
Заряд в переходных |
|
|
Реакции |
Реагент и переходное |
состояниях |
Влияние увеличения |
|
|
состояние |
в сравнении |
полярности растворителя |
|
|
|
с исходными соедине- |
на скорость реакции |
|
|
|
ниями |
|
|
SN2 |
Тип I |
Распределён |
Наибольшее снижение |
|
|
R-X + Y→ Y δ…R…X δ |
|
|
|
SN2 |
Тип II |
Повышен |
Большое увеличение |
|
|
R-X + Y → Y+δ… R…X δ |
|
|
|
SN2 |
Тип III |
Понижен |
Большое снижение |
|
|
R-X+ + Y → Y δ …R…X+δ |
|
|
|
SN2 |
Тип IV |
Распределён |
Небольшое снижение |
|
|
R-X+ + Y → Y+δ …R …X+δ |
|
|
|
SN1 |
R-X → R+δ… X δ |
Повышен |
Большое увеличение |
|
|
|
|
|
|
SN1 |
R-X+→ R+δ … X+δ |
Распределён |
Небольшое снижение |
|
|
|
|
|
|
С другой стороны, в переходном состоянии отрицательный заряд распределен между обоими атомами галогенов, рис. 7.4. По этой причине взаимодействие с растворителем оказывает неодинаковое стабилизирующее влияние на переходное состояние и на исходное соединение

69
Рис. 7. 3. Влияние полярности растворителя на SN2-процесс обмена галогена на галоген. (----) Более полярный растворитель; ( ▬ ) менее полярный растворитель.
Повышение полярности растворителя стабилизирует переходное состояние в меньшей степени, чем исходное соединение и продукты реакции, поэтому увеличивается разность энергий исходного вещества и переходного состояния и, следовательно, энергия активации. Результатом этого является уменьшение скорости реакции. Поэтому увеличение полярности растворителя приводит для этого типа реакций SN2 к увеличению энергии активации и небольшому уменьшению скорости реакции.
7.6. Реакционная способность нуклеофилов и скорость SN2-реакций
Термин «нуклеофильность» принято относить к влиянию основания Льюиса на скорость реакции нуклеофильного замещения. Относительная нук-
леофильность различных частиц может меняться от реакции к реакции, поэтому невозможно составить абсолютную шкалу нуклеофильностей. Факторы, влияющие на нуклеофильность, оценены многими исследователями, обычно в связи с предельным случаем SN2-реакций, так как именно здесь свойства нуклеофила особенно очевидны. Наиболее важными характеристиками, влияющими на нуклеофильность, являются: а) энергия сольватации нуклеофила, б) его эффективный объём, в) электроотрицательность атакующего атома, г) поляризуемость атакующего атома.
Более объёмистый нуклеофил, имеющий больший объем, менее реакционноспособен, по сравнению с небольшим по объёму нуклеофилами, так
