
u_sem
.pdf10
Изменение в строении органических молекул, приводящее к изменениям в их реакционной способности, связано с тем, что имеющиеся в молекуле группировки взаимодействуют друг с другом. Это взаимодействие приводит к изменениям в распределении электронной плотности в молекуле, меняет ее геометрическое строение, что неизбежно будет сказываться на ее физических и химических свойствах. Необходимость учета этих различий привело к созданию теории взаимного влияния атомов в молекулах органических соединениях.
Впервые взаимное влияние атомов было обнаружено в молекулах алкенов и галогенопроизводных.
Способность заместителей передавать свое влияние по цепи ковалентно связанных атомов является одним из характерных свойств органических соединений. При этом заместитель также испытывает на себе влияние остатка молекулы, к которому он присоединен, поэтому, состояние заместителя зависит от природы окружающих его атомов и от структуры остатка молекулы.
Передача влияния заместителя по линии σ- и π-связей приводит к изменению электронного состояния этих связей. Характер поляризации связи при этом оказывается зависящим от ее типа.
Если влияние заместителя передается за счет последовательной поляризации σ-связей, то такая поляризация называется индуктивной, а заместитель проявляет индуктивный эффект (I-эффект). Если заместитель имеет положительно или отрицательно заряженные атомы, то вокруг них создается электрическое поле, которое действует не только по линии связей, но и непосредственно через пространство по законам электростатики: в этом случае сила воздействия заместителя на другие атомы зависит от конфигурации и конформации молекулы. Аналогично действуют и заместители, образующие сильнополярные связи С–Х. Такое влияние заместителя называется эффектом поля (F-эффект). Если в цепи имеется система сопряженных кратных связей либо заместитель находится при кратной связи или ароматическом ядре, то передача влияния, проходящая по системе π- связей, либо передача влияния путем перекрывания π-систем со свободными электронными парами описывается при помощи эффекта сопряжения заместителя (С- или М- эффект).
Под поляризацией молекулы понимают перераспределение электронной плотности под действием электростатических сил, при котором происходит частичное разделение «центров тяжести» положительного и отрицательного зарядов. При этом к поляризации более склонны малополярные частицы (имеющие низкие электрические моменты диполей).
Заместители, которые могут увеличивать электронную плотность в остальной части молекулы, называются электронодонорами, заместители, которые могут уменьшать электронную плотность, являются электроноакцепто-
рами.

11
При смене заместителей одновременно с изменением поляризации молекулы могут возникнуть стерические взаимодействия между введенным заместителем и остальными атомами молекулы. Эти взаимодействия зависят от объема и радиуса действия атомов (Ван-дер-ваальсовы радиусы). В результате этих взаимодействий может измениться конформация молекулы, что, в свою очередь, будет влиять на электронное состояние связей. В массе, особенно в растворах, отдельные молекулы одного и того же соединения, сохраняя неизменной одну и ту же последовательность атомов, могут иметь несколько изменяющееся при изменении конформации молекулы распределение электронной плотности.
Электронное состояние молекулы в растворе зависит от растворителя (поляризующего молекулы растворенного вещества, образуя с ним разного рода сольваты), что легко обнаруживается путем изменения дипольных моментов одного и того же соединения в различных растворителях. Примером этому служат значения дипольного момента дихлорэтана в различных растворителях, так в бензоле он составляет 1,88 Д, а в циклогексане – 1,56 Д.
2.2. Эффект поля и индуктивный эффект
Индуктивный эффект заместителей и эффект поля на близком расстоянии нельзя отделять друг от друга, и определение относительного вклада этих двух эффектов затруднительно. Влияние заместителей на атомы, находящиеся на более далеком расстоянии (в 1,3-положении и далее), в основном сводится к влиянию через пространство. Таким образом, эффект поля является более общим эффектом, чем индуктивный эффект. Обычно оба эффекта рассматриваются совместно, их общее влияние объединяют под названием
«полярный эффект».
Под индуктивным эффектом подразумевается поляризация связи по системе σ-связей. Принято различать положительный или отрицательный индуктивный эффект. В качестве стандарта для индуктивного эффекта (+ или − I-эффекта) выбирают углеводороды, условно приравнивая в них нулю дипольный момент С–Н связи. Замена водородного атома другим заместителем ведет к получению полярного соединения, в котором в зависимости от различий в электроотрицательности отрицательным концом диполя может оказаться либо алкильный остаток, либо заместитель. Знак индукционного эффекта принято определять по заряду, который приобретает заместитель:
|
|
|
|
|
||||
X |
|
CR3 |
H |
|
CR3 |
Y |
|
CR3 |
|
|
|
||||||
|
−I – эффект |
стандарт, I = 0 |
+ I – эффект. |
|||||
Смещение электронной плотности под действием индуктивного эффекта графически изображают с помощью стрелок (→). Стрелки обозначают по-
12
ляризацию ковалентной связи со смещением электронной плотности в направлении, указываемом стрелкой. Индуктивный эффект характеризуется следующими качественными особенностями:
а) сила индуктивного эффекта возрастает с ростом заряда (или частичного заряда) заместителя и быстро убывает с расстоянием, так как заряд, возникающий при поляризации связей на атоме, возбуждает на соседних атомах меньшие заряды. В итоге, например, в пропилхлориде имеется приближенно следующее изменение состояния заряженности атомов, по сравнению с
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
H ''' + |
H '' + |
H ' + |
|
|
|
|
|
|
|
|||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
' + '' |
+ |
|
''' + |
||||
|
|
|
|
C |
|
C |
|
|
|
C |
|
Cl |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
H |
H |
|
|
H |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
заряженностью в пропане.
б) ионные заместители создают более дальнодействующие поля, чем дипольные группы; положительно заряженные группы (например, NR3+) притягивают электроны и являются сильными −I- заместителями; отрицательно заряженные группы (например, О −) притягивают положительные заряды (т.е. отталкивают электроны) и являются сильными +I-заместителями.
г) заместители обладают тем большим −I- эффектом, чем правее в группе периодической системы находится соответствующий элемент.
д) все без исключения ненасыщенные углеродные группировки проявляют −I- эффект, возрастающий в ряду: изолированная двойная связь, сопряженная двойная связь, кумулированная двойная связь (и тройная связь). Это можно считать следствием возрастания доли s-компоненты в sp2- и spгибридных состояниях, в результате чего углеродный атом приобретает большую электроотрицательность. Другие ненасыщенные группы также обладают сильным −I-эффектом, в особенности, если их двойные связи имеют семиполярный характер (нитрогруппа, карбонильная группа и др.)
Экспериментальной количественной характеристикой индуктивного эффекта могут служить, например, данные о химических сдвигах сигналов протонов в спектрах ПМР. Так, в молекуле СН3Х относительное значение положительного заряда, возникающего на атомах углерода и водорода при смене заместителя Х, и, соответственно, отрицательный индуктивный эффект тем больше, чем в более слабое поле смещен сигнал, тем сильнее дезэкранировано ядро, т. е. тем более оттянуты с него валентные электроны.
В настоящее время под эффектом поля (F-эффектом) понимается воздействие статического электрического заряда ионизированных атомов, вхо-

13
дящих в состав молекулы, или больших дробных зарядов диполей поляризованных σ, π-связей на соседние атомы или близлежащие атомы той же молекулярной частицы.
Число известных соединений подобной структуры бесконечно велико. Под влиянием электрического поля точечных носителей заряда соседние химические связи поляризуются, в результате чего изменяются химические свойства связанных атомов и атомных групп, находящихся в непосредственной близости от источника заряда. При этом F-эффект обладает значительно большим дальнодействием, чем ковалентный I-эффект. Влияние электрического заряда распространяется до 3 нм. Примером могут быть молекулы с семиполярной связь, такие как диметилсульфоксид, оксид триэтиламина или молекулы с полным разделением заряда за счёт сильных внутримолекулярных кислотно-основных взаимодействий, например, α-аминокислоты, или соли арилдиазония .
2.3. Эффект сопряжения.
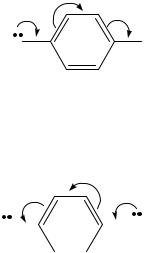
Эффект сопряжения (C- или М-эффект) проявляется в тех случаях, когда заместитель имеет π-связи, p-электроны или вакантную низко лежащую орбиталь (атомы бора, кремния или положительно заряженный атом углерода) и находится при атоме углерода в состоянии sp2- или sp-гибридизации (при атоме углерода с двойной или тройной связью либо при ароматическом ядре). При таком сочетании структуры заместителя и основной части молекулы происходит перекрывании p- или π-орбиталей заместителя с орбиталями углеродных связей цепи или ароматического кольца. В результате заместитель оказывается связанным с остатком молекулы кроме обычной σ-связи дополнительно посредством небольшого π-электронного облака; p-электроны или π-связи заместителя оказываются сопряженными с π-связями остатка молекулы . Графически смещение электронной плотности под действием эффекта сопряжения изображается с помощью изогнутых стрелок. Начало стрелки указывает, какие n-, p- или π-электроны смещаются, а в конце стрелки – связь или атом, к которому они смещаются. В отличие от индуктивного эффекта, когда происходит лишь изменение полярности σ- или π-связи, при сопряжении электронное облако частично смещается в область соседней σ- связи. Если в сопряжении принимают участие только атомы второго периода, то смещение электронов не может приводить к увеличению электронной плотности сверх восьми электронов (электронный октет не может быть нарушен). В связи с этим дозволено только смещение, указанное стрелками в
Так как в литературе в соответствии с концепциями мезомерии и резонанса для изображения этих соединений используют набор резонансных (мезомерных структур), эффект, проявляемый заместителем, называют также мезомерным или резонансным. В дальнейшем для обозначения этого эффекта будет использоваться символ «M».

14
представленной ниже схеме, любое встречное смещение привело бы к нарушению октета. Если в сопряжении участвуют атомы третьего и выше периодов, то, так как на их внешней оболочке может быть 18 электронов, они могут иметь электроны дополнительно к октету:
CH2 = CH |
|
CH = O |
CH3 |
O |
|
CH = CH2 |
|
|
Принято считать положительным такой эффект сопряжения, при котором заместитель подает электроны в цепь (+M-эффект), а отрицательным - если заместитель оттягивает электроны (–M-эффект). +M-Эффект проявляют все атомы, имеющие неподеленные электронные пары, причем внутри второго периода он тем больше, чем меньше заряд ядра соответствующего атома2. Поэтому +M-эффект атомов изменяется в следующем порядке: N > O > F.. +M-Эффект проявляют отрицательно заряженные атомы; их эффект также тем больше, чем меньше заряд ядра, и больше тех же атомов в незаряженном состоянии.
При переходе вниз внутри одной и той же группы +M-эффект падает, что объясняют большей выгодностью перекрывания близких по размерам орбиталей. Вследствие этого 2p-орбитали лучше перекрываются также с 2p- орбиталями, хуже с 3p-орбиталями и еще хуже с 4p-орбиталями.
–M- Эффект проявляют заместители, имеющие вакантную низко лежащую орбиталь (бор, С+), и заместители, имеющие π-связи между атомами с разной электроотрицательностью, если при этом группа присоединена к остатку молекулы менее электроотрицательным атомом, например:
C |
|
O, |
|
C |
|
N, |
C |
|
NH, |
|
NO2 |
|
|
|
|
|
|||||||
|
|
Вследствие сдвига электронов в сторону более электроотрицательного атома менее электроотрицательный атом имеет дефицит электронов, т. е. он заряжен положительно. Следует ожидать, что чем больше разность электроотрицательностей, тем больше −M-эффект заместителя.
Группы, имеющие связи между одинаковыми атомами, такие как:
C O ; N
O ; N N ; C
N ; C C
C
являются проводниками эффектов сопряжения обоих знаков.
Смещение электронов обычно незначительно, и длины связей практически не изменены. О незначительности смещения электронной плотности судят по дипольным моментам. Даже в случае относительно больших эффек-
2 +M-эффект также проявляют алкильные группы
15
тов сопряжения частичные заряды невелики и составляют максимум 0,25 заряда электрона. Если в системе сопряженных связей на концах имеются атомы с целым положительным или отрицательным зарядом, то, поскольку эффекты сопряжения таких заместителей очень большие, может происходить выравнивание состояний связей, и получается соединение с примерно полуторными связями; например, в аллильном катионе или анионе заряды распределены практически полностью между двумя крайними атомами:
|
|
|
|
|
|
_ |
- |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
1 |
||||
H2C |
|
|
CH |
|
CH2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
||||||
|
|
|
или H2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
+ |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
1 |
|
||||||||
|
|
|
|
|
|
+ |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||||||||||
H2C |
|
|
CH |
CH2 |
или H2C |
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
CH2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Для экспериментального доказательства существования эффекта сопряжения и его относительной силы обычно сопоставляют значение дипольных моментов соединений, в которых заместитель Х стоит при бензольном ядре, и таких, в которых эффект сопряжения заместителя Х проявиться не может, например, производных метана. В табл. 2.2 приведены дипольные моменты соединения С6Н5Х и СН3Х (в газообразном состоянии).
Разность значений дипольных моментов ∆μ со знаком (+) или (-) указывает на знак эффекта сопряжения и качественно свидетельствует о силе проявляемого эффекта сопряжения: поскольку дипольный момент связи C – Cl в хлорбензоле имеет то же направление, что и в метилхлориде (от С к Cl), можно заключить, что в хлорбензоле электроны σ-связей в большей степени смещены в сторону хлора, чем p -электроны хлора в сторону бензольного ядра (вследствие сопряжения).
Таблица 2.2.
Значения дипольных моментов производных бензола и метана
X |
F |
Cl |
Br |
CN |
NO2 |
|
|
|
|
|
|
μ(C6H5X), |
-1,57 |
-1,69 |
-1,64 |
-4,39 |
-3,54 |
D |
|
|
|
|
|
μ(CH3X), |
-1,81 |
-1,86 |
-1,78 |
-3,94 |
-4,23 |
D |
|
|
|
|
|
∆μ,D |
+0,24 |
+0,17 |
+0,07 |
-0,45 |
-0,69 |
|
|
|
|
|
Таким образом, атом хлора, стоящий при ароматическом ядре, проявляет в большей степени отрицательный индуктивный эффект, чем положительный эффект сопряжения.

16
Если при одинаковом направлении дипольного момента переход от алифатического соединения к ароматическому приводит к увеличению дипольного момента ( например, дипольный момент нитробензола больше дипольного момента нитрометана), то π-электронное облако смещается в ту же сторону, что и электроны σ-связей. Благодаря проявлению эффекта сопряжения электроны оказываются больше сдвинутыми в сторону замещающей группы, чем при проявлении ею только одного индуктивного эффекта.
По убыванию проявляемого ими эффекта сопряжения заместители можно поставить в следующий ряд:
+М-эффект: (CH3)3N > CH3O > F > Cl > Br >I; _ М-эффект:NO2 > CN.
Эффект сопряжения в наибольшей степени проявляется в том случае, когда перекрывание p- или π-орбиталей максимально, условием чего является копланарность осей p-орбиталей, участвующих в сопряжении. Поскольку величина перекрывания пропорциональна косинусу угла между осями орбиталей, сопряжение отсутствует, если плоскости кратных связей или ароматических ядер находятся под углом 90˚.
Отсутствие копланарности может быть вызвано стерическими причинами. Так, при введении двух метильных групп в орто-, орто-положения N,N-диметиланилина происходит увеличение угла между осью орбитали неподеленной пары электронов и осями p-электронов бензольного ядра от 31º 39´ до 61º 55´. Это приводит к значительному уменьшению дипольного момента. Аналогично влияет на дипольный момент молекулы введение метильных групп в орто-положение по отношению к нитрогруппе.
CH3
NO2 D |
H3C |
|
|
|
|
|
NO2 D |
|
|
|
|
||||
|
|
|
|
|
|
|
|
CH3
Степень проявления эффекта сопряжения зависит от наличия других заместителей в сопряженном положении, т. е. в том положении, при котором эффект одного заместителя передается на атом с находящимся около него вторым заместителем. Если оба заместителя имеют эффекты сопряжения разных знаков, то эффект каждого усиливается, если же эффекты сопряжения заместителей одного знака, то эффект каждого ослабляется.
Электронные эффекты групп могут зависеть от растворителя, их увеличение или уменьшение связано с природой заместителя.
Эффект сопряжения падает с расстоянием и, если в сопряжении не участвуют вакантные орбитали или отрицательно заряженные атомы, то он затухает примерно через три двойные связи.

17
Если в молекуле между С-акцепторными группами находится атом с неподеленной электронной парой или имеется скрещенная система, то происходит «рассеивание» М-эффектов атома или группы, являющихся общими для обеих сопряженных систем. Например, в случае эфира n-аминобензойной кислоты происходит рассеивание влияния углеродного атома карбонильной группы; при этом влияние группы С=О на этоксильную и аминофенильную группы оказывается уменьшенным по сравнению с тем действием, которое оказывала группа С=О на каждую из названных групп при отсутствии другой:
 O
O
H2N |
C |
OC2H5
Если две группы находятся в одной системе сопряженных связей на более далеком расстоянии друг от друга, то степень их взаимодействия зависит от силы проявляемых ими эффектов, расстояния между группами и от природы фрагментов молекулы, через которые происходит передача влияния (мостиковых групп). Обычно введение таких групп приводит к ослаблению эффекта заместителя, однако, если в качестве мостиковой группы выступает атом с неподеленной парой электронов, передача влияния может увеличиваться (положительный мостиковый эффект).
Эффекты сопряжения атомов элементов третьего периода. Атомы элементов третьего периода, стоящие правее кремния, – фосфор, сера и хлор – могут проявлять эффекты сопряжения двух знаков: +М-эффект при наличии у них неподеленных электронных пар и –М-эффект, вследствие вовлечения в сопряжение d-орбиталей. Способность проявлять +М-эффект уменьшается в следующем ряду: RS > Cl > > R2P.
Предполагается, что такая последовательность, а также меньшая способность к проявлению эффекта сопряжения по сравнению с элементами второго периода обусловлены значительной долей s-орбитали в гибридных орбиталях неподеленных электронных пар этих элементов, особенно у атома трехвалентного фосфора.
Атомы серы проявляют как +M-, так и –M-эффект в зависимости от заместителей, имеющихся в той же молекуле в сопряженном положении. Так, при введении в параположение тиоанизола NO2-группы, атом серы проявляет +М-эффект, причем эффекты обеих групп (СН3 и NO2) усиливается по срав-
Скрещенной системой сопряжения кратных связей называется такая система связей, когда одна кратная связь с одной и той же стороны сопряжена с двумя кратными связями; схематически это можно изобразить следующим образом:
18
нению с их действием в отсутствие второго заместителя, что видно из сопоставления вычисленных по правилу аддитивности и экспериментально найденных значений дипольных моментов:
|
Вычислено: D. |
H3CS |
NO2 Найдено: D |
При введении в параположение тиоанизола электронодонорной группы (СН3)3N сера проявляет –M-эффект, причем и в этом случае эффекты обоих заместителей усиливаются:
H3CS |
|
|
|
|
|
|
|
N(CH3)3 |
Вычислено: D. |
|
|
|
|
|
|
|
Найдено: D |
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В первом случае сопряжение обусловлено участием неподеленной электронной пары атома серы (2pπ - 3 pπ-взаимодействием), во втором случае атом серы представляет при сопряжении вакантные d-орбитали (2pπ – 3d- взаимодействие). В отсутствие электронодонорной группы с большим +I- эффектом последний вид сопряжения либо совсем не проявляется, либо имеет лишь небольшое значение.
Проявлением 2pπ - 3pπ-сопряжения объясняют большую силу n- триметилсилил-бензойной кислоты по сравнению с n-трет-бутилбензойной кислотой.
Если бы 2pπ - 3pπ-эффект не проявлялся, то следовало бы ожидать, что в силу меньшей электроотрицательности кремния по сравнению с углеродом (1,8 и 2,5 соответственно) n-триметилсилилбензойная кислота должна была бы слабее, чем n-трет-бутилбензойная кислота.
2.4. Эффект сверхсопряжения
При изучении относительной устойчивости олефинов путем определения теплоты гидрирования оказалось, что алкилзамещенные этилены имеют меньший запас энергии, чем этилен, хотя, казалось бы, под действием +I- эффекта метильной группы результат должен быть обратным – двойная связь должна принимать электроны тем легче, чем меньше ее электронная плотность.
Опытные данные о гидрировании соответствуют ряду электронодонорности алкильных заместителей: Н < высший алкил < CH3,
в то время как +I-эффект растет в ряду: Н < CH3 < высший алкил.
19
Ряд индуктивных эффектов нарушается также при сопоставлении данных о многих других химических реакциях. Например, при изучении Беккером и Натаном влияния алкильных групп на кинетику взаимодействия n- алкилбензилхлоридов с пиридином и на гидролиз n-алкилбензилхлоридов неожиданно было обнаружено, что электронодонорные свойства алкильных групп имеют ряд, обратный изменению индуктивных эффектов указанных групп: CH3 > C2H5 > изо-C3H7 > трет-C4H9 > H. Оказывается, что в таком же порядке располагаются алкильные группы по их влиянию на константы диссоциации n-алкилбензойных кислот. Этот эффект называют эффектом Ната- на–Беккера.
Для объяснения наблюдаемых фактов было высказано два предположения. По мнению Малликена эффект Натана -Беккера объясняется тем, что обычное π, π-сопряжение дополняется еще сопряжением между π- электронами и σ-электронами: этот эффект он назвал сверхсопряжением (гиперконъюгация, σ, π-сопряжение). Согласно Малликену в метильной группе толуола на нормальное тетраэдрическое состояние с σ-связями налагается второе, в котором углерод находится в тригональном состоянии sp2 – гибридизации и имеет, следовательно, p-орбиталь. Эта последняя при копланарности с π-орбиталями ароматического ядра может вступать с ними в сопряжение, вызывающее понижение энергии молекулы. Вычисленное понижение составляет лишь 1,5 ккал/моль по сравнению с чистым sp3-состоянием.
Способность к сверхсопряжению приписываются прежде всего С __Н- связям, поскольку в основе расчета лежит допущение, что с протонами из-за их малой величины можно оперировать так же, как с электронами. Важным аргументом в защиту сверхсопряжения считают укорочение связи между алкильной группой и ненасыщенной системой. Однако тот факт, что это укорочение не зависит от числа водородных атомов и от типа π-системы, говорит, скорее, против сверхсопряжения и лучше объясняется изменениями в гибридизации.
Сверхсопряжение часто привлекают для объяснения стабилизации карбониевых ионов и свободных радикалов, что для радикалов согласуется с расчетами по методу молекулярных орбиталей.
В свете концепции сверсопряжения устойчивость третичных, вторичных и первичных радикалов объясняется делокализацией неспаренного электрона в результате перекрывания p-орбитали, занимаемой неспаренным электроном, и σ-орбитали алкильной группы. В результате этого перекрывания три электрона – неспаренный и пара электронов связи углерод – водород помогают в какой-то степени удерживать вместе три ядра: два атома углерода и один атом водорода:
