
u_sem
.pdf
20
H H
1e 
 C C
C C
 C C
C C
Известно, что этот вклад стабилизирует этильный радикал на 5 ккал/моль больше по сравнению с метильным. Если распространить этот подход на изопропильный радикал, то он стабилизирован на 11 ккал/моль больше по сравнению с метильным.
2.5. Эффект обратного сверхсопряжения
При изучении свойств перфторалканов был обнаружен ряд необычных свойств, в частности, меньшая длина связи C __ F в них и большая энергия ее образования по сравнению с обычными C __ F-связями. Объяснение этих отклонений встречает затруднение при допущении только двух эффектов у атома фтора – сильного отрицательного индуктивного эффекта, обусловленного его наибольшей из всех элементов электроотрицательностью, и значительного положительного эффекта сопряжения. Для такого влияния перфторалкильных групп были предложены следующие названия: гиперконъюгация фтора и обратная гиперконьгация фтора. Последнее название указывает на обратное направление электронов по сравнению с обычной гиперконъюгацией при участии атомов водорода:
|
H |
|
|
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
H |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
С+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H |
|
|
С |
|
|
|
|
|
H |
|
|
С |
|
|
С |
или H |
|
|
С |
|
|
С+ |
|||||||
H |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F- |
|
|
|
|
|
|
|
|
|
||||||
|
|
F |
|
|
|
|
|
С- |
|
|
|
|
|
|
-С |
|
|
F |
|
|
|
|
|
С- |
|||||
F |
|
|
С |
|
|
|
|
|
F |
|
|
С |
|
|
или F |
|
|
С |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
F |
|
|
|
|
|
|
||||
Для доказательства обратной гиперконъюгации был использован метод дипольных моментов. Обнаружено, что разность дипольных моментов СН3СF3 (2,32 D) и C6H5CF3 (2,61 D) отрицательна. Это указывает на наличие сильного смещения электронов в сторону заместителя, которое можно объяснить обратной гиперконъюгацией. В дизамещенных производных бензола также имеется существенное различие между вычисленным и найденным значениями дипольного момента:
21
(H3C)2N |
|
|
|
|
|
|
|
CF3 |
Вычислено: D. |
|
|
|
|
|
|
|
Найдено: D. |
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.6. Теория резонанса
Для некоторых молекул и ионов возможно изображение нескольких структур, в которых распределение электронов различно, но каждое из них хорошо удовлетворяет правилу октетной теории Льюиса. Классическим примером служит нитрит-ион NO2 , для которого возможны два полностью приемлемых способа изображения распределения электронов.
 O N O
O N O  O N O
O N O 
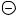
Ни один из данных способов изображения не отвечает распределению электронов в реальном ионе. В реальном нитрит-ионе распределение элек-
тронов является промежуточным. Структура соответствующая такому распределению имеет половину отрицательного заряда на одном атоме кислорода и половину – на другом и содержит две одинаковые связи азот − кислород. Эти связи не являются ни простыми, ни двойными, а промежуточными между ними. Электрон или заряд может быть «здесь» или «там», но как можно изобразить их «наполовину здесь» и «наполовину там»?
Для решения этой проблемы химики разработали концепцию резонан-
са. В своём простейшем виде она гласит, что если для соединения мы можем изобразить две или больше приемлемые структуры, то реальное распределение электронов не соответствует ни одной из них, а представляет нечто промежуточное между ними. Реальную молекулу называют резонансным гибридом структур, которые могут быть изображены, но сами по себе в действительности не существуют. Такие гипотетические структуры называют резонансными структурами. Энергия реальной молекулы меньше, чем энергия любой из резонансных структур. Принято резонансные структуры для одной реальной молекулы связывать стрелкой ↔ .
В органической химии существует очень много молекул и ионов, которые можно изобразить несколькими резонансными структурами. Так молекулу бензола можно изобразить резонансными структурами I – V.
22
I |
II |
III |
IV |
V |
Структуры III − V наряду со структурами Кекуле также представляют возможные способы распределения электронов в плоском шестиугольном остове молекулы. Очевидно, что эти три структуры энергетически менее выгодны чем структуры Кекуле., так как атомы С1 и С4 также как и атомы С2 – С5 или атомы С3 – С6 отстоят слишком далеко друг от друга (› 2 А˚) для эффективного образования связей.
При использовании метода резонанса необходимо иметь в виду, что величина вклада, вносимого каждой из набора резонансных структур, должна отвечать степени образования связи, которая осуществлялась бы в том случае, в каком данной структуре соответствовала бы реальная молекула со своей геометрией. Так в случае бензола две структуры Кекуле вносят равный и преимущественный вклад в гибридную структуру бензола. Отсюда следует, что структуры III − V практически могут игнорироваться при рассмотрении свойств нормального состояния реальной молекулы бензола.
При использовании метода резонанса предполагают, что пространственное расположение атомов для всех резонансных структур данного резонансного гибрида совершенно одинаково, но схемы распределения электронов различны.
Существуют определённые правила, устанавливающие, насколько важен вклад той или иной структуры в описание резонансного гибрида.
1.Все структуры, вклады которых существенны, должны располагать одинаковым (наименьшим числом) неспаренных электронов. Согласно этому правилу об истинных свойствах бензола нельзя судить по структурам III − V
2.Чем больше степень разделения зарядов в резонансной структуре, тем меньше значение этой структуры в описании резонансного гибрида.
3.Электронная стабилизация будет наибольшей, в том случае, когда имеется две (или большее число) эквивалентных структур, обладающих наинизшей энергией.
4.Если имеется одна структура с низкой энергией, то в первом приближении можно ожидать, что свойства резонансного гибрида будут подобны свойствам этой структуры.
5.В различных резонансных структурах положение всех атомов должно быть одинаковым. Резонансные структуры могут отличаться только распределением электронов.
23
Несмотря на искусственность концепции резонанса, она чрезвычайно полезна для обобщения фактического материала органической химии. В отсутствии строгого математического решения о характере распределения электронной плотности в молекуле, этот метод позволяет распространить идеи теории валентности на соединения, подобные бензолу, приближённо описывая реальную молекулу с помощью всех валентных схем.
3. ТИПЫ РЕАКЦИЙ И КЛАССИФИКАЦИЯ РЕАГЕНТОВ.
Под влиянием атакующего реагента или под действием среды связь в молекуле органического соединения (субстрата) может разорваться по одному из двух возможных типов.
По первому – пара электронов, образующая ковалентную связь, уходит с одним из фрагментов: происходит, так называемый, гетеролиз связи:
А─В → А+ + В По второму типу образующиеся фрагменты получают по одному элек-
трону связи. Механизм разрыва связи носит название гомолиз связи :
А─В → А• + В•
Имеется третий тип механизма, по которому электроны движутся по замкнутому кольцу. В этих реакциях не образуются промежуточные частицы (интермедиаты) – катионы, анионы, радикалы. Разрыв старой связи и образование новой происходит синхронно. Такие реакции называются перицикличе-
скими.
Важно помнить, что реакционная способность органического соединения (субстрата) никогда не рассматривается изолированно от реакционной способности реагента. Отсюда в основу классификации органических реакций положены следующие характеристические признаки:
1.механизм раскрытия связей;
2.характер действующего реагента;
3.результат реакции;
4.молекулярность лимитирующей стадии реакции в механизме её протекания.
3.1. Классификация реакций
По механизму раскрытия связей и характеру действующего реагента все реакции можно разделить на следующие типы:
а) гетеролитические: нуклеофильные, электрофильные.

24
б)гомолитические: радикальные
в) молекулярные
По результату реакции делятся на реакции:
а) присоединения б) замещения
в) отщепления (элиминирования)
Реакции присоединения обозначаются символом «А» (от англ. Addition) Присоединение реагента происходит по кратным связям и включает:
а) реакции радикального присоединения АR
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
+Y |
|
|
R |
|
Y |
|||
C |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
+ R |
|
|
|
C |
|
C |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
C |
|
C |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) реакции электрофильного присоединения АЕ
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
+Y |
|
|
|
|
|
E |
|
Y |
||
C |
|
C |
|
+ E |
|
Y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|
|
C |
|
C |
|||||||||||||
|
|
|
-Y |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
в) реакции нуклеофильного присоединения АN
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Y |
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
Y |
||||
C |
|
C |
|
+ E |
|
Y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|
C |
|
C |
|||||||||||||||||
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Реакции замещения обозначают символом «S» (от англ. Substitution). Они подразделяются на
а) реакции радикального замещения SR
|
|
|
|
|
|
|
|
|
|
R + X |
C |
|
X + R |
|
|
|
C |
|
|||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) реакции электрофильного замещения SE
C X + E |
C E + X |
в) реакции нуклеофильного замещения SN
C X + N |
C N + X |
25
Реакции отщепления (элиминирования). Символ этих реакций Е (от англ.
Еlimination)
а) реакции β –элиминирования
E Y
C C C C
EY
б) реакции α-элиминирования:
Перегруппировки. В процессе перегруппировок происходит переход атомов или групп атомов от одного атома к другому. Наиболее распространённый вид перегруппировок – 1,2-перегруппировки.
В зависимости от природы мигрирующего центра различают три типа перегруппировок:
а) нуклеофильные (миграция атома или группы атомов с парой электронов)
R  R
R
C X

 C X
C X
б) радикальные (миграция атома или группы атомов с одним электроном)
R  R
R
C X

 C X
C X
в) электрофильные (миграция атома или группы атомов без электронов)
26
R  R
R
C X

 C X
C X
Молекулярные реакции. Этот тип реакций включает реакции, протекающие с образованием ковалентных связей (σ-связей) по концам различных центров с одновременным перераспределением π-связей внутри циклического переходного состояния.
Различают:
а) электроциклические реакции; б) реакции циклоприсоединения; в) сигматропные перегруппировки.
Электроциклические реакции включают образование σ-связей между конца ми линейной π-электронной сопряжённой системы:.
HC HC CH2
HC HC CH2
В реакциях циклоприсоединения две ненасыщенные молекулы соединяются с образованием циклического продукта с перераспределением и уменьшением числа кратных связей:
|
CH |
C |
HC |
|
|
|
|
HC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH |
|
|
|
|
C |
|||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Сигматропные перегруппировки включают разрыв σ-связей в исходной молекуле и образование новой σ-связи между ранее не связанными атомами
CH |
X |
|
C |
C |
X |
|
H2C |
C |
|
H2C |
|
||
|
|
|
|
|||
|
|
|
|
|
|
|
H C |
|
C |
H2C |
C |
C |
|
2 |
CH |
Y |
|
Y |
||
|
|
|
|
|||
|
|
|
|
|
|
|
По характеру молекулярности лимитирующей стадии реакции в механизме её протекания различают:
а) мономолекулярные реакции;
27
б) бимолекулярные реакции; в) реакции высшей молекулярности.
3.2. Классификация реагентов
Все реагенты можно разделить на три группы:
1.нуклеофильные реагенты
2.электрофильные реагенты
3.радикальные реагенты
Таблица 3.1
Некоторые нуклеофильные реагенты
Отрицательно заряженные |
Нейтральные молекулы, |
|||
|
ионы |
имеющие свободную |
||
|
|
|
пару электронов |
|
Название |
|
Формула |
Название |
Формула |
|
|
|
|
|
гидрид-ион |
|
H |
вода |
H2O |
галогенид-ионы |
|
F ,Cl , Br ,I |
спирты |
R-OH |
гидроксид-ион |
|
HO |
тиоспирты |
R-SH |
алкоксид-ион |
|
RO |
аммиак |
NH3 |
цианид-ион |
|
N≡C |
первичные амины |
R-NH2 |
тиолат-ион |
|
HS |
вторичные амины |
R2NH |
акилтиолат-ион |
|
RS |
третичные амины |
R3N |
фенолят-ион |
|
C6H5O |
фенолы |
Ar-OH |
карбоксилат-ион |
|
R-COO |
эфиры |
R-O-R |
карбанион |
|
R |
|
|
бисульфат-ион |
|
HSO4 |
|
|
Нуклеофильные реагенты. Нуклеофильные реагенты (нуклеофилы) –
это частицы или молекулы, которые для образования связи с субстратом предоставляют пару электронов.
Нуклеофилы обозначают символом N или :N. В табл. 3.1. представлены некоторые нуклеофильные реагенты.
Электрофильные реагенты. Электрофильные реагенты (электрофилы)
− это частицы или молекулы, которые для образования связи с субстратом
предоставляют свободную орбиталь. Электрофилы обозначают символом Е или Е+:

|
|
|
|
|
28 |
|
|
Некоторые электрофильные реагенты |
Таблица3.2 |
||||
|
|
|
||||
|
|
|
|
|
|
|
|
|
Нейтральные молекулы, |
|
|
|
|
Положительно заряжен- |
имеющие электроно- |
Радикалы, карбены, арины |
||||
ные частицы, Е+ |
дефицитный центр, Е |
|
|
|
||
|
|
|
|
Название |
|
|
Название |
Формула |
Название |
Формула |
Формула |
||
|
|
|
|
радикалы: |
|
|
протон |
Н+ |
|
AlCl3 , |
|
R. |
|
|
|
|
|
|
|
|
|
|
|
BF3 |
|
|
|
катионы |
М+ |
кислоты |
SO3 |
карбены |
|
: – C| : |
металлов |
Льюиса |
PCl3 |
|
|
|
|
нитроний-катион |
NO2+ |
|
FeCl3 |
|
|
|
нитрозил-катион |
NO+ |
|
|
|
|
|
|
|
|
|
|
|
|
4. КИНЕТИКА И ТЕРМОДИНАМИКА ОРГАНИЧЕСКИХ РЕАКЦИЙ
Реакционная способность – это способность химического соединения взаимодействовать с другим химическим соединением или атомом. Количественной мерой реакционной способности является константа скорости реакции k. Если реакция обратима, то мерой реакционной способности является константа равновесия К.
Экспериментальное исследование кинетики состоит в измерении скоростей исчезновения исходных веществ и/или появления продуктов реакции при различных концентрациях реагирующих веществ при фиксированной температуре. За ходом изменения концентраций можно следить разными методами, например титрометрическим, колориметрическим, спектрометрическим и т.д. Наиболее важным этапом кинетических исследований является нахождение формы уравнения, выражающего зависимость скорости реакции от концентрации реагирующих веществ.
Исходными понятиями химической кинетики являются: кинетическое уравнение, порядок реакции, молекулярность реакции.
4.1. Кинетическое уравнение.
Уравнение, описывающее зависимость скорости реакции от концентрации реагирующих соединений, называется кинетическим уравнением.
Для реакции:
αА +βВ + … → γС + δD +…
кинетическое уравнение примет вид:
29
V = -d[A]/d[t] = -d[B]/d[t] = k[A] [B] …
…
Коэффициент пропорциональности k в этом уравнении называется кон-
стантой скорости реакции.
Порядок реакции. Величины α, β … в выражении для скорости реакции называют порядками реакции по соединениям А, В, …и т.д. Сумма порядков по всем реагирующим веществам называется общим порядком или просто порядком. Порядок реакции обозначают буквой n (n = α+ β + …).
Если концентрация одного или нескольких реагирующих веществ в ходе реакции остаются постоянными, тогда соответствующие концентрациям множители включают в константу. В этих случаях реакция имеет псевдо- n -
ый порядок.
Элементарные реакции. В большинстве органических реакций образование конечного продукта протекает через несколько стадий. Каждую из этих стадий можно рассматривать как самостоятельную реакцию со своими исходными веществами и продуктами. Такие реакции называются элемен-
тарными.
Выделение элементарных стадий химического процесса определяется чувствительностью методов анализа, которые используют для определения концентрации промежуточных продуктов.
4.2. Молекулярность реакции.
Мономолекулярные реакции. В общем виде мономолекулярную реакцию выражают уравнением:
А → αВ + βС
Если обозначить через α число молей вещества А в начальный момент времени, через x – число молей вещества А, превратившегося к моменту времени t, то кинетическое уравнение в экспоненциальной форме можно представить так:
α ─ x = α е–kt
Из уравнения следует, что концентрация вещества А экспоненциально уменьшается во времени от исходной концентрации до нулевой.
Примерами необратимых реакций первого порядка являются реакции изомеризации молекул, разложения молекул в газовой фазе, некоторые реакции, протекающие в растворе (SN1, Е1 и др.).
Бимолекулярные реакции. Реакция второго порядка записывается так:
A + B → C + D
