
u_sem
.pdf70
как SN2- переходное состояние, имеющее структуру тригональной бипирамиды, более пространственно затруднено, чем основное состояние.
Более электроотрицательный атом удерживает свои электроны прочнее, чем менее электроотрицательный, и требует большей затраты энергии для достижения переходного состояния, которое включает подачу электронной пары к электрофильному центру. Нуклеофильность понижается при переходе по диагонали в Периодической системе.
Чем больше электроотрицательность атакующего атома, тем легче ему найти тот атом углерода, который он должен атаковать. Поэтому анионы яв-
ляются более сильными нуклеофилами, чем сопряженные им кислоты. На-
пример, ОН− более сильный нуклеофил, чем Н2О. Ниже приводятся другие примеры:
SH > H–SH; RO > R–OH; Cl > H–Cl
При движении сверху вниз в группе периодической системы элементов размеры атомов увеличиваются. Например, относительные размеры атомов галогенов изменяются в следующем порядке: I > Вг > CI > F.
В протонном растворителе (типа этанола) нуклеофильность аниона обычно тем больше, чем больше размер аниона. Поэтому нуклеофильность атома в группе периодической системы элементов повышается при движении сверху вниз. Это соответствует ряду нуклеофильности галогенов:
I > Br > Cl > F .
По этим же причинам RSH является лучшим нуклеофилом, чем ROH,
RS−– лучшим нуклеофилом, чем RO−, и РН2− – лучшим нуклеофилом, чем
NH2−.
Влияние размера атома на нуклеофильность отчасти связано с поляризуемостью атома, выступающего в качестве нуклеофила. (Под поляризуемостью понимают способность внешнего электронного облака атома претерпевать деформацию.) Чем больше поляризуемость атома, тем легче деформируется внешнее электронное облако. В свою очередь, чем больше поляризуемость атома, тем быстрее его электронное облако реагирует на небольшой положительный заряд, локализованный на атакуемом атоме углерода. Боль-
шей поляризуемостью обладают те атомы, размер которых больше, потому что в больших атомах внешние электроны расположены на большем расстоянии от положительно заряженного ядра. Теперь можно сказать, что в протонных растворителях I− является более сильным нуклеофилом, чем Br−, потому что в 10 больше по размеру, чем Вг−, и, следовательно, легче поляризуется.
Нуклеофильность аниона очень сильно зависит от степени его сольватации. В растворителях, образующих водородные связи анион сильно сольватирован, что понижает его реакционную способность.
Общий порядок реакционной способности нуклеофилов в протонных растворителях следующий:
71
HS , RS > I > Br > RO > Cl > H3C-COO > NO3
Описанное выше влияние растворителя на нуклеофильность в протонном растворителе можно объяснить так: анион в протонном растворителе стабилизирован за счет образования водородных связей. В небольших по размеру анионах отрицательный заряд распределен в сравнительно небольшом объеме. Поскольку заряженные частицы стабилизируются распределением заряда («размазыванием»), анионы малого размера, образуя водородную связь с растворителем, способствуют распределению заряда и тем самым понижению их энергии. В больших анионах отрицательный заряд распределен в сравнительно большом объеме. Следовательно, образование водородных связей гораздо важнее для стабилизации анионов малого размера, чем для стабилизации анионов большого размера. К сожалению, сильное взаимодействие между растворителем и анионом малого размера подавляет его нуклеофильность. Поскольку прежде, чем приобрести свойства нуклеофила, анион должен затратить энергию для того, чтобы освободиться от растворителя. Боль-
ший анион освобождается от растворителя с меньшей затратой энергии, и потому в протонных растворителях он будет обладать свойствами более сильного нуклеофила.
Апротонный растворитель типа N,N-диметилформамида не способен сольватировать анионы за счет образования водородных связей с ними, поскольку растворитель не содержит атомов водорода, способных к образованию водородных связей. Следовательно, в апротонных растворителях анионы сольватированы в меньшей степени, чем в протонных. Благодаря этим обстоятельствам небольшой анион богаче энергией, чем большой, и является, поэтому, более сильным нуклеофилом. Таким образом, в полярном апротонном растворителе F−, который меньше, чем Вг− или I−, будет более сильным нуклеофилом, чем Вг− или I−.
Использование апротонных растворителей приводит к повышению нуклеофильности анионов по сравнению с протонными средами. Применение макроциклических полиэфиров (краун-эфиров) позволило увеличить растворимость неорганических солей в органических растворителях и добиться эффекта относительно слабой сольватации анионов. Анионы в этих условиях ведут себя как очень реакционноспособные частицы.
7.7. Мономолекулярное нуклеофильное замещение (SN1)
Изучение кинетики реакции взаимодействия трет-бутилбромида с гидро- ксил-ионом показало, что эта реакция первого порядка, и скорость реакции (v) зависит только от концентрации трет-бутилбромида: v= k[RBr]
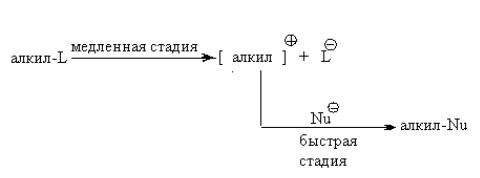
72
(CH3)3CBr + OH → (CH3)3COH + Br
Если скорость реакции не зависит от концентрации гидроксил-ионов, это означает, что OH не участвует в реакции, скорость которой определяют. Эти наблюдения находятся в соответствии со следующим механизмом. Реакция гидролиза протекает в две стадии.
На первой стадии трет-бутилбромид медленно диссоциирует на
трет-бутильный карбокатион и анион брома:
(CH3)3CBr → (CH3)3C+ + Br |
(медленно). |
На второй стадии, образовавшийся карбокатион быстро реагирует с гидроксил-ионом, образуя конечное вещество:
(CH3)3C+ + OH |
(быстро). |
Этот механизм называется SN1-мономолекулярное нуклеофильное заме-
щение. Используется термин «мономолекулярное», так как в стадии, определяющей скорость реакции, участвует только одна молекула.
Скорость общей реакции определяется тем, как быстро ионизуется алкилгалогенид. Стадия разрыва связи требует затраты энергии. Эта энергия выделяется в результате ион-дипольного взаимодействия между образующимися ионами и растворителем. Таким образом, можно сделать следующий вывод:
реакции, протекающие по механизму SN1, состоят из двух отдельных стадий. На первой, наиболее важной стадии, происходит ионизация исходно-
го соединения (например, алкилгалогенида) с образованием аниона (напри-
мер, галогенид-иона) и катиона R+. На второй, завершающей стадии, образовавшийся катион реагирует с нуклеофилом, давая конечный продукт.
Реакция SN1 в общем виде:
В ходе этой последней стадии атом углерода, несущий положительный заряд претерпевает изменение гибридизации. В катионе этот атом углерода находится в состоянии sр2-гибридизации, в конечном продукте — В sр3- гибридизованном состоянии.
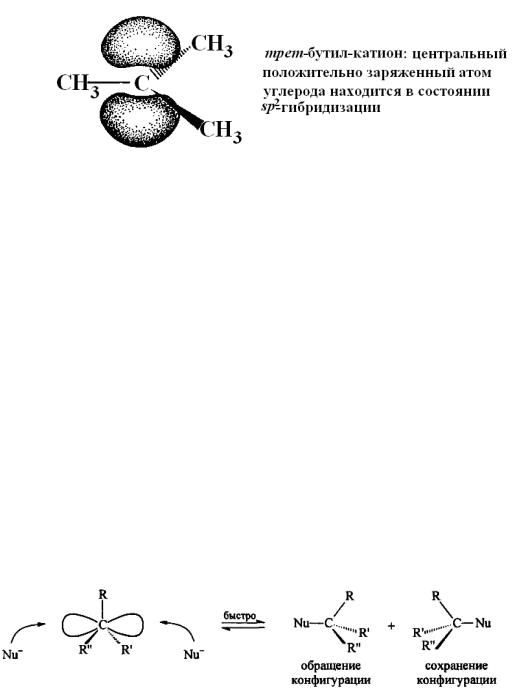
73
7.8. Стереохимия SN1-реакций
Известно, что многие реакции, в которых оптически активные субстраты претерпевают нуклеофильное замещение, приводят к полной потери оптической активности продукта реакции. Например, реакция гидролиза оптически активного α-хлорэтилбензола в 80%-ном водном растворе ацетона сопровождается 97%-ной рацемизацией. В чём причина? При гидролизе α- хлорэтилбензола реакция протекает через стадию образования карбокатиона. В карбокатионе все три связи положительно заряженного sp2- гибридизованного атома углерода лежат в одной плоскости.
Нуклеофильный реагент может с одинаковой вероятностью атаковать плоский карбокатион с любой стороны − с фронта или с тыла, и в зависимости от того с какой стороны происходит атака, образуются продукты с сохраненной или обращённой конфигурацией. Следовательно, в результате реакции образуется эквимолярная смесь энантиомеров. Таким образом, исходное оптически активное соединение, подвергаясь реакции SN1, даёт рацемический продукт.
7.9. SN1 -Реакции: реакционная способность.
Стадией, определяющей скорость реакции при SNl-замещении, является стадия образования карбокатиона. Исходя из вышесказанного, можно ожидать, что реакционная способность алкилгалогенида зависит главным образом
от устойчивости образующегося карбокатиона.
Это действительно так: реакционная способность алкилгалогенидов изменяется в таком же порядке, как и устойчивость карбокатионов.
74
Реакционная способность RX в SNl-реакции уменьшается в ряду: аллил, бензил > третичный > вторичный > первичный > СН3Х.
Таблица 7.5.
Относительные скорости SN1-реакций ряда алкилхлоридов
Соединение |
котн. |
Соединение |
котн. |
|
|
|
|
Хлористый аллил |
1.0 |
2-хлор-2-метилпропан |
4•104 |
|
|
|
|
2-хлорпропан |
0,1 |
1-хлор-1-фенилэтан |
8•104 |
|
|
|
|
1-хлорбутен-2 |
2•103 |
Хлордифенилметан |
4•107 |
|
|
|
|
4-хлор-2-метилбутен-2 |
3•106 |
Хлортрифенилметан |
2•1010 |
|
|
|
|
3-хлор-3-метилбутен-1 |
1•107 |
|
|
|
|
|
|
Поскольку в переходном состоянии положительный заряд сосредоточен на атоме углерода, то он делокализуется вследствие эффекта гиперконъюгации и резонанса, которые стабилизуют полностью образовавшийся карбониевый ион:
Приведенные в табл. 7.5 примеры позволяют представить, как изменяется скорость реакции в зависимости от строения радикала:
Скорость SN2-peaкции зависит главным образом от пространственных факторов, т. е. от объема заместителей. Напротив, скорость SN1-реакции зависит в основном от электронных факторов, т. е. от способности заместителей подавать или оттягивать электроны, табл. 7.8.
7.10. SN1-Реакции: перегруппировки
Если SN1-реакция протекает через стадию образования карбокатиона, то следует ожидать еще одну характерную для карбокатиона реакцию, а именно перегруппировку. В SN2-peaкции, напротив, ион галогена не отходит от радикала до тех пор, пока не присоединится нуклеофильный реагент; в этом случае не существует промежуточной частицы, и, следовательно, нельзя ожидать перегруппировки. И это действительно так. Приведенный ниже пример иллюстрируют эту точку зрения:
75
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
H2O |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH3 |
|
C |
|
CH2 |
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
C |
|
|
CH2 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
H |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H2O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH2 |
|
|
|
CH3 |
|||||||||||||||||
CH3 |
|
|
|
C |
|
|
CH2 |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
При гидролизе неопентилхлорида образуется не первичный спирт, а исключительно третичный. Неопентильный карбокатион особенно склонен к перегруппировке в более устойчивый трет-пентиловый карбокатион.
7.11. SN1-Реакции: влияние природы уходящей группы
Введение электроноакцепторных заместителей в уходящую группу приводит к делокализации возникающего в ней отрицательного заряда и к увеличению скорости SN1 –реакции. Так, например, реакционная способность трифторацета в 106 раз выше, чем у ацетата. Трифторметилсульфонат (трифлат) является исключительно хорошей уходящей группой. Это позволяет проводить реакции нуклеофильного замещения для нереакционноспособных субстратов.
Сильные основания обычно бывают плохими уходящими группами. К их числу относятся, например, ОН-, NH-, RO- R2N-, СН3- и Н-. Слабые основания обычно являются хорошими уходящими группами. Действительно, можно сказать, что существует обратное соотношение между основностью час-
тицы и ее способностью быть уходящей группой. Наилучшие уходящие группы – сульфонаты – обладают очень слабыми основными свойствами.
Вживых организмах многие процессы протекают как реакции нуклеофильного замещения. В то время как в лабораториях химики в качестве уходящих групп часто используют галогениды и производные серной кислоты, в организме человека реакции замещения протекают с другими уходящими группами. Среди наиболее часто встречающихся в живых системах уходящих групп − фосфатная группа ОР(О)(ОН)2.
Вряду галогенопроизводных, реакционная способность изменяется в следующем порядке: RI > RBr > RCl >> RF.
Это связано с увеличением энергии ионной диссоциации связи С-Hal и уменьшением эффекта поляризуемости в этом ряду. Так, относительная скорость сольволиза различных трет-бутилгалогенидов в 80%-ном этиловом спирте при 25 ºС изменяется в 105,5 раза при переходе от трет-бутилхлорида
ктрет-бутилиодиду (для трет-бутилбромида она равна 43,5).

76
Плохую уходящую группу можно сделать более мобильной, применяя катализаторы электрофильного характера. Например, в случае галогенопроизводных реакция замещения ускоряется, если использовать ионы серебра, способные образовывать комплексы с галогенид-ионами.
7.12. Сравнение SN1- и SN2-реакций
Строгость доказательства обоих механизмов, SN1- и SN2-реакций, заключается в их логичности. Нуклеофильное замещение, протекающее по первому порядку, сопровождается рацемизацией и перегруппировкой, и реакционная способность уменьшается в следующем порядке: третичный > вторичный > первичный > СН3Х. Для реакций второго порядка характерны полное обращение конфигурации и отсутствие перегруппировок; реакционная способность уменьшается в следующем порядке: СН3Х первичный > вторичный > третичный. Поскольку порядок изменения реакционной способности в SN1- и SN2- реакциях различен, каждая из них в чистом виде встречается очень редко, а вместо этого имеется последовательность, которая является комбинацией обеих. Наиболее типично для алкилгалогенидов при переходе от СН3 к первичным, вторичным и третичным галогенидам наличие минимума, обычно для вторичных алкилгалогенидов:
Реакционная способность в SN2-реакции уменьшается при переходе от СН3 к первичным алкилгалогенидам, и для вторичных алкилгалогенидов она настолько низка, что появляется значительный вклад SN1-реакции; реакционная способность, теперь уже в SN1-реакции, резко возрастает при переходе к третичным алкилгалогенидам. В случае нуклеофильного замещения в алифатическом ряду рассмотренный минимум очень характерен для изменения молекулярности реакции.
Несмотря на склонность определенного класса алкилгалогенидов к определенному механизму, можно в какой-то степени контролировать реакцию, изменяя экспериментальные условия. Влияние экспериментальных условий на относительное значение двух механизмов дает дополнительное доказательство их существования. Высокая концентрация нуклеофильного реагента благоприятствует SN2-реакции, а низкая концентрация, наоборот, способствует SN1-реакции.
Природа нуклеофильного реагента также играет важную роль: например, неопентилбромид реагирует с этилат-ионом по SN2-механизму, а с этиловым спиртом − по SN1-механизму. Сильный нуклеофил (сильное основание), этилат-ион, выталкивает ион галогена из молекулы, тогда как слабый
77
нуклеофил − этиловый спирт, “ждет”, пока ион галогена отойдёт от реакционного центра.
Наконец, механизм реакции часто может определяться полярностью растворителя. Ионизация алкилгалогенида возможна только потому, что образование диполь-дипольных связей между растворителем и полярным переходным состоянием освобождает некоторое количество энергии, необходимое для достижения переходного состояния. Чем полярнее растворитель, тем больше его сольватирующая способность и тем быстрее происходит ионизация Замена растворителя, например 80%-ного этилового спирта, более полярной водой должна ускорять ионизацию и, следовательно, скорость SN1- реакции. В случае такой замены увеличение полярности растворителя намного замедляет SN2-peaкцию. При этом переходное состояние менее полярно, чем исходные вещества, поскольку отрицательный заряд распределен между ОН и X и, следовательно, переходное состояние менее сильно сольватировано по сравнению с исходными веществами.
При прочих равных условиях, чем полярнее растворитель, тем больше вероятность, что алкилгалогенид будет реагировать по SN1-механизму. Рассмотренные механизмы позволяют предсказать поведение алкилгалогенида определенного строения в реакциях нуклеофильного замещения: его реакционную способность в данных условиях, вероятность рацемизации или перегруппировки, степень элиминирования. Они позволяют выбрать условия эксперимента – концентрацию, растворитель, нуклеофильный реагент – для получения необходимого вещества.
Все вышеизложенное не следует рассматривать как свидетельство того, что в реакциях нуклеофильного замещения в качестве нуклеофила или уходящей группы могут участвовать только галогены. В определении, которое было приведено, говорилось, что нуклеофилом является любое соединение, способное быть донором пары электронов, и, следовательно, класс нуклеофилов не ограничивается только анионами. Аналогично тот факт, что большинство уходящих групп уходит в виде анионов, еще не является необходимым условием того, что уходящая группа будет анионом. В реакциях бимолекуляр-
ного нуклеофильного замещения в качестве атакуемого атома может выступать не только атом углерода, но и атомы серы, брома, кремния, олова и других элементов. Однако общим для всех этих процессов является то обстоятельство, что нуклеофил атакует наиболее электроположительный участок поляризованной ковалентной связи.
8. РЕАКЦИИ ЭЛИМИНИРОВАНИЯ
Наиболее характерная особенность реакций элиминирования состоит в том, что от субстрата под действием реагента отщепляются два фрагмента и в результате образуется продукт элиминирования. В результате этой реакции в продукте элиминирования обычно образуется новая σ- или π-связь.
78
8.1. Классификация реакций элиминирования
Один из способов классификации реакций элиминирования состоит в использовании греческого алфавита для обозначения атомов скелета, связанных с уходящими группами. Атом, несущий типичную уходящую группу (например, Cl), обозначается Сα, а атом, несущий нетипичную уходящую группу (например, водород), обозначается последовательно, начиная с Сα. Когда имеются две типичные уходящие группы (например, два хлора), обозначение Сα произвольно. Можно считать, что реакции отщепления проходят от Сα и Сα; от Сα и Сβ; от Сα и Cγv и т. д. Для простоты такие реакции классифицируются по старшей букве, и на основе этого правила только что указанные реакции будут называться α-, β- и γ-элиминированием соответственно. Если оба отщепляющихся фрагмента связаны с одним и тем же атомом углеродного скелета, то такой процесс называется α-элиминированием, в результате образуется электронодефицитная частица – карбен (1).
Если уходящие группы связаны с соседними атомами, то реакция отщепления, приводящая к возникновению новой σ-связи, протекает путем (β- элиминирования с образованием двойной связи (2).
Реакции элиминирования групп, расположенных далеко друг от друга, приводят к циклическим соединениям (3):
A |
|
|
B |
|
|
|
Y |
|
|
|
|
|
|
|
|
|
A |
|
|
|
B |
(1) |
|||
|
|
|
|
|
|
|
|
|
XY |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
A |
|
B |
|
|
|
|
|
|
|
|
|
A |
|
|
|
B |
(2) |
|||||||
|
|
|
|
|
|
|
|
XY |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Y |
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
(3) |
|||||
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
C |
|
|
|
XY |
C |
|
|
|
C |
||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
XY
8.2.Бимолекулярное элиминирование (Е2)
При нуклеофильном замещении у насыщенного атома углерода практически всегда имеет место отщепление, которое приводит к олефинам. По предложению Ингольда эти реакции обозначают как мономолекулярное элиминирование (Е1) или бимолекулярное элиминирование (Е2).
Наиболее важные структурные особенности, которые необходимо рассмотреть при обсуждении механизма элиминирования следующие: природа
79
уходящей группы, природа основания, пространственные факторы в субстрате, влияние растворителя.
8.2.1.Механизм Е2-реакций
Вреакциях бимолекулярного элиминирования две группы отщепляются одновременно:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
C |
|
C |
|
|
|
||
|
C |
|
C |
|
X |
|
|
|
B H C |
|
C X |
|
|
|
H |
|
|
|
|
|
X |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакции Е2 протекают в одну стадию и характеризуются кинетикой второго порядка, первым по субстрату и первым по основанию:
v k B 
 H C C X
H C C X
Донор электронной пары (основание) может быть нейтральным (например, вода) или отрицательно заряженным (например, гидроксил-ион). Уходящая группа может отщепляться в виде аниона (например, хлорид-ион) или нейтрального соединения (например, вода). В представленной выше схеме приведена только одна возможная комбинация (отрицательно заряженное основание и анионная уходящая группа).
На рис. 10.1 представлен процесс образования π-связи при элиминировании. В исходном соединении (1) одна из sp3-орбиталей атома углерода перекрывается с орбиталью атома водорода, а другая – с орбиталью Х. В переходном состоянии (II) эти sp3-орбитали почти полностью превращаются в р- орбитали, а углерод, первоначально тетраэдрический, принимает форму близкую к плоской тригональной. Эта форма реализуется полностью в конечном продукте (III), в котором благодаря перекрыванию р-орбиталей образуется π- связь.
Точная природа переходного состояния в Е2-реакциях зависит от нескольких переменных, таких как сила основания, природа уходящей группы и природа растворителя. Например, реакцию элиминирования, протекающую через Е2-переходное состояние, можно заставить протекать по Е1cb- механизму (связь С-Х почти не затронута, а β-атом водорода почти отщепился под действием основания), если увеличить силу основания или заменить хорошую уходящую группу на худшую.
