
himorgsoedinenii
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
«ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
__________________________________________________________________
Е.Б. ГОЛУШКОВА
ХИМИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Рекомендовано в качестве учебного пособия Редакционно-издательским советом Томского политехнического университета
Издательство Томского политехнического университета
2009
УДК 547 (075.8) ББК 24.2я73
Г16
Голушкова Е.Б.
Г16 Химия органических соединений: учебное пособие / Е.Б. Голушкова; Томский политехнический университет. – Томск: Изд-во Томского политехнического университета, 2009. – 113 с.
В пособии изложены основные теоретические положения и фактический материал курса органической химии, рассмотрено строение органических соединений, их классификация, способы получения, основные физические и химические свойства.
Пособие является частью комплексного методического обеспечения кафедры общей и неорганической химии ТПУ. Предназначено для студентов, изучающих дисциплину «Химия». Пособие также может представлять интерес для магистрантов и аспирантов, работающих с органическими веществами.
УДК 547(075.8) ББК 24.2я73
Рецензенты
Доктор химических наук, ведущий научный сотрудник института химии нефти СО РАН
Т. А. Сагаченко
Кандидат химических наук, старший преподаватель кафедры химии СГМУ
Л. А. Дрыгунова
©ГОУ ВПО «Томский политехнический универ-
ситет», 2009
©Голушкова Е.Б., 2009
©Оформление. Издательство Томского политехнического университета, 2009
ОГЛАВЛЕНИЕ |
|
ВВЕДЕНИЕ…………………………………………………………………… 4 |
|
РАЗДЕЛ 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ............. |
6 |
Глава 1. Природа химических связей в органических соединениях………….6 |
|
§1. Развитие теории химического строения органических соединений. 6
§2. Особенности строения электронных подуровней атома углерода.. 8
§3. Типы химической связи в органических соединениях……………. 12
§4. Типы разрыва ковалентных связей………………………………..... 13
Глава 2. Теория органических соединений……….…………………...…….. 16
§5. Классификация органических соединений…………………..……….. 16
§6. Изомерия…………………………………………………..………. 19
§7. Графическое изображение органических соединений……..……... 25
§8. Взаимное влияние атомов в молекуле……………………..……….. 26
§9. Кислотно-основные свойства органических соединений……..…... 29
§10. Номенклатура органических соединений………………………...…. 32
Глава 3. Теория органических реакций…………………………………...….... 34
§11. Классификация органических реакций…………………………..….. 34
§12. Реагирующие органические частицы………………………..…….. 37
РАЗДЕЛ 2. УГЛЕВОДОРОДЫ…………………………………………...…. 39
Глава 4. Ациклические углеводороды………………………………………... 39
§13. Алканы…………………………………………………………..…... 39
§14. Алкены……………………………………………………………..... 45
§15. Алкадиены………………………………………………..................... 52
§16. Алкины………………………………………………………...…….. 57
Глава 5. Циклические углеводороды………………………...………………... 61
§17. Циклоалканы………………………………………………..……..…. 61
§18. Ароматические углеводороды………………………………..…..….65
РАЗДЕЛ 3. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ С ОДНОРОДНЫМИ ФУНКЦИЯМИ……..…………………………………………….……………. 71
Глава 6. Органические галогениды…………………………..……………...... 71
§19. Галогенопроизводные алканов…………………………………..…..71
§20. Галогенопроизводные непредельных углеводородов………..….…75
Глава 7. Органические кислородсодержащие соединения……………..…...…78
§21. Спирты………………………………………………………....……... 78
§22. Фенолы………………………………………………………..…...…..85
§23. Альдегиды и кетоны………………………………………....………. 89
§24. Карбоновые кислоты………………………………………....……… 96 ЗАКЛЮЧЕНИЕ………………………………………………………..……..... 102 ЗАДАЧИ И УПРАЖНЕНИЯ……………………………………..…...………. 104 СПИСОК ЛИТЕРАТУРЫ…………………………………………..………….106 ПРИЛОЖЕНИЕ……………………………………………………..……..…... 107
3
ВВЕДЕНИЕ
В настоящее время человечество уже не в силах существовать без химии и химической технологии. Мы живем в окружении разнообразных веществ. Одни из них существуют со времени образования нашей планеты, другие созданы руками человека. Причем синтетических соединений становится все больше. Это связано, прежде всего, с увеличением численности населения планеты и возрастанием потребностей человека.
Все вещества химики делят на два больших класса– на органические и неорганические. Органические соединения изучаются в отдельном разделе химии – органическая химия. Органическую химию обычно определяют какхимию соединений углерода. Такое определение сразу вызывает вопрос: а как же обстоит дело с такими хорошо известными неорганическими веществами, как угольная и синильная кислоты
иих соли, ведь они тоже содержат углерод? Действительно, четкой грани между органической и неорганической химией провести невозможно.
Понятие органическая химия возникло в начале ХIX века, когда было выяснено, что углеродсодержащие вещества являются главной составной частью растительных и животных организмов. Первоначально задачей органической химии было изучение веществ, определяемых в живой природе. Однако постепенно все большее значение стали приобретать продукты органического синтеза– искусственно получаемые вещества, многие из которых не встречаются в природе. Современная органическая химия – один из важнейших разделов химической науки, изучающий как природные, так и синтетические органические вещества, их строение, способы получения, свойства, возможности практического использования.
Выделение органической химии в особый раздел химической науки вызвано несколькими причинами. Первая из них – многочисленность
имногообразие органических соединений. Действительно, в настоящее время их известно около10 миллионов, число же известных неорганических соединений не превышает700 тысяч. Удивительная многочисленность таких соединений обусловлена уникальными свойствами углерода. Атомы углерода способны соединяться не только с другими элементами, но и друг с другом, образуя часто сложные молекулы, построенные как в виде цепей (линейных, разветвленных), так и различного циклического строения. Вторая причина состоит в сложности и своеобразии органических веществ. Они существенно отличаются от неорганических соединений. Так, при нагревании (даже до сравнительно не-
4
высокой температуры) многие органические вещества обычно разлагаются. Их температуры кипения и плавления значительно ниже, чем у неорганических веществ. Кроме того, все органические соединения горючи (за некоторым исключением), тогда как большинство неорганических веществ этим свойством не обладают. Для органических соединений характерно большое разнообразие химических превращений. При этом реакции органических соединений, как правило, протекают гораздо медленнее, чем неорганических. В органической химии мы встречаем новые понятия и закономерности. Это изомерия и гомология, пространственное строение молекул, взаимное влияние атомов в молекуле. Третья причина выделения органической химии в отдельную науку заключается в
большом практическом значении органических соединений. Высокомоле-
кулярные соединения, лекарственные препараты и красители, средства повышения урожайности, эффективные поверхностно-активные соединения, взрывчатые вещества – вот неполный перечень того, что может дать органическая химия. Без знания основ органической химии современный человек не способен использовать все эти продукты цивилизации правильно, без вреда для себя и окружающей среды.
Данное пособие состоит из трех разделов. В первом разделе излагаются теоретические основы органической химии. Во втором и третьем разделах рассматриваются особенности строения атома углерода в органических соединениях, теории гибридизации электронных орбиталей, взаимного влияния атомов в молекуле, изомерии, электронных эффектов, классификации и механизмов некоторых химических реакций, классификации и номенклатуры определенных классов органических соединений.
В основу пособия положена классификация органических соединений, связанная с характером углерод-углеродной цепи. Такая классификация, по мнению автора, более удобна для усвоения курса органиче-
ской химии. Поэтому второй раздел пособия посвящен химии углеводородов, третий раздел – химии производных углеводородов.
Пособие рекомендовано студентам нехимических специальностей, изучающих органическую химию в соответствии с государственным образовательным стандартом в небольшом объеме. Оно главным образом ориентировано на самостоятельную работу студентов. Поэтому для систематизации изученного материала и закрепления полученных знаний рекомендуется выполнить задания и упражнения, помещенные в конце пособия. В приложении приводится справочный материал, который может использоваться при выполнении данных заданий.
5

Раздел 1. Теоретические основы органической химии
РАЗДЕЛ 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
В современной органической химии накоплен огромный объем фактического материала. По этой причине предмет органической химии традиционно труден для изучения. В то же время знание теории строения органических соединений вместе с основными принципами механизмов реакций позволяет систематизировать различные факты этой науки и объяснить их при помощи нескольких фундаментальных законов и правил. Поэтому, прежде чем приступить к изучению классов органических соединений, необходимо изучить теоретические основы органической химии в целом.
ГЛАВА 1. ПРИРОДА ХИМИЧЕСКИХ СВЯЗЕЙ
ВОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
§1. Развитие теории химического строения органических соединений
Попытки объяснить природу органических -со единений были сделаны в20–30-х годах XIX века рядом ученых (Берцелиус, Дюма, Либих, Вёлер, Гей-Люссак) в теории радикалов. В ее основу было положено то, что при многих химических реакциях
группа из нескольких атомов– органический ради-
кал, входящий в состав органического соединения,
– может переходить без изменения из одной молекулы (исходное вещество) в другую (продукт реак-
ции). Берцелиус рассматривал органические вещест-  ва как системы, состоящие из двух противоположно заряженных частиц
ва как системы, состоящие из двух противоположно заряженных частиц
– органического радикала (с положительным зарядом) и простого неорганического остатка (заряженного отрицательно), связанных с помощью электростатического взаимодействия.
Дальнейшие исследования показали несостоятельность этой теории, и в 40-х годах XIX века возникла другая теория– теория типов (Жерар, Лоран, Дюма). В противоположность «теории радикалов» она рассматривала часть молекулы, изменяющуюся в процессе химической реакции. Согласно этой теории, все известные в то время органические соединения рассматривались
6

Глава 1. Природа химических связей в органических соединениях
производные простейших неорганических веществ: водорода, хлори-
стого водорода, воды, аммиака. При замене атома водорода в любом из этих типов веществ на радикал можно получить различные органические соединения. Позже по предложению Ф. Кекуле был введен новый тип – тип метана, к которому стали относить все углеводороды:
Тип водорода |
|
|
|
|
|
|
Тип аммиака |
|
|
|
|
|
|||
Нü |
СН |
ü |
С Н |
ü |
|
С Н Оü |
Нü |
СН |
ü |
|
СН |
|
ü |
||
ý |
3 ý |
2 5 |
ý |
|
|
2 3 |
ý |
ï |
3 |
ï |
|
3 |
ï |
||
Н |
Н |
þ |
Н |
þ |
|
|
Н |
Нý N Н |
ýN |
Н |
ý N |
||||
þ |
|
|
|
|
|
þ |
ï |
Н |
ï |
|
|
|
ï |
||
водород |
метан |
этан |
|
|
уксусный |
|
|
|
|||||||
|
|
Нþ |
þ |
|
СН3 þ |
||||||||||
|
|
|
|
|
|
альдегид |
аммиак |
метиламин |
диметиламин |
||||||
Тип хлористиго водорода |
|
|
|
|
Тип метана |
|
|
|
|
|
|||||
Н ü |
СН3 ü |
|
С Н Оü |
|
Нü |
СН3 ü |
|
СН3 ü |
|||||||
ý |
|
ý |
|
2 |
3 |
ý |
|
ï |
Н |
ï |
|
СН3 |
ï |
||
|
|
|
|
|
|
Нï |
ï |
С |
ï |
||||||
Clþ |
|
Cl þ |
|
|
|
Cl þ |
|
ýС |
Н |
ý |
Н |
ýС |
|||
хлористый |
хлористый |
|
хлористый |
Нï |
ï |
|
ï |
||||||||
водород |
|
метил |
|
|
ацетил |
|
ï |
Н |
ï |
|
Н |
ï |
|||
|
|
|
|
|
|
|
|
|
Нþ |
þ |
|
þ |
|||
Тип воды |
|
|
|
|
|
|
|
метан |
этан |
|
пропан |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Нü |
СН |
ü |
С Н |
ü |
О |
|
С Н Оü |
О |
|
|
|
|
|
|
|
ýО |
3 |
ýО |
2 5 |
ý |
|
2 3 ý |
|
|
|
|
|
|
|||
Нþ |
Н |
þ |
|
Н |
þ |
|
|
Нþ |
|
|
|
|
|
|
|
вода |
метиловый |
диэтиловый |
уксусная |
|
|
|
|
|
|
||||||
|
спирт |
эфир |
|
|
|
кислота |
|
|
|
|
|
|
|
||
Теория типов сыграла в свое время положительную роль. Она способствовала классификации органических соединений. Но её основная мысль – уложить соединения углерода в формулы простейших неорганических соединений– была ошибочной. Вскоре обнаружилась необходимость введения кратных(удвоенных, утроенных и т. д.) и смешанных (составленных из двух и более простых) типов, а также возможность относить соединения одного класса к разным типам (например, альдегиды к типам водорода и воды).
В основе современных теоретических представлений органической химии лежиттеория химического строения, предложенная в 60-х годах XIX в. великим русским химиком А.М. Бутлеро-
7

Раздел 1. Теоретические основы органической химии
вым. Предпосылками к появлению этой теории явились теории радикалов и типов, а также введение фундаментальных понятий химии: атом, молекула, эквивалент.
Сущность этой теории можно сформулировать в виде следующих положений:
1.Атомы, входящие в состав молекулы органического вещества, не находятся в беспорядочном состоянии, а соединены между собой в определенной последовательности химическими связями (согласно валентности этих атомов ).
Последовательность соединения атомов в молекуле А.М. Бутлеров назвал химическим строением.
2.От строения молекул, т. е. от того, в каком порядке соединены между собой атомы в молекуле, зависят свойства вещества.
3.Зная свойства вещества, можно установить его строение, и, наоборот, химическое строение органического соединения может многое сказать о его свойствах.
4.Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние атомов наблюдается в том случае, если они связаны друг с другом непосредственно.
5.Строение молекулы можно выразить при помощи структурной формулы, которая для данного вещества является единственной.
Сегодня сущность этой теории можно выразить так: физические и
химические свойства органических соединений определяются составом их молекул, а также химическим, пространственным и электронным строением.
§ 2. Особенности строения электронных подуровней атома углерода в органических соединениях
При изучении органической химии особый интерес представляет электронное строение атома углерода, как определяющий фактор особых свойств органических соединений.
Строение атома углерода часто рассматривается при изучении раздела «Строение вещества» в курсе «Общая химия». Вспомним, что углерод является элементом II периода, IV группы периодической системы
8
Глава 1. Природа химических связей в органических соединениях
элементов. Два его электрона находятся на внутреннем первом(K) уровне, четыре – на внешнем втором (L) уровне.
В нормальном состоянии К- и L-уровни атома углерода можно описать следующей графической формулой:
2p
C 2s
1s |
|
|
|
L |
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
|
|
|
|
|
|
|
К
Атом углерода в момент образования химической связи переходит из основного состояния(1s22s22p2) в возбужденное (напомним, что его принято условно обозначать С*). При этом происходит распаривание 2sэлектронов и переход одного из них на свободную2р-орбиталь. При таком переходе образуются четыре неспаренных электрона– один 2s и три 2р. Поэтому атом углерода в органических соединениях всегда четырехвалентен:
2p
C* 2s
1s |
|
|
|
L |
|
|
|||
|
К
Связи между атомами в органических соединениях равноценны. Это объясняется теорией гибридизации орбиталей(см. раздел
«Строение вещества»). Для атома углерода возможны три валентных состояния с различными типами гибридизации: sp3-, sp2- и sp.
При sp3-гибридизации происходит смешение одной2s- и трех 2рорбиталей:
9
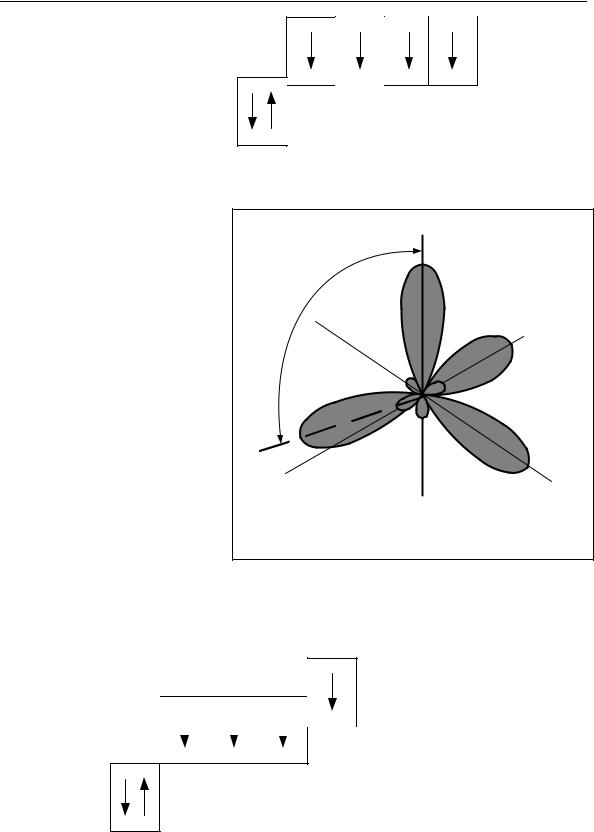
Раздел 1. Теоретические основы органической химии
sp3
|
|
|
|
|
1s |
|
|
||
В результате образуются четыре одинаковые гибридные орбитали, |
|||||||||
имеющие большую электронную плотность по одну сторону ядра. |
|||||||||
Поэтому каждая из гиб- |
|
|
|
||||||
ридных |
|
орбиталей |
|
в |
Y |
||||
большей |
степени |
склон- |
|
|
|||||
на перекрываться с ор- |
|
|
|||||||
биталями |
|
других |
атомов, |
|
109028" |
|
|||
чем |
отдельные «чистые» |
|
|
||||||
|
|
|
|||||||
2s- и 2р-орбитали. Все че- |
|
|
|
||||||
тыре |
гибридные |
орбита- |
|
|
|
||||
ли строго ориентированы |
|
|
|
||||||
в пространстве и созда- |
|
|
|||||||
ют своими утолщенными |
|
|
|
||||||
«лепестками» геометри- |
|
|
|
||||||
ческую |
фигуру – |
тетра- |
|
Z |
X |
||||
эдр, так как они располо- |
|
|
|||||||
|
|
|
|||||||
жены |
относительно |
друг Рис. 1. Электронные орбитали атома углерода |
|||||||
друга |
под |
углом109° 28'. |
|
в первом валентном состоянии |
|||||
Состояние |
углеродного |
||||||||
|
|
||||||||
атома |
с spЗ-гибридными |
орбиталями |
называютпервым валентным |
||||||
состоянием (рис. 1). |
|
|
|
|
|||||
sp2-Гибридизация является результатом смешения одной 2s- и двух |
|||||||||
2р-орбиталей: |
|
|
|
|
|
||||
|
|
|
|
|
|
|
2p |
|
|
sp2 






1s
10
