
himorgsoedinenii
.pdf
Глава 4. Ациклические углеводороды
гих алканов. Для этого обычно используют низкосортные бурые угли, которые измельчают и смешивают с тяжелым маслом(продукт перегонки каменноугольной смолы), а затем обрабатывают водородом при нагревании (450–500 °С) и давлении в присутствии катализатора:
nCO+(2n+1)H2 ¾¾®Сn H2n+2 +nH2O
Так как при этом из твердого угля образуется смесь жидких продуктов, процесс называют сжижением угля. В результате образуется сложная смесь, из которой после фракционирования или дополнительной обработки получают бензины, смазочные масла и другие продукты.
3. Алканы получают из очищенной смеси оксида углерода(II) и водорода (синтез-газ) в присутствии катализаторов (железа, кобальта, никеля или магния) методом Фишера – Тропша:
nC+2nH2 ¾¾¾¾®катализатор Сn H2n+2
4. Гидрирование этиленовых и ацетиленовых углеводородов(катализа-
торы Pt, Pd, Ni):
Pt
H2C=CH2 +H2 ¾¾®H3C-CH3
этилен |
этан |
|
Pt |
H-C º C-H+2H2 ¾¾®H3C-CH3 |
|
ацетилен |
этан |
5. Реакция Кижнера (открыта в Томском технологическом институте на кафедре органической химии, 1912):
R |
|
R |
С |
|
О +H2 N-NH2 ¾¾® СH2 +H2 |
|
||
|
||
R |
|
R |
6. Синтез А. Вюрца-Шорыгина – действие металлического натрия (лития, цинка, магния) на галогенопроизводные (галогеналкилы):
Н3С-I+2Na+I-СН3 ¾¾®Н3 С-СН3 +2NaI
Вслучае использования разных галоидалканов получается смесь всех возможных продуктов реакции, что снижает препаративную ценность реакции.
7. Реакция декарбоксилирования – сплавление солей карбоновых кислот с едкими щелочами:
41

Раздел 2. Углеводороды
Pt
H3C-COONa+NaOH ¾¾®CH4 +Na2CO3
8. Восстановление галогенопроизводных:
Н3С-Cl+Н2 ¾¾®СН4 +HCl
хлорметан
Химические свойства
Для предельных углеводородов характерны два основных типа химических реакций: замещение водорода с разрывом связи С-Н и расщепление молекулы алкана с разрывом связей С-С и С-Н. В реакциях первого типа легче происходит замещение атома водорода, связ нного с третичным углеродным атомом, труднее со вторичным и совсем трудно с первичным. Это можно объяснить, если сопоставить энергии связей С-Н у первичного (около 420 кДж/моль), вторичного (390 кДж/моль) и третичного (370 кДж/моль) атома углерода.
Гомолитические реакции алканов обычно протекают по ради- кально-цепному механизму (Н.Н. Семенов).
I.Реакции замещения.
1.Галогенирование. Замещение водородных атомов на атомы галогена
(реакция галогенирования) – одна из важнейших реакций алканов. В результате такой реакции образуются галогенопроизводные алканов– галогеналкилы. Протекает при освещении УФ-светом (фотохимическое галогенирование) или в темноте при нагревании(250–400 °С), а также в присутствии катализаторов. Рассмотрим реакцию хлорирования метана.
Она протекает с последовательным замещением в молекуле метана всех атомов водорода на хлор:
hν
СН4 + Сl2 ¾¾® СН3Сl + НСl
хлорметан
hν
СН3Сl+Сl2 ¾¾® СН2Сl2 + НСl
дихлорметан
СН2Сl2 +Сl2 |
hν |
+ |
НСl |
¾¾® СНСl3 |
|||
|
трихлорметан |
|
|
|
hν |
+ |
НСl |
СНСl3 +Сl2 ¾¾® ССl4 |
|||
тетрахлорметан
2. Нитрование. При нитровании алкана происходит замена атомов водорода в молекуле на нитрогруппу (N02) с образованием нитросоединений. Такие реакции протекают при повышенной температуре в жидкой или газовой фазе разбавленной азотной кислоте или оксидами азота.
42

Глава 4. Ациклические углеводороды
Впервые реакцию нитрования алканов провел М..ИКоновалов в 1888 году (реакция носит его имя), действуя на алканы разбавленной азотной кислотой (12–14%-й) при нагревании (130–150 °С) и повышенном давлении:
Н3С-СН2 -СН3 +НNO3 ¾¾®H3 C СН СН3
NO2
2-нитропропан
3. Сульфирование. При сульфировании происходит замена атомов водорода в алканах на группуS02Cl (сульфохлорирование) или насульфо-
группу S03H (сульфоокисление).
Реакцию сульфохлорирования алканов проводят при обычной температуре и при облучении УФ-светом, действуя на алканы смесью диоксида серы и хлора. При этом можно получить хлориды алкансульфоновых кислот:
R-H+SO2 +Cl ¾¾®R-SO2Cl+HCl
При сульфоокислении алканы реагируют с S02 в присутствии кислорода с образованием алкансульфоновых кислот:
2R-H+2SO2 +O2 ¾¾®2R-SO3H
II. Реакции расщепления. Данные реакции протекают при высокой температуре и в присутствии катализаторов. В таких условиях происходит гомолитический разрыв связей С-Н и С-С. Термические превращения алканов называются крекингом.
1. Отщепление водорода (дегидрирование алканов) происходит при на-
гревании алканов в присутствии катализатора за счет разрыва связей -С Н. При этом получают непредельные углеводороды:
Н3С-СН2 -СН3 |
Сr О |
; 460 0C |
|
|
2 |
3 |
|
|
|
¾¾¾¾¾¾®H3 C-СН=СН2 |
||||
пропан |
|
-Н2 |
пропилен |
|
|
|
|
||
2. Ароматизация, или дегидроциклизация, алканов характерна для алка-
нов с шестью и более углеродными атомами также при нагревании и в присутствии катализаторов с образованием бензола и его производных. В промышленности этот процесс называют риформингом:
Н3С-СН2 -СН2 -СН2 -СН2 -СН3 ® |
|
|
+4Н2 |
|
|
|
|
43

Раздел 2. Углеводороды
3. Расщепление молекулы алкана за счет разрыва связей С-Спри кре-
кинге приводит к образованию смесей предельных и непредельных углеводородов различного состава. Например, при крекинге бутана можно получить следующие вещества:
 СН3 -СН3 +Н2С=СН2
СН3 -СН3 +Н2С=СН2
 Н2С=СН-СН3 +СН4
Н2С=СН-СН3 +СН4
Н3С-СН2 -СН2 -СН3
 СН3 -СН3 +СН4 +С
СН3 -СН3 +СН4 +С  2СН º СН+3Н2
2СН º СН+3Н2
III. Реакции изомеризации. При нагревании и в присутствии катализаторов (кислоты Льюиса) неразветвленная цепь молекулы алкана состава С4 и более превращается в разветвленную. Это сопровождается разрывом связей С-С:
 Н3С-СН-СН2 -СН3
Н3С-СН-СН2 -СН3
СН3
2-метилбутан
Н3С-СН2 -СН2 -СН2 -СН3
СН3
Н3С-С-СН3
СН3 2,2-диметилпропан
IV. Реакции окисления. Полное окисление (сгорание) алканов можно представить схемой:
Сn Н2n+2 +(3n+1)O ¾¾®CO2 +(n+1)H2O
При сгорании выделяется большое количество энергии. Например, при сгорании 1 кг метана энергия составляет около 55 000 кДж.
Неполное окисление алканов в газовой или жидкой среде(при средних температурах и в присутствии катализаторов) приводит к получению многих кислородсодержащих соединений: спиртов, альдегидов, кетонов и карбоновых кислот:
44

Глава 4. Ациклические углеводороды
[О] |
[О] |
|
альдегиды |
[О] |
карбоновые кислоты |
||
|
|||||||
|
|
[О] |
|||||
алканы ¾¾¾®спирты |
|
|
|
|
кетоны |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отдельные представители
Метан (болотный газ) СН4 – главная составная часть природного(до 98 %) и попутных газов. В значительном количестве присутствует в газах нефтепереработки. Для обнаружения утечки в газопроводах используют некоторые сильно пахнущие -ве щества – одоранты (например, низшие тиоспирты). В смеси с воздухом метан взрывоопасен. Поэтому скопление метана в угольных шахтах(метан называют также рудничным газом) может привести к взрывам. Широко используют в качестве топлива в технике и быту. Является ценным сырьем для химической промышленности. Из него получают ацетилен, галогенопроизводные, метанол, формальдегид и другие вещества.
Этан, пропан, бутан и пентаны применяют для получения непредельных соединений соответственно этилена, пропилена, дивинила и изопрена. Пропан в смеси с бутаном используют в качестве топлива(бытовой сжиженный газ, транспортируемый в баллонах).
Изооктан C8H18 (2,2,4-триметилпентан) – ценная составная часть высококачественного горючего (бензина) для двигателей внутреннего сгорания.
Средние члены гомологического ряда метана С7-С17 используют как растворители и моторное топливо.
Высшие алканы (парафины) С18-С44 применяют для производства высших кислот и спиртов, синтетических жиров, смазочных масел, пластификаторов и непредельных соединений. К высшим алканам относитсяозокерит (горный воск), в основном состоящий из твердых алканов с разветвленной цепью углеродных атомов, число которых превышает 25–30.
§ 14. Алкены
Алкены, или олефины, – алифатические углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. Они содержат в своей молекуле меньшее количество водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными, или не-
насыщенными.
Общая формула ряда алкенов: Сn H2n . Простейшим представителем алкенов является этилен С2Н4. По номенклатуре ИЮПАК название алкенов производят от соответствующих названиюалканов, заменяя окончание «ан» на «ен» и цифрой указывая положение двойной связи, например: этан – этен (этилен), пропан – пропен (пропилен), бутан – бутен.
45
Раздел 2. Углеводороды
Строение и изомерия
В молекулах алкенов атомы углерода, образующие двойную связь, находятся во втором валентном состоянии, . е. в состоянии sр2- гибридизации. Строение молекулы этилена можно выразить структурной
(I) и электронной (II) формулами:
H |
H |
H |
H |
C C |
|
H C |
C |
H |
H |
||
H |
|
II |
|
I |
|
|
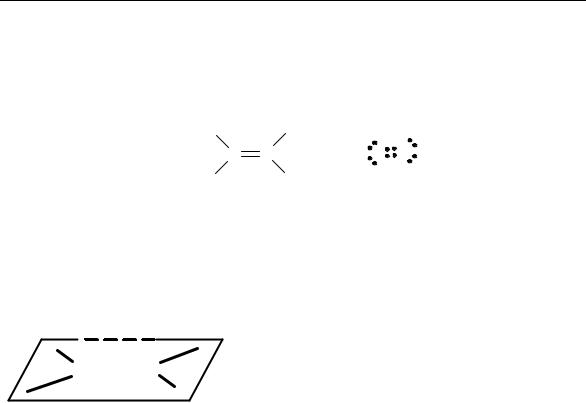
Вмолекуле этилена имеется шесть связей: пять σ-связей (одна С-С
ичетыре С-Н) и одна π-связь. Их расположение показано на рис. 5.
|
|
|
|
|
|
Длина и энергия двойной связи рав- |
|||||
|
|
π |
|
|
|
||||||
|
|
|
|
|
ны |
соответственно: 0,134 нм и 610 |
|||||
|
|
|
|
|
|
||||||
H σ |
|
|
|
σ |
H |
кДж/моль. |
|
|
|
||
|
σ |
|
|
Для |
алкенов |
характерны |
два |
||||
σ C |
C σ |
|
вида изомерии: структурная и про- |
||||||||
|
|
||||||||||
H |
|
|
|
H |
|
странственная. |
|
|
|||
|
|
π |
|
|
|
|
Структурная |
изомерия связа- |
|||
|
|
|
|
|
на |
со строением |
углеродной |
цепи |
|||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
(изомерия |
углеродного скелета) |
и |
|||
Рис.5. Схема расположения связей |
|||||||||||
положением двойной связи в этой |
|||||||||||
в молекуле этилена |
|||||||||||
|
|
|
|
|
|
цепи (изомерия положения). Первые |
|||||
два члена гомологического ряда алкенов– этилен и пропилен – изоме-
ров не имеют. Для углеводорода С4Н8 |
возможны три изомера: |
||||
H2C=CH-CH2 -CH3 |
H C-CH=CH-CH |
H |
C=C-CH |
||
|
3 |
3 |
2 |
|
CH3 |
|
|
||||
бутен-1 |
бутен-2 |
|
|
|
|
|
2-метилпропен-1 |
||||
Первые два изомера различаются между собой положением двойной связи в углеродной цепи, а третий – характером цепи (изостроение).
Пространственная изомерия алкенов представлена геометрической, или цис-, транс-изомерией. Например, для бутена-2 возможно два стереоизомера:
46

Глава 4. Ациклические углеводороды
Н |
Н |
Н |
СН3 |
С=С |
|
|
С=С |
Н3С |
СН3 |
Н3С |
Н |
цис-бутен-2 транс-бутен-2
Физические свойства
Физические свойства алкенов по существу такие же, как свойства алканов. Они нерастворимы в воде, но хорошо растворимы в неполярных растворителях, таких как бензол, эфир, хлороформ. Их плотность меньше плотности воды и колеблется от0,6 до 0,8 (г/мл). В гомологическом ряду она увеличивается. Алкены с числом атомов углерода от2 до 4 – газы, от С5 до С17 – жидкости, далее идут твердые вещества. Температуры кипения олефинов повышаются с увеличением содержания углерода примерно на 20–30 °С при увеличении цепи на один углеродный атом. Разветвление понижает температуру кипения. Цис-изомеры обычно кипят при более высокой температуре, чем транс-изомеры. Перемещение двойной связи в центр молекулы вызывает повышение температуры плавления. Трансизомеры плавятся при более высокой температуре, чем цис-изомеры.
Способы получения
Вприроде алкены встречаются редко. Газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля(коксовый газ). Для получения низкомолекулярных алкенов(С2–С5) используют также пиролиз (700–800 °С) газообразных алканов, выделенных из природного, попутного газов и газов, полученных при переработке нефти. При этом выход алкенов, главным образом, этилена и пропилена составляет около
50 %.
Впромышленности алкены получают дегидрированием алканов в присутствии катализатора (Сr203). Например:
Н2С=СН-СН2 -СН3
бутен-1
Н3С-СН2 -СН2 -СН3 -Н2 бутан
Н3С-СН=СН-СН3 бутен-2
47

Раздел 2. Углеводороды
Из лабораторных способов получения алкенов можно отметить следующие.
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи (реакция элиминирования):
Н2С СН2 ¾¾®Н2С=СН2 +КС l+Н2 О
НСl
НО К
2. Гидрирование ацетилена в присутствии катализатора (Pd):
Рd
Н-С º С-Н+Н2 ¾¾®Н2С=СН2
3. Дегидратация спиртов. В качестве катализатора используют кислоты (серную или фосфорную) или А1203 при нагревании (350–400 °С):
Н2С |
|
СН2 |
¾¾¾®Н2С=СН2 |
||
|
|||||
|
|
|
|
|
-Н2О |
|
|
|
|
|
|
|
|
|
|
|
|
Н ОН
этиловый спирт
В этих реакцияхводород отщепляется от наименее гидрогенизиро-
ванного (с наименьшим числом водородных атомов) углеродного атома (правило A.M. Зайцева). Например:
Н ОН
Н3С-С-СН-СН3 ¾¾¾®Н3С-С=СН-СН3
-Н2О
СН3 |
СН3 |
3-метилбутанол-2 |
2-метилбутен-2 |
Химические свойства
Алкены, в отличие от алканов, обладают высокой химической активностью. Их свойства определяются двойной углерод-углеродной связью. Наиболее типичны для них реакции присоединения, причем большинство являются реакциямиэлектрофильного присоединения и протекают по гетеролитическому типу.
I.Реакции присоединения.
1.Гидрирование. Алкены, присоединяя водород под давлением и в присутствии катализаторов (Pt, Pd, Ni), переходят в предельные углеводороды– алканы:
48

Глава 4. Ациклические углеводороды
Pt
H2C=CH2 +H2 ¾¾®H3C-CH3
Легче гидрируются те алкены, в молекулах которых при двойной связи меньше заместителей (правило С. В. Лебедева).
2. Гидратация (присоединение воды). В присутствии катализаторов
(конц. H2S04, ZnCl2) к алкенам присоединяется вода(по правилу Марковникова) с образованием спиртов:
Н3С-СН=СН2 |
+ Н-ОН ¾¾® Н3 С-СН-СН3 |
|
|
|
|
|
ОН |
|
пропилен |
изопропиловый спирт |
|
3. Галогенирование. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных:
Н2С=СН2 +Сl2 ¾¾®СlСН2 -СН2 Сl 1,2-дихлорэтан
Галогенирование протекает быстрее с алкенами, которые имеют заместители у двойной связи. Присоединение галогенов в зависимости от условий реакции может проходить как по ионному, так и по радикальному механизмам.
4. Гидрогалогенирование (присоединение галогеноводородов). Алкены легко присоединяют галогеноводороды:
H2C=CH2 +HBr ¾¾®H3C-CH2Br
Как и реакции присоединения галогенов, гидрогалогенирование в зависимости от условий реакции может проходить как по ионному, так и по радикальному механизмам. B.B. Марковников (1837– 1904), изучая эти реакции, установил следующую закономерность, которая носит его имя– правило Марковникова: при ионном присоединении(при
обычных условиях) галогеноводородов к несимметричным алкенам водород присоединяется по мес-
ту двойной связи к наиболее гидрогенизированному
 (связанному с наибольшим числом атомов водорода) атому углерода, а галоген – к наименее гидрогенизированному.
(связанному с наибольшим числом атомов водорода) атому углерода, а галоген – к наименее гидрогенизированному.
Если же реакция идетпо радикальному механизму(в присутствии пероксидных соединений или кислорода), то порядок присоединения может быть обратным. Такое исключение из правила Марковникова бы-
49

Раздел 2. Углеводороды
ло установлено М. Харашем (1933 г.) и названо пероксидным эффектом, или эффектом Хараша. Так, гидрогалогенирование пропена по гетеролитическому механизму протекает по схеме 1, по гомолитическому механизму – по схеме 2:
Н3С-СНBr-СН3 (1)
НBr
Н3С-СН=СН2
Н3С-СН2 -СН2Br (2)
5. Присоединение серной кислоты(образование алкилсерных кислот).
Реакция протекает при пропускании газообразного алкена через концентрированную серную кислоту или при перемешивании алкена с кислотой. Присоединение кислоты идет по правилу Марковникова с образованием связи углерод-кислород:
Н3С-СН=СН2 + |
НО |
|
|
|
|
SО |
2 |
¾¾® Н |
С- |
СН-СН |
|
|
НО |
3 |
|
3 |
|
|
|
|
ОSО3Н |
||
|
|
|
|
||
|
|
|
изопропилсерная кислота |
||
II. Алкилирование алкенов алканами.
Алкилирование – реакция, с помощью которой можно вводить различные углеводородные радикалы (алкилы) в органические соеди-
нения. Реакции протекают в присутствии кислот(серной или фосфорной) с удлинением углеродной цепи. При этом часто образуются алканы с изостроением, имеющие большое значение как высокооктановое топливо для двигателей внутреннего сгорания. Например:
|
|
|
|
|
СН3 |
|
|
|
|
|
СН3 |
Н2SO4 |
|
|
|
СН3 |
|
|
СН3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Н |
С |
|
СН |
|
|
С |
|
СН¾¾¾¾® Н3С |
|
С |
|
СН2 |
|
СН |
|
СН3 |
|||||||||
3 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
изобутилен |
|
|
СН3 |
|
|
|
|
|
||||||||||||
изобутан |
изооктан (2,2,4-триметилпентан) |
||||||||||||||||||||||||
50
