
himorgsoedinenii
.pdf
Глава 2. Теория органических соединений
веществам, относящимся к разным классам органических соединений– диметиловому эфиру СН3-О-СН3 и этиловому спирту СН3-СН2-ОН.
Изомерия положения обусловлена различным положением функциональной группы или кратных связей при одинаковом углеродном скелете молекул. Так, пропану соответствуют два изомерных спирта– н-пропиловый и изопропиловый:
СН3 СН2 СН2 ОН СН3 СН СН3
н-пропиловый спирт
ОН
изопропиловый спирт
Для углеводорода бутена известно два изомера, для которых характерна изомерия положения двойной связи:
СН2 |
|
СН |
|
СН2 |
|
СН3 СН3 |
|
СН |
|
|
СН |
|
СН3 |
|
|
|
|
|
|
|
|||||||
|
|
бутен-1 |
|
бутен-2 |
|||||||||
Структурные изомеры отличаются друг от друга химическими и физическими свойствами и могут быть разделены на этой основе обычными методами.
Пространственная изомерия подразделяется на два вида:
1)геометрическую изомерию;
2)оптическую изомерию.
Геометрическая изомерия свойственна соединениям, содержащим двойные связи (С=С , С=N, N=N). В таких соединениях невозможно свободное вращение заместителей вокруг двойной связи и для этого необходим разрыв π-связи.
Изомер, у которого заместители находятся по обе стороны от плоскости двойной связи, называется транс-изомером, если по одну сторону – цис-изомером:
Н |
Н |
Н |
СН3 |
|
С=С |
|
С=С |
Н3С |
СН3 |
Н3С |
Н |
цис-бутен-2 |
транс-бутен-2 |
||
Цис- и транс-изомеры отличаются по химическим и физическим свойствам и легко разделяются обычными методами.
Оптическая изомерия свойственна молекулам органических - ве ществ, не имеющим плоскости симметрии (плоскости, разделяющей
21

Раздел 1. Теоретические основы органической химии
молекулу на две зеркально тождественные половины) и не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению). Оптическая изомерия является важным свойством органических соединений, оказывающим существенное влияние на их свойства. Например, такие природные соединения, как углеводы, белки, оптически активны. Оптическая изомерия в химии является частным случаем проявления общего свойства природы – симметрии. Правая и левая руки, правая и левая половины листа, тела характерны тем, что пары – объект и его зеркальное отражение – не совместимы друг с другом.
Оптические изомеры – пространственные изомеры, имеющие одинаковый количественный и качественный состав, одинаковое химическое строение, идентичные по всем физическим и химическим свойствам, но отличающиеся оптической активностью – способностью вращения плоскополяризованного света и образования при кристаллизации кристаллов, являющихся зеркальными отражениями друг друга.
Оптическая активность обусловлена наличием в молекулехираль-
ного центра – асимметричного атома углерода, т. е. атома углерода, связанного с четырьмя различными заместителями.
Энантиомеры – оптические антиподы, содержащие любые пары объекта и его изображения, несовместимые друг с другом. Соеди-
нение называется хиральным, если оно существует в виде пары энантиомеров. Примером может служить молочная кислота(асимметриический атом углерода отмечен звёздочкой) CH3C*H(OH)COOH. Согласно тетраэдрической модели атома углерода, заместители располагаются в углах правильного тетраэдра, в центре которого находится атом углерода:
НООС Зеркало СООН
С |
|
|
СН3 |
|
|
Н3С |
С |
|
|
||||||
Н |
|
|
|
ОН |
НО |
|
Н |
Из приведенных формул видно, что молекула молочной кислоты ни при каком перемещении в пространстве не может совпасть со своим - зер
22

Глава 2. Теория органических соединений
кальным отображением. Эти две формы кислоты являются энантиомерами.
Все химические свойства оптических антиподов идентичны; одинаковы и их физические свойства, за исключением оптической активности: одна форма вращает плоскость поляризации света влево[l- или (–)- форма], другая – на тот же по величине угол вправо[d- или (+)-форма]. Из этого следует, что две формы одного и того же вещества с противоположными знаками вращения имеютзеркально-противоположные конфигурации.
Рацемат, или рацемическая смесь, – эквимолекулярная смесь энантиомеров, не обладающая оптической активностью вследствие внутренней взаимной компенсации; обозначается (±). Рацемиче-
ские соединения могут быть расщеплены на оптические антиподы. Для этого обычно используют реакции с оптически активными веществами.
Диастереомеры – пространственные изомеры, не являющиеся энантиомерами, то есть зеркальными изображениями друг друга; отличаются друг от друга физическими и химическими свойствами.
В таких изомерах конфигурации одного асимметричного центра противоположны, а другого – совпадают. Так формы молекул молочной кислоты, представленные ниже, являются диастереомерами. Это связано с тем, что они не являются зеркальными изображениями друг друга:
НООС |
Зеркало |
СООН |
С |
|
|
СН3 |
|
|
Н3С |
С |
|
|
||||||
Н |
|
|
|
ОН |
Н |
|
НО |
Изомеры также по своему поведению в обычных условиях могут относиться к статическому или динамическому ряду.
Статические изомеры устойчивы, могут быть выделены и существуют в индивидуальном виде, что обусловлено значительным энергетическим барьером между ними. Взаимопереход связан с разрывом ковалентной связи, прочность которой значительно превосходит возможность «теплового» движения атомов в молекуле. Все рассмотренные выше виды изомеров относятся к статическому ряду.
Динамические изомеры находятся в равновесии, скорость взаимоперехода изомеров такова, что их невозможно выделить в индивиду-
23

Раздел 1. Теоретические основы органической химии
альном виде. Энергетические барьеры между такими изомерами столь малы, что легко преодолеваются тепловым движением атомов в молекуле.
Для структурных изомеров динамического ряда характерно -рас пространенное в органической химии явление таутомерии.
Таутомерия – обратимая структурная изомеризация молекул органических веществ.
Она возможна при переносе подвижного водорода(карбонильные соединения, амины, амиды и др.), внутримолекулярных взаимодействиях (углеводы), валентных превращениях:
|
|
|
ОН |
Н3С |
|
О |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
СН2 |
|
|
С |
|
|
|
|
С |
|
N |
ОН |
|
|
N |
О |
|||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
Н |
|
|
|
|||||||||
|
|
|
Н |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
2-гидроксипиридин |
|
|
Н |
|
|||||||||
виниловый спирт |
ацетальдегид |
|
|
2-пиридон |
|
|||||||||||||
|
|
|
|
|
а |
|
|
|
|
|
|
|
б |
|
||||
Пары соединений а и б являются таутомерами и относятся к динамическому ряду структурных изомеров.
К динамическому ряду пространственной изомерии относят конформационную изомерию. Конформационная изомерия обусловлена ограниченным вращением в молекуле атомов или групп атомов вокруг углерод-углеродной (или любой другой) простой связи.
Геометрические формы, которые принимает при этом молекула, называются конформациями, а соответствующие структуры – конформерами (конформационными, вращательными, или поворотными изомерами).
Теоретически молекула может принимать бесчисленное множество конформаций, однако реализуются обычно немногие, выгодные энергетически. Конформации могут быть изображены разными способами – с помощью перспективных формул и/или с помощьюпроекций Ньюмена. Так, перспективные формулы двух конформаций этана выглядят следующим образом:
24

Глава 2. Теория органических соединений
|
Н |
Н |
|
Н |
|
|
|
||
|
Н |
|
Н |
Н |
|
Н |
|
Н |
|
Н |
Н |
Н |
б |
Н |
|
а |
|
|
Формулы Ньюмена для этих же конформаций этана имеют вид:
Н |
Н Н |
НН
Н |
Н |
Н |
Н |
Н |
|||
|
Н |
|
Н |
|
|
г |
|
|
в |
|
Формула в соответствует заторможенной конформации молекулы, а г – заслоненной конформации. Заторможенная конформация обладает
минимальной энергией, заслоненная – максимальной. Так, из всех возможных конформаций этана энергетически наиболее выгодна заторможенная конформация (в), наименее – заслоненная (г). Это связано с тем, что в заслоненной конформации молекулы этана расстояния между однородными атомами минимальны, а в заторможенной – максимальны.
§ 7. Графическое изображение органических соединений
Так как в органической химии молекулярные формулы не отражают сущность химической связи в веществе, то для изображения органических соединений используют структурные формулы.
Структурные формулы (формулы строения) – изображения органических соединений с помощью символов для элементов и черточек для обозначения химических связей.
Структурные формулы наглядно показывают последовательность соединения атомов в молекуле с учетом их валентности и химической природы (химических свойств). В органических соединениях валентность атома углерода равна 4. Следует отметить, что валентность водорода равна 1, кислорода-2, галогенов-1. Азот, сера и фосфор в органических веществах могут находиться в разных валентных состояниях. Число черточек у элемента соответствует его валентности.
25
Раздел 1. Теоретические основы органической химии
|
|
Н |
|
Н |
|
Н |
|
|
ОН |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|
|
|
СН3 СН3 |
СНОН |
|
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН |
|
||||||
Н |
|
С |
|
С |
|
|
С |
|
Н |
|
|
|
|||||||||
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
О |
|
Н Н |
|
|
б |
в |
|||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изопропиловый спирт |
|
|
|
||||
СН НС
 СН
СН
НС 
 СН СН
СН СН
г |
д |
бензол
Рис. 4. Структурные формулы некоторых органических соединений
Возможна полная (рис. 4 а) или сокращенная запись(рис. 4 б, в) структурных формул соединений. В изображениях циклических соединений начертания символов углерода и водорода часто опускают, но при этом их присутствие подразумевается(рис. 4 г, д). Нельзя забывать, что любая, даже очень удачная структурная формула есть всего лишь абстрактный образ молекулы. Она не является точным отображением реальной структуры. Поэтому нельзя отождествлять символ молекулы – формулу – с реально существующей молекулой.
§ 8. Взаимное влияние атомов в молекулах органических соединений
Взаимное влияние атомов в молекуле связано прежде все с перераспределением в ней электронной плотности. Это перераспределение может осуществляться при помощи двух электронных эф-
фектов – индуктивного эффекта и эффекта сопряжения.
Индуктивный эффект (I) – эффект, связанный со смещением электронной плотности вдоль δ-связей под влиянием атомов или групп, различных по электронной природе.
Этот эффект является простейшей формой проявления взаимного влияния атомов в молекуле. Следует отметить, что индуктивный эффект – влияние быстро затухающее.
26

Глава 2. Теория органических соединений
В симметричной молекуле, состоящей из схожих по электроотрицательности атомов, электронная плотность распределена равномерно. Но под влиянием реагента в такой молекуле может происходить частичное смещение электронного облака. Особенно это заметно в случае несимметричного строения молекул(например, R=-СН=СН2 ). Если же в молекуле атомы значительно отличаются по электроотрицательности, то смещение электронной плотности происходит в сторону атома(группы) с большей электроотрицательностью. В результате этого δ-связь поляризуется, оказывая влияние на соседние связи.
Если смещение электронной плотности происходит по цепи в сторону заместителя, то такой эффект называют отрицательным (–I).
Если атом (или группа) смещает электронную плотность в сторону цепи (от себя), то индуктивный эффект будет положительным (+I).
Изображается данный эффект обычно стрелкой, направленной по оси связи:
δ |
+ |
δ |
+ |
δ |
+ |
δ- |
δ - |
δ - |
δ+ |
|
3 |
|
2 |
1 |
|
CH3 ¬ CH2 ¬ Li |
|||
CH3 ® CH2 ® CH2 ® Cl |
|||||||||
|
|
|
|
a |
|
|
|
|
б |
В молекуле пропилхлорида(а) заместитель Cl вызывает отрицательный индуктивный эффект (–I), т. к. он является электроноакцептором (более электроотрицателен, чем углерод). В молекуле этиллития (б) заместитель Li вызывает положительный индуктивный эффект (+I), т. к. он является электронодонором(более электроположителен, чем углерод).
По мере удаления от атома(или группы атомов), вызывающего смещение электронной плотности, влияние индуктивного эффекта в насыщенных системах быстро ослабевает. Так в молекуле пропил-
хлорида (а) доля частичного заряда δ+ , характеризующего электронную недостаточность, уменьшается: δ1+ >δ+2 >δ3+ . В молекуле этиллития(б)
так же доля частичного заряда δ- уменьшается : δ1- >δ-2
В табл. 2 перечислены заместители, вызывающие отрицательный и положительный индуктивные эффекты в молекулах органических -со единений.
27

Раздел 1. Теоретические основы органической химии
Таблица 2
Функциональные заместители, вызывающие индуктивный эффект
Отрицательный индуктивный эф- |
Положительный индуктивный |
фект (–I) |
эффект(+I) |
Галогены: -F,-Cl,-Br,-I; -OH; -OR; |
Металлы; алкилы; -О- ; -NH-; |
-NH2; -NR2; -NO2; -C≡N; -C(R)=O; |
-С-R2(карбанионы) |
-COOH; -SH; -SR; -SO3H; -CHCl2; |
|
-CCl3; -CH=CH2; -C≡CH; -C6H5 |
|
Индуктивный эффект оказывает большое влияние на свойства органических соединений и направление химических реакций.
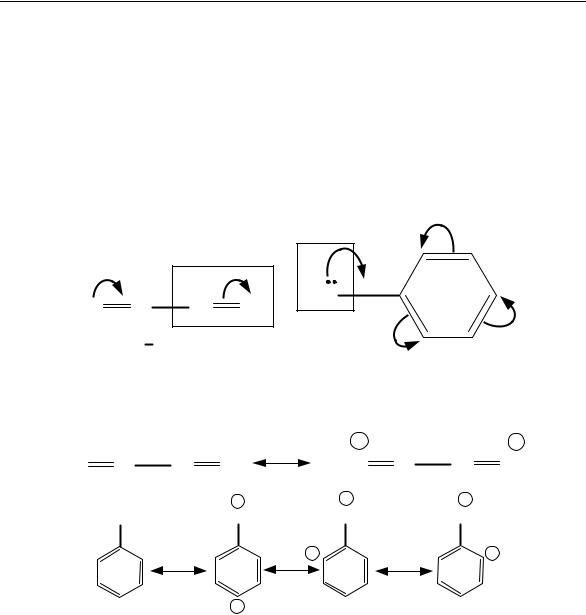
Мезомерный эффект (М), или эффект сопряжения (С), – тип электронного влияния, возникающий в молекулах с сопряженными двойными связями, содержащих электронодонорные или электроноакцепторные заместители.
Этот эффект возникает за счет смещения π-электронного облака вдоль системы с образованием на противоположных концах такой системы, равных по величине, но различных по знаку частичных зарядов. В отличие от индуктивного эффекта, мезомерный может передаваться по цепи сопряжения на более дальние расстояния.
Функционльные группы, смещающие π-электронную плотность в сторону системы, проявляют положительный ме-
зомерный эффект (+М). Такие группировки имеют неподеленные пары электронов или отрицательный заряд.
Фукциональные группы, смещающие π-электронную плотность в свою сторону, обладают отрицательным мезомерным эф-
фектом (–М). Такие группировки имеют кратные связи. В табл. 3 приведены заместители, вызывающие отрицательный и положительный мезомерные эффекты.
Таблица 3
Функциональные заместители, вызывающие мезомерный эффект
Отрицательный мезомерный |
Положительный мезомерный |
эффект (–М) |
эффект (+М) |
-NO2, -C≡N, -C(R)=O, -COOH, |
Галогены: F,Cl,Br,I; -OH, -OR, |
-SO3H, -C+R2(карбкатионы) |
-NH2, -NR2, -SH, -SR, |
28
Глава 2. Теория органических соединений
Сопряжение связей в нереагирующей молекуле называют статическим эффектом сопряжения. При взаимодействии моле-
кулы, имеющей систему сопряженных связей, с атакующим реагентом происходят глубокие изменения в этой системе, связанные с перераспределением электронной плотности. В этом случае прояв-
ляется динамический эффект сопряжения.
Мезомерные эффекты изображают при помощи изогнутых стрелок, которые обозначают направление смещения электронов в результате сопряжения:
δ-
δ |
+ |
|
δ- |
δ+ |
|
Н |
H2N |
||||
Н2С |
Н |
О |
|||
С |
С |
|
|||
|
|
М |
|
+M |
|
|
|
|
|
δ- |
Также применяется изображение мезомерных эффектов с помощью резонансных структур:
Н |
Н |
+ |
Н |
Н |
- |
|
|
||||
Н2С С |
С О |
Н2С С |
С О |
||
|
+ |
+ |
|
+ |
|
NH2 |
NH2 |
NH2 |
|
NH2 |
|
|
|
- |
|
|
- |
-
Резонансные структуры разделяются между собой обоюдоострыми стрелками. Каждая из написанных резонансных структур показывает результат полного сопряжения, т. е. полного сдвига электронов без какого-либо перемещения атомов в молекуле.
§ 9. Кислотно-основные свойства органических соединений
Рассмотрение кислотных и основных свойств веществ проводят в рамках следующих теорий: электролитической диссоциации Аррениуса, протолитической Бренстеда – Лоури и теории Льюиса.
29

Раздел 1. Теоретические основы органической химии
Согласно классическому определению .САррениуса, кислоты –
это вещества, которые в водной среде при диссоциации отщепляют Н+, а основания – вещества, которые в тех же условиях отдают ОН.
Теория электролитической диссоциации хорошо объясняет свойства неорганических и простых органических кислот и оснований в водных растворах, однако огромное число кислотно-основных взаимодействий в неводных растворах остается вне этой теории.
Более общее определение кислот и оснований было предложено в 1923 г. Й. Бренстедом и Г. Лоури. Согласно их протолитической теории,
кислоты в любых растворах являются донорами протонов, основания в любых растворах – акцепторам протонов. Например, в реакции
NH3 +НСl ® NH4Cl газообразный хлороводород – кислота, а газообразный аммиак – основание, так как первое соединение отдает свой водород в виде протона, а второе – связывает его свободной парой электронов.
По определению Й. Бренстеда, любое соединение можно рассматривать как потенциальную кислоту, если оно с отщеплением протона превращается в сопряженное данной кислоте основание:
Кислота А ¬¾¾¾®Основание В+Н+
Справедливо и обратное утверждение: вещество, присоединившее протон, можно рассматривать как сопряженную данному основанию кислоту:
Основание В+Н+ ¬¾¾¾®Кислота А Вот некоторые примеры таких пар сопряженных кислот и оснований:
|
Кислота А |
Основание В |
|
|
|
|
|
||||||||
|
|
СН |
-СООН ¾¾®Н |
+ +СН -СОО- |
|
|
|
|
|
||||||
3 |
¬¾ |
|
3 |
|
О |
|
|
||||||||
|
+ ОН |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
¾¾¾® |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CН3 C |
|
CН3 ¬¾¾ |
Н |
+СН3 |
C |
|
CН3 |
||||||||
+
CH3NH3 ¬¾¾¾¾®CH3 NH2 +H+
Эти сопряженные пары отличаются тем, что левая часть (кислота А) содержит на один протон больше, а правая (основание В) – на протон меньше.
В органической химии, как и в неорганической, широко использу-
ют понятие константы диссоциации (константы кислотности) Ка :
Н-Х¬¾¾¾¾®Н+ +Х-
30
