
himorgsoedinenii
.pdf
Глава 4. Ациклические углеводороды
III. Реакции изомеризации. При нагревании или в присутствии катализаторов алкены способны изомеризоваться с перемещением двойной связи или с изменением строения углеродного скелета:
Н3С-СН=СН-СН3
бутен-2
Н2С=СН-СН2 -СН3
Н2С-С=СН2
СН3 2-метилпропен-1
IV. Реакции полимеризации. Вследствие разрыва π-связей молекулы алкена могут соединяться друг с другом, образуя макромолекулы с высокой молекулярной массой:
nCH2 =CH2 ® [-CH2 -CH2 -]n
этилен полиэтилен
V. Реакции окисления. Алкены окисляются легче, чем алканы. Продукты окисления алкенов зависят от их строения и от условий проведения реакции окисления.
А. При действии на этиленводного раствора КМn04 при незначительном охлаждении в слабощелочной средепроисходит образование двухатомного спирта – этиленгликоля (реакция Е.Е. Вагнера):
3Н2С=СН2 +2КМnО4 +4Н2О ¾¾®3НОСН2 -СН2ОН+2МnО2 +2КОН
Эта реакция являетсякачественной: фиолетовая окраска раствора КМп04 переходит в бурую при добавлении к нему непредельногосо единения.
При действии на этиленводного раствора КМn04 при нагревании
двойная связь разрывается:
Н2С=СН2 +4КМnО4 ¾¾®2СО2 +4МnО2 +4КОН
Б. Расщепление молекулы алкена по месту двойной связи вызывают и более энергичные окислители(например, кислый раствор КМп04, хромовая смесь, HN03):
СН3 -СН=СН-СН3 +2О2 |
¾¾®2Н3 С-СООН |
бутен-2 |
уксусная кислота |
51

Раздел 2. Углеводороды
В. При окислении этилена кислородом воздуха в присутствии металлического серебра образуется оксид этилена:
3500С
2Н2С=СН2 +2О2 ¾¾¾¾®2H2 C-CН2
Аg
О
оксид этилена
Г. Процесс энергичного и полного окисления на воздухе(горение) этилена выражают следующим уравнением:
Н2С=СН2 +3О2 ¾¾®2СО2 +2Н2О
Отдельные представители
Алкены широко используются в качестве мономеров для получения многих высокомолекулярных материалов.
Этилен находит широкое применение в получении различных органических веществ: этилового спирта, стирола, различных галогенопроизводных, оксида этилена, этиленгликоля, полиэтилена.
Пропилен служит сырьем для получения изопропилбензола(кумола), ацетона, фенола, глицерина, изопропилового спирта, полипропилена, синтетического каучука и других ценных органических продуктов.
Бутен-1 применяют для получения дивинила, а бутен-2 – в качестве среды при полимеризации дивинила. Из изобутилена получают изооктан, изопрен и полиизобутилен.
§ 15. Алкадиены
Алкадиены (диеновые углеводороды, или диолефины) – непредельные органические соединения, содержащие в молекуле две двойные связи.
Молекулы диеновых углеводородов содержат на два атома водорода меньше, чем молекулы алкенов. Поэтому общая формула диеновых углеводородов: Сn H2n-2 . В молекулах диеновых углеводородов две двойные связи могут находиться в разных положениях относительно друг друга. Ес-
ли они расположены рядом, то их называют кумулированными (I), если же они разделены одной простой σ-связью, то – сопряженными, или конъюгированными (II); двойные связи, разделенные двумя или несколькими про-
стыми связями, называют изолированными (несопряженными) (III):
Н2С=С=СН2 |
Н2С=СН-СН=СН2 |
Н2С=СН-СН2 -СН2 -СН=СН2 |
I |
II |
III |
52
Глава 4. Ациклические углеводороды
Строение и изомерия
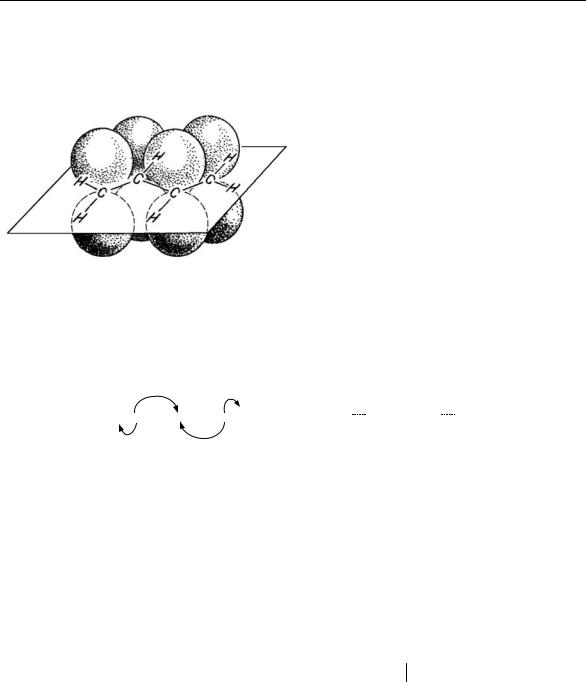
Типичным примером соединения с сопряженными двойными связями является бутадиен-1,3. В молекуле бутадиена все атомы углерода находятся в состоянии sр2-гибридизации, они лежат в одной плоскости.
|
Четыре |
параллельные |
друг другу |
|
|
орбитали π-электронов перпенди- |
|||
|
кулярны плоскости, в которой ле- |
|||
|
жат ядра атомов углерода (рис. 6). |
|||
|
При взаимодействии |
подвижных |
||
|
π-электронных облаков двух |
-со |
||
|
пряженных связей возникает еди- |
|||
|
ное π-электронное облако, охваты- |
|||
Рис. 6. Строение бутадиена |
вающее |
все |
четыре |
атома |
|
углерода. Отдельные |
π-электроны |
||
не закреплены попарно в определенных связях, а делокализованы, т. е. |
||||
распределены по всей сопряженной системе, по всем находящимся в |
||||
сопряжении связям, и простым, и кратным: |
|
|
|
|
Н |
С = СН - СН = СН |
Н2С |
|
СН |
|
СН |
|
СН2 |
|
|
|
||||||
2 |
2 |
|
|
|
|
|
|
|
Взаимодействие двух соседних π-связей способствует процессу взаимного влияния атомов в этой системе(эффект сопряжения) и снижению общей энергии молекулы. Благодаря этому диены с сопряженными двойными связями – довольно устойчивые соединения.
По систематической номенклатуре диеновые углеводороды называют, как и этиленовые, но заменяют суффикс -ен на -диен (две двойные связи). Нумерацию углеродных атомов производят так, чтобы сумма цифр, обозначающих положение двойных связей, была наименьшей:
1 |
2 |
3 |
4 |
5 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Н2C=СН-CН=СН-СН3 Н2C-СН=СН-С=СН-СН2 -СН3
пентадиен-1,3 |
CН3 |
4-метилгептадиен-2,4 |
В систематической номенклатуре сохраняются такие тривиальные названия, как аллен (пропадиен-1,2), дивинил (бутадиен-1,3), изопрен (2- метилбутадиен-1,3).
Для диенов характерна изомерия положения двойных связей в -уг леродной цепи и строения углеродного скелета. Например, для диена с молекулярной формулой С5Н8 возможны следующие изомеры:
53

Раздел 2. Углеводороды
Н2С= |
|
С-СН=СН2 |
Н3С-С=С=СН2 |
|
Н3С-СН=С=СН-СН3 |
||
|
|
||||||
|
CН3 |
|
CН3 |
|
пентадиен-2,3 |
||
2-метилбутадиен-1,3 |
3-метилбутадиен-1,2 |
||||||
Н2С=СН-СН2 -СН=СН2 |
Н |
С=С=СН-СН -СН |
Н |
С=СН-СН=СН-СН |
|||
|
|
|
2 |
2 |
3 |
2 |
3 |
пентадиен-1,4 |
|
пентадиен-1,2 |
|
|
пентадиен-1,3 |
||
Физические свойства
Для алкадиенов прослеживаются общие закономерности физических свойств, характерные для гомологического ряда алкенов.
Способы получения
1. Основным промышленным способом получения дивинила(бутадие- на-1,3) и изопрена (2-метилбутадиена-1,3) является дегидрирование соответствующих бутан-бутиленовых или изопентан-амиленовых(пенти- леновых) смесей, выделяемых из продуктов нефтепереработки, над катализатором (Сr203):
|
|
|
|
|
|
|
|
Н2С=СН-СН2 -СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бутен-1 |
|
|
650 0С |
|
||
Н3С-СН2 |
-СН2 |
-СН3 |
600 0С |
|
|
|
|
Н2С=СН-СН=СН2 |
||||||
|
|
-Н2 |
|
|
|
|
|
|
|
-Н2 |
||||
|
бутан |
|
|
|
|
|
|
|
|
|
дивинил |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Н3С-СН=СН-СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бутен-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
600 0С |
|
|
|
|
|
|
|
|
Н3С- |
|
СН-СН2 |
-СН3 ¾¾¾¾®Н2 |
С |
|
=С-СН=СН2 |
||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
-2Н2 |
|
|
|
|
|
|
|
|
|
СН3 |
СН3 |
|
|||||||||
|
|
|
|
|
|
|||||||||
|
2-метилбутан (изопентан) |
|
|
|
изопрен |
|
||||||||
2. Впервые дивинил был получен по методу С.ВЛебедева из этилового спирта. В качестве катализатора использовали оксиды алюминия и цинка, способствующие одновременной дегидратации (отщеплению воды) и дегидрированию (отщеплению водорода):
450 0С; Al O , ZnO
2С2Н5ОН ¾¾¾¾¾¾¾¾2 3 ®Н2С=СН-СН=СН2
-2H2O; -H2
3.Дивинил и изопрен в небольших количествах выделяют из продуктов пиролиза нефти.
4.Дивинил и изопрен получают дегидратацией гликолей(двухатомных спиртов):
54

Глава 4. Ациклические углеводороды
Н2С- |
СН- |
СН- |
СН2 |
¾¾¾¾®Н2С=СН-СН=СН2 |
||||||
|
|
|
|
|
|
|
|
|
-2Н2О |
|
Н ОН Н |
|
ОН |
||||||||
бутандиол-1,3 |
|
|
||||||||
Н2С |
|
С |
|
|
СН-СН2 |
¾¾¾¾®Н2С=С-СН=СН2 |
||||
|
|
|
||||||||
Н НО СН3 |
Н ОН |
-2Н2О |
||||||||
СН3 |
||||||||||
2-метилбутадиен-2,3
5. Изопрен получают из ацетилена и ацетона (реакция А.Е. Фаворского):
|
|
|
|
|
40 0С |
|
Н |
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
2 |
|
Н3С-СО-СН3 |
+ Н-С º С-Н ¾¾¾®Н3С-С-С º СН ¾¾¾® |
||||||
ацетон |
|
ацетилен |
КОН |
СН3 |
|||
|
|
||||||
Н ОН |
|
|
|
|
|||
|
|
|
|
||||
¾¾®Н2С-С-СН=СН2 |
¾¾¾®Н2С=С-СН=СН2 |
||||||
|
|
СН3 |
|
-Н2О |
СН3 |
||
|
|
|
|
||||
Химические свойства
Диены, содержащие в молекуле несопряженные(изолированные) двойные связи, проявляют свойства алкенов. В то же время диены с сопряженными двойными связями обладают высокой реакционной способностью и отличаются рядом особенностей. Однако для тех и других диеновых углеводородов характерны прежде всего реакции присоединения.
I. Реакции присоединения. Две сопряженные π-связи, образуя общее электронное облако, способны присоединять водород, галогены, галогеноводороды и другие вещества не только по месту отдельных двойных связей (1,2-присоединение), но и к крайним атомам углерода(1,4-
присоединение):
|
|
|
|
|
|
|
Н3С-СН2 -СН=СН2 |
|
|
|
|
Ni |
|||
СН2 =СН-СН=СН2 + Н2 |
|
|
|
|
|
бутен-1 |
|
|
1,4 |
|
|
Н3С-СН=СН-СН3 |
|||
|
|
|
|
|
|||
|
|
|
|
2Н |
|
|
|
|
|
|
|
|
|
|
бутен-2 |
|
|
|
1,2 |
|
|
||
|
|
|
|
СН2Сl-СНСl-СН=СН2 |
|||
|
|
|
|
|
|
||
Н2С=СН-СН=СН2 + Сl2 |
|
|
|
|
|
|
3,4-дихлорбутен-1 |
|
1,4 |
|
|
СН2Сl-СН=СН-СН2 Сl |
|||
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,4-дихлорбутен-2 |
55

Раздел 2. Углеводороды
|
|
|
|
Н3С-СНВr-СН=СН2 |
|
|
|
||
Н2С=СН-СН=СН2 + НВr |
|
|
|
3-бромбутен-1 |
|
1,4 |
|
Н3С-СН=СН-СНВr |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
1-бромбутен-2 |
II. Диеновые синтезы являются важными реакциями, которые применяются для получения многих циклических органических соединений. Этот вид реакций заключается в1,4-присоединении алкена или алкина к диену с сопряженными двойными связями(синтез Дильса-
Альдера):
НС |
СН2 |
CH |
|
НС |
СН2 |
|
|
2 |
СН2 |
||||
|
+ |
|
|
120 °C; давление |
|
|
|
|
|
|
|||
НС |
СН2 |
¾¾¾¾¾¾¾® |
СН2 |
|||
СН2 |
НС |
|||||
|
|
|
|
|
СН2 |
|
циклогексен
III. Реакции полимеризации. Диеновые углеводороды обладают исключительно важной особенностью: они легко вступают в реакции полимеризации с образованием каучукоподобных высокомолекулярных продуктов:
Н2С=СН-СН=СН2 + Н2С=СН-СН=СН2 + ... ¾¾®
¾¾®...-СН2 -СН=СН-СН2 -СН2 -СН=СН-СН2...
IV. Реакции гидратации характерны для диенов с кумулированными двойными связями(например, аллен) в присутствии концентрированной серной кислоты:
СН2 =С=СН2 + 2Н-ОН ¾¾®СН3 -С-СН3 ¾¾¾®СН3 -С-СН3 |
||
|
НО OH |
-Н2О |
аллен |
О |
|
неустойчивое |
кетон |
|
|
соединение |
(ацетон) |
Отдельные представители
Дивинил является одним из важнейших исходных веществ(мономеров) для производства синтетических каучуков и латексов, пластмасс и других органических соединений.
Изопрен является структурной составляющей природного каучука и других соединений (терпенов, каротиноидов и др.). Применяется для получения синтетического каучука.
56

Глава 4. Ациклические углеводороды
Хлоропрен (2-хлорбутадиен-1,3) применяют для производства хлоропренового синтетического каучука.
2,3-Диметилбутадиен-1,3 легко полимеризуется с образованием «метилкаучука».
§ 16. Алкины
Алкины (ацетилены) – алифатические непредельные углеводороды, в молекулах которых между атомами углерода имеется одна тройная связь.
Алкины образуют гомологический ряд с общей формулойСn H2n-2 . Эта формула является общей и для гомологического ряда диеновых углеводородов. Таким образом, алкины и алкадиены являются изомерами. Простейшим представителем этого класса углеводородов является ацетилен 2СН2. Такие углеводороды являются более непредельными соединениями, чем соответствующие им алкены (с тем же числом углеродных атомов).
Строение и изомерия
В алкинах атомы углерода находятся в третьем валентном состоянии
|
|
p |
|
(sр-гибридизация). В этом слу- |
|
|
|
|
чае между углеродными ато- |
||
|
|
p |
|
мами возникает тройная связь, |
|
Н s |
С |
С |
s Н |
состоящая |
из одной -σ и двух |
π-связей. Длина тройной связи |
|||||
|
|
p |
|
равна 0,12 нм, а ее энергия со- |
|
|
|
p |
|
ставляет 830 кДж/моль. Связь |
|
|
|
|
С-С и две связи С-Н распо- |
||
Рис. 7. Схема взаимного расположения |
ложены на одной прямой. |
||||
Расположение связей в мо- |
|||||
s -и p - связей в молекуле ацетилена |
лекуле |
этина показано на |
|||
|
|
|
|
рис. 7. |
|
Изомерия алкиновых углеводородов определяется строением углеродной цепи и положением в ней тройной связи. Например:
НС º С-СН2 -СН2 -СН3 |
Н3С-С º С-СН2 -СН3 |
НС º С-СН(СН3 )-СН3 |
пентин-1 |
пентин-2 |
3-метилбутин-1 |
|
Физические свойства |
|
Алкины – малополярные соединения, поэтому они нерастворимы в воде, но хорошо растворимы в обычных органических растворителях с низкой полярностью: лигроине, эфире, бензоле, четыреххлористом углероде. Плотность их меньше плотности воды. Температура кипения алкинов повышается с увеличением числа атомов углерода(ацетилен – 75 °С, пропин – 23 °С). Алкины имеют температуру кипения, очень близкую к
57

Раздел 2. Углеводороды
температуре кипения алканов и алкенов, имеющих то же число углеродных атомов.
Способы получения
1. Разложение карбида кальция СаС2 водой:
CaC2 +2H2O ® C2H2 +Ca(OH)2
2. Термическое разложение (крекинг) углеводородов:
1500 °С
2СН4 ¾¾¾®С2Н2 +3Н2
1200 °С
С2Н6 ¾¾¾®С2Н2 +2Н2
3. Действие на дигалогенопроизводные алканов, содержащие два атома галогена при одном или соседних углеродных атомах, спиртовыми растворами щелочей (или твердых NaOH, КОН):
Н3С-СН-СН-СН3 +2KOH ® H3C-C º C-CH3 +2KBr+2H2 O
Вr Вr |
бутин-2 |
2,3-дибромбутан |
|
4. Алкилирование металлических производных ацетилена:
С2Н5 -I+Na-C º CH ¾¾¾®С2 Н5 -C º CH
-NaI
ацетиленид |
бутин-1 |
натрия
Химические свойства
Химические свойства алкинов определяются тройной связью и особенностью ее строения. Они способны вступать в реакции присоединения, замещения, полимеризации и окисления.
I. Реакции присоединения. Реакции присоединения протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, – в одинарную.
1. Гидрирование протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni), но с меньшей скоростью:
|
Н2 |
|
Н2 |
|
НС º СН ¾¾®H2C=CH2 |
¾¾®H3C-CH3 |
|||
ацетилен |
Pt |
этилен |
Pt |
этан |
|
|
|||
2. Галогенирование протекает с меньшей скоростью, чем в ряду алкенов:
Br2 |
Br2 |
-CHBr2 |
НС º СН ¾¾¾® CHBr=CHBr ¾¾¾®CHBr2 |
||
1,2-дибромэтен 1,1,2,2-тетрабромэтан
58

Глава 4. Ациклические углеводороды
3. Гидрогалогенирование происходит непосредственно или в присутствии катализаторов (Cu2Cl2, HgCl2 и др.) в основном по механизму электрофильного присоединения:
HCl
НС º СН+НСl ® H2C=CHCl¾¾¾® H3C-CHCl2
хлорэтен 1,1-дихлорэтан (хлористый винил)
4. Присоединение воды (реакция Кучерова). В этой реакции в качестве ка-
тализатора используют серную кислоту и сульфат ртути (II):
О
HgSO4 |
|
|
НС º СН+Н-ОН ¾¾¾¾®[H2C=CH-OH]® |
СН3 |
С |
H2SO4 |
|
Н |
|
|
виниловый спирт уксусный альдегид
Неустойчивое промежуточное соединение– виниловый спирт – перегруппировывается в уксусный альдегид. Реакция гидратации ацетилена по Кучерову имеет промышленное значение(получение уксусного альдегида).
Гомологи ацетилена гидрируются с образованием кетонов:
HgSO4 |
|
|
Н3С |
|
|
СН3 |
|
|
|
|
С |
||||
Н3С-С º СН+Н-ОН ¾¾¾¾®[H3C- |
CH=СН2 |
]® |
|||||
|
|
|
|||||
H2SO4 |
|
|
|
|
|
|
|
|
ОН |
|
О |
||||
|
|
|
ацетон |
||||
5. Присоединение циановодородаидет в присутствии |
|
|
катализатора |
||||
(СuС12): |
|
|
|
|
|
|
|
катализатор
НС º СН+НСN ¾¾¾¾¾®Н 2С=СН-СN
акрилонитрил
Образующийся продукт – акрилонитрил – используют в качестве мономера для получения синтетического волокна нитрон.
6. Присоединение спиртов(реакция Фаворского). При взаимодействии ацетилена со спиртом(в присутствии едких щелочей) образуются алкилвиниловые эфиры (нуклеофильное присоединение):
KOH(тв.)/t
НС º СН+ОНС2Н5 ¾¾¾¾¾®Н2С=СН-O-С2 Н5
этилвиниловый эфир
59

Раздел 2. Углеводороды
II. Реакции замещения. Атомы водорода в ацетилене способны замещаться на металлы (реакция металлирования). Поэтому при пропускании ацетилена через аммиачный раствор оксида серебра образуется
ацетиленид серебра:
НС º СН+2[Ag(NH3 )2 ]ОН¾¾® Ag-Сº С-Ag+4NH3 +2H2 O
ацетиленид серебра
Образование ацетиленидов – качественная реакция на тройную связь (в том случае, если водородные атомы, связанные с углеродом при тройной связи, не замещены на радикалы).
III. Реакции изомеризации. Алкиновые углеводороды, как алканы и алкены, способны изомеризоваться с перемещением кратной связи в -уг леродной цепи:
|
Na(спирт.р-р) |
Н3С-СН2 -С º СН ¾¾¾¾¾¾®Н3С-С º С-СН3 |
|
бутин-1 |
бутин-2 |
IV. Реакции полимеризации. Ацетилен в зависимости от условий проведения реакции способен образовывать различные продукты полимеризации – линейные или циклические:
Cu2Cl2
2СН º СН ¾¾¾¾®НС º С -CН=CH2
80°C
винилацетилен
(бутен-1-ин-3)
|
СН |
|
|
|
НС |
СН |
||
НС |
|
СН |
Акт. уголь |
СН |
||||
|
|
|||||||
НС |
+ |
|
¾¾¾¾¾® |
|
|
|
||
|
СН |
400 0С |
|
|
|
|
||
СН |
НС |
СН |
||||||
|
|
|
|
|
|
СН |
||
|
|
|
|
|
|
|
||
бензол
V. Реакции окисления. Алкины легко окисляются с разрывом молекулы по месту тройной связи:
А. Если ацетилен пропускать через окислитель (водный раствор КМn04), то раствор быстро обесцвечивается:
3НС º СН +10КМnО4 +2Н2О ¾¾®6CO2 +10МnО2 +10КОН
Б. При полном сгорании ацетилена на воздухе образуются два продукта
– окись углерода (IV) и вода:
2НС º СН +5О2 ¾¾®4СО2 +2Н2О
В. При неполном сгорании образуется углерод (сажа):
60
