
himorgsoedinenii
.pdf
Глава 2. Теория органических соединений
|
é + ù é |
- ù |
Ка = |
ëН ûЧëХ |
û |
[Н-Х] |
|
|
|
|
Как правило, для органических соединений значение Ка – очень малая величина (например, для уксусной кислоты Ка =1,75Ч10-5 ). Поэтому для удобства вместо Ка пользуются ее отрицательным логарифмом–
показателем константы кислотности рКа : рКа = -lg Ка . Чем меньше численное значение рКа, тем выше кислотность соединения. Кисло-
та тем сильнее, чем слабее связь атома водорода с остатком молекулы (т.е. чем полярнее эта связь) и чем устойчивее этот остаток после отрыва водорода. Основность органических соединений оценивают по величине рКа сопряженных с ними кислот. Например, для метиламина CH3NH2 определяют рКа сопряженной с ним кислоты:
+
CH3NH3 ¬¾¾¾®CH3NH2 +H+
Чем больше рКа сопряженной кислоты, тем выше основность со-
единения. Основание тем сильнее, чем слабее связана с атомом свободная пара электронов, атакуемая протоном.
Более общей теорией кислот и оснований является теория, разработанная Г. Льюисом. Согласно этой теории, кислотой можно считать соединение,
не имеющее свободной электронной пары, но способное присоединить другое вещество, один из атомов которого содержит такую пару. На-
пример:
 Cl
Cl
 Cl
Cl B
B
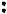 Cl
Cl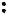
Основанием будет являться вещество, имеющее неподеленную пару электронов, которые могут быть использованы для образования устойчивой электронной оболочки другого атома. Примером такого вещества может служить аммиак:
H
H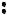 N
N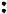
H
Таким образом, по теории Льюиса, основание (в данном примере – амми-
ак) – донор, а кислота (трихлорид бора) – акцептор электронной пары. По теории Льюиса, в число кислот включаются не только водородсодержащие
31

Раздел 1. Теоретические основы органической химии
вещества, но и апротонные соединения(не содержащие водорода): ВС13,
А1С13, S03, SnCl4.
§10. Номенклатура органических соединений
Огромное число существующих органических соединений требует строгого согласования правил их наименования, то есть номенклатуры.
В начальный период развития органической химии вновь полученным веществам присваивались случайные названия. Они могли быть связаны с источником получения этого соединения(муравьиная кислота), именем исследователя и т.д. Такие названия известны кактривиальные. С увеличением числа органических соединений, и особенно с усложнением
их строения, всё больше стала ощущаться острая потребность в- но менклатуре, которая бы учитывала строение веществ. Такой первой номенклатурой стала рациональная (от лат. ratio – «разум»). Она рассматривает все изомеры и гомологи определенного класса веществ как производные наиболее простого представителя гомологического ряда. Например, в предельных углеводородах это метан, а непредельных – этилен и ацетилен:
CН3
Н |
C |
|
|
|
|
Н C |
Н |
C-СН=СН-CН |
C2Н5 -С º С-C2 Н5 |
|
С |
|
|||||||
|
|
||||||||
3 |
|
|
|
|
|
3 |
3 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CН3 |
|
диметилэтилен |
диэтилацетилен |
||||
тетраметилметан |
|||||||||
Для сравнительно простых соединений эта номенклатура используется и сейчас. Однако для названия сложных органических веществ требовалась другая – более универсальная номенклатура. В настоящее время такой номенклатурой стала международная номенклатура (офи-
циальная, или систематическая), известная как Правила номенклатуры ИЮПАК (IUРАС). Основные принципы этой системы номенклатуры таковы:
1.За основу названия берется самая длинная углеводородная цепь, обычно включающая старшую функциональную группу, с добавлением
всуффиксе родового окончания, соответствующего последней.
2.Атомы углерода в цепи нумеруются последовательно с того конца, к которому ближе расположена старшая функциональная группа, но предпочтение при прочих равных условиях отдается двойной, а затем тройной связи. Если оба варианта нумерации равнозначны, то направление выбирается таким образом, чтобы сумма цифр, указывающих по-
32

Глава 2. Теория органических соединений
ложение заместителей, была наименьшей (правильней будет та, в которой первой стоит меньшая цифра).
3.К основе названия добавляются названия заместителей, начиная
спростейшего, при необходимости с указанием их количества при помощи приставок умножения (приложение табл. 3). При этом для каждого заместителя указывают его место в цепи, то есть номер атома, к которому присоединен заместитель в сквозной нумерации. Положение и
название заместителей и при необходимости функциональных групп указывают в префиксе перед названием цепи, отделяя цифры дефисом. Для функциональных групп цифры ставят перед названием или после названия, отделяя их в суффиксе также дефисом.
4.Названия заместителей (радикалов) могут быть системные и тривиальные (приложение табл. 4). Одновалентные (алкильные) радикалы называют, изменяя окончание -ан на -ил в названии соответствующего алкана. Обычно в названии радикала отражается тип атома углерода, имеющего свободную валентность. Различают следующие атомы углерода:
·первичный – связан с одним углеродным атомом ( Н3С-СН2 - );
·вторичный – связан с двумя углеродными атомами ( (СН3 )2 СН- );
·третичный – связан с тремя углеродными атомами ( (СН3 )3 С- );
· четвертичный – связан с четырьмя углеродными атомами
( (СН3 )4 С ).
Другие радикалы, независимо от того, имеют они окончание–ил или нет, обычно носят тривиальное название. Двухвалентные радикалы имеют окончание -ен или -иден.
5. Если в названии необходимо указать несколько заместителей, то они даются в порядке возрастания старшинства(приложение табл. 5) или в алфавитном порядке. При перечислении суффиксов в первую очередь указывают двойную, затем тройную связи, далее – функциональные группы по старшинству. Функциональная группа в названии может быть указана только в префиксе(приложение табл. 6) или в префиксе и суффиксе (приложение табл. 7).
В данном пособии используются все три номенклатуры, но предпочтение отдается систематической.
33
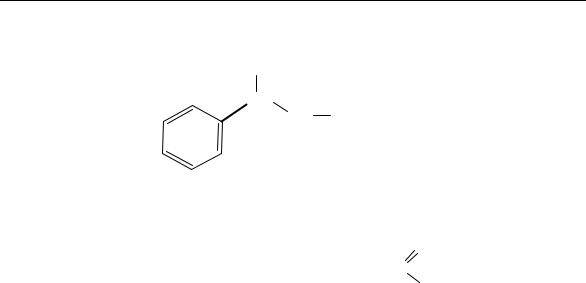
Раздел 1. Теоретические основы органической химии
Примеры названий органических соединений по номенклатуре ИЮПАК:
CН3 CН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CН |
|
|
|
|
О |
||||
|
CН2 |
|
О |
|
|
|
|
|
CН3 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
С |
|
|
||||
|
|
|
|
|
||||||
2-(о-толил)пропилацетат
|
|
|
|
|
CН3 |
|
OН |
|
|
|
|
|
O |
||||||
7 |
6 |
5 |
|
|
|
|
|
4 |
|
3 |
2 |
1 |
|||||||
CН3 |
|
CН |
|
CН |
|
|
|
C |
|
|
CН=CН |
|
C |
H |
|||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сl |
|
Н3C |
|
|
CН |
|
|
|
CН3 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
5-метил-4-изопропил-4-гидрокси-6-хлоргептен-2аль (по старшинству)
4-гидрокси-4-изопропил-5-метил-6-хлоргептен-2аль (по алфавиту)
ГЛАВА 3. ТЕОРИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ § 11. Классификация органических реакций
Всё многообразие химических реакций в органической химии можно классифицировать, используя различные критерии.
Реагирующие вещества в органических реакциях принято называть субстратом и реагентом. Субстратом называют основное органиче-
ское вещество, участвующее в реакции, реагентом – вещество, с ко-
торым оно взаимодействует. Обычно под реагентом подразумевается наиболее простое по строению вещество.
Часто органическую реакцию записывают не в виде уравнения, а в виде схемы. Это связано с тем, что в ходе реакции образуется не только основное вещество, но и несколько побочных. В схеме указываются исходные вещества, главный продукт и условия ее проведения. Вместо знака равенства используют стрелку( ®), указывающую направление превращения веществ. Над стрелкой указывают условия проведения реакции (катализатор, давление, температуру, иногда реагенты), а под стрелкой со знаком минус – побочные вещества, выделяющиеся при реакции.
Часто за основу классификации принимаютспособ разрыва старых химических связей и образования новых. В этом случае органические
34

Глава 3. Теория органических реакций
реакции классифицируют по характеру химических превращений или по механизму их протекания.
I. По характеру химических превращенийорганические реакции делят на следующие типы:
1. Реакции замещения (обозначается буквой S,, от англ. substitution – «замещение»). Один атом (или группа атомов) замещается на другой атом (или группу атомов) с образованием новой молекулы:
СН4 + СI2 ¾¾®СН3С I + НСI
метан хлорметан
2. Реакции присоединения (обозначается символом А или Ad, от англ. аddition – «присоединение»). Из двух или нескольких молекул образуется одно новое вещество:
Н2С=СН2 + Вr2 ¾¾®СН2 Вr - СН2 Вr
этилен |
1,2-дибромэтилен |
Как правило, в таких реакциях происходит присоединение различных реагентов к кратным связям. К реакциям присоединения также можно отнести реакции восстановления. Восстанавливающий реагент обозначают символом [Н]. Например:
[Н]
СН3-СО-СН3 ¾¾¾®СН3 - СН-СН3
ОН
ацетон изопрориловый спирт
Эти реакции противоположны реакциям окисления. Частным случаем реакций восстановления являются реакции гидрирования – присоедине-
ния водорода:
|
Н2 |
|
|
Рt |
-СН3 |
Н2С=СН2 ¾¾¾®СН3 |
||
этилен |
этан |
|
3. Реакции отщепления, или элиминирования (обозначается симво-
лом Е, от англ. еlimination – «отщепление»). В результате этой реакции образуется новое вещество, молекулы которого часто содержат кратную связь:
СН3 -СН2 ОН ¾¾®СН2 = СН2 +Н2 О
этиловый спирт |
этилен |
35
Раздел 1. Теоретические основы органической химии
4. Реакции перегруппировки, или изомеризации. Такие реакции при-
водят к внутримолекулярным перемещениям атомов или групп атомов без изменения формулы веществ, участвующих в реакциях:
N-OН |
О |
|
NН |
||
|
оксим циклогексана ε-капролактам
5. Окисление. Реакция, при которой под действием окисляющего реагента (его обозначают символом [О]) образуется одно или несколько новых кислородсодержащих веществ:
О |
[О] |
|
СН3 -С |
|
СН3 -СООН |
|
||
Н |
|
уксусная кислота |
уксусный альдегид |
||
6. Реакции конденсации и поликонденсации являются также ча-
стным случаем реакции присоединения. В результате соединения нескольких молекул (в случае поликонденсации – большего числа) друг с другом, сопровождающегося выделением простых веществ(Н20, NH3, НСl и др.), образуется сложное вещество с высокой молекулярной массой:
HO-CH2 -CH2 -OH+HO-CH2 |
-CH2 |
-OH ¾¾¾® |
|
|
-H2O |
этиленгликоль |
этиленгликоль |
|
HO-CH2 -CH2 -OH
¾¾®HO-CH2 -CH2 -O-CH2 -CH2 -OH ¾¾¾¾¾¾¾®
-H2O
димер этиленгликоля
¾¾®HO-CH2 -CH2 -O-CH2 -CH2 -O-CH2 -CH2 -OH
тример этиленгликоля
7. Реакции разложения (расщепления) приводят к образованию новых веществ более простого строения:
C6H12O6 ¾¾® 2C2H5OH + 2CO2
глюкоза |
этиловый спирт |
II. По механизмупротекания органические реакции делят на следующие типы:
36
Глава 3. Теория органических реакций
1. Гомолитические, или радикальные, реакции идут с участием атакующих реагентов свободных радикалов– частиц с неспаренным электроном. Обозначают такие реакции индексомR. Пример радикального замещения SR:
hν
Cl2 2Cl
CH4 +Cl2
 CH3 +HCl
CH3 +HCl
CH3 +Cl Cl
Cl  CH3Cl+Cl
CH3Cl+Cl и т.д.
и т.д.
2. Гетеролитические, или ионные, реакции идут с участием ио-
нов, а также частиц с неподеленной парой электронов или вакантной орбиталью, то есть нуклеофилов и электрофилов. Если атакующая частица (реагент) является нуклеофилом, то говорят, что реакция нуклеофильная (обозначают индексом N). Пример реакций нуклеофильного замещения SN:
Н3C-CH2Cl+OH ¾¾®Н3 C-CH2 OH+Cl
(CH3 )3 CCl+H2O ¾¾®(CH3 )3 COH+HCl
Если атакующая частица является электрофилом, то реакция считается электрофильной (обозначают индексом E). Пример реакций элек-
трофильного замещения SE (а) и |
электрофильного |
присоединения АЕ |
||||||||||||||
(б): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а) |
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
+ NO2 |
¾¾® |
|
|
|
+ H |
|||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) CH3Cl+AlCl3 ¾¾®CH3 [AlCl4 ]
§ 12. Реагирующие органические частицы
Реагенты, участвующие в органических реакциях, подразделяют на
нуклеофилы, электрофилы и свободные радикалы.
Нуклеофил – химическое соединение, способное быть донором электронной пары (дословно – «любящий, стремящийся к ядру», т. е. к положительному заряду). К нуклеофилам относятся все анионы и органические соединения с атомами, несущими неподеленные пары электронов.
37
Раздел 1. Теоретические основы органической химии
Рассмотренные выше карбанионные интермедиаты относятся к типичным нуклеофилам:
- |
- |
- |
- |
- |
ОН |
ОR |
NR 2 |
CI |
CR3 |
Н2О RОН RОR NH3 |
NR3 |
|||
Электрофил – химическое соединение, способное принимать на себя электронные пары (дословно – «любящий, стремящийся к электрону», т. е. к отрицательному заряду). К электрофилам относятся все катионы и кислоты Льюиса (см. раздел 1, глава 2, § 9) – галогениды алюминия, железа, олова, цинка и сурьмы:
+
Н Li Cl NO2 CR3
38

Глава 4. Ациклические углеводороды
РАЗДЕЛ 2. УГЛЕВОДОРОДЫ
Вданном разделе рассматривается класс органических соединений
–углеводороды. Как уже отмечалось выше (раздел 1, глава 2), к ним от-
носят органические соединения, в молекулы которых входят атомы лишь двух элементов – углерода и водорода.
ГЛАВА 4. АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
Ациклическими, или алифатическими, называют углеводороды с открытой (незамкнутой) цепью углеродных атомов. По характеру свя-
зей между углеродными атомами алифатические углеводороды могут быть
предельными (насыщенными) и непредельными (ненасыщенными).
§ 13. Алканы
Алканы – углеводороды, наиболее богатые атомами водорода и насыщенные им до возможного предела. Поэтому их относят к насы-
щенным, или предельным, углеводородам. Их называют такжепарафинами, что означает по латыни«лишенные сродства». Это название характеризует низкую реакционную способность этого класса соединений. Общая формула ряда алканов: Сn H2n+2 . Простейшим представителем алканов является метан СН4. Гомологический ряд представлен следующими соединениями:
СН4 – метан |
С6Н14 |
– гексан |
С2Н6 – этан |
С7Н16 |
– гептан |
C3H8 – пропан |
С8Н20 |
– октан |
С4Н10 – бутан |
С9Н22 – нонан |
|
С5Н12 – пентан |
С10Н22 – декан и т. д. |
|
Строение и изомерия
Общей чертой в строении насыщенных соединений являетсяпро-
стая, или одинарная, ковалентная σ – (сигма) связь между атомами С-С и С-Н.
Прочность связей С-С и С-Н зависит от типа атома углерода, у которого происходит разрыв связи. Наименее прочной она является у третичного атома углерода, что делает такую связь наиболее уязвимой при химических реакциях.
В молекуле насыщенных углеводородов атомы углерода находятся в первом валентном состоянии, т. е. sр3-гибридизации. Это состояние характеризуется тетраэдрической конфигурацией углеродного атома с валентным углом 109º 28′.
39

Раздел 2. Углеводороды
Дипольный момент алканов равен нулю, что свидетельствует о неполярном характере связей С-Н и С-С. Межмолекулярные взаимодействия алканов включают главным образом дисперсионную составляющую и являются очень слабыми. Это предопределяет для алканов в твердом
состоянии молекулярный тип кристаллической решетки и легкость ее разрушения.
Изомерия алканов связана, во-первых, со структурой углеродного скелета, во-вторых, с вращением по связи С-С. Структурная изомерия алканов впервые была экспериментально доказана А..МБутлеровым получением бутана и изобутана.
Пространственные конформационные изомеры алканов имеют малый энергетический барьер и в нормальных условиях не могут быть выделены в индивидуальном виде, так как они быстро переходят друг в друга.
Физические свойства
Первые четыре члена гомологического ряда алканов в обычных условиях – газообразные вещества, соединения от С5 до С15 – жидкости, от С16 и выше – твердые вещества. В гомологическом ряду алканов постепенно повышаются температуры кипения, плавления, а также относительная плотность. Это позволяет предвидеть свойства неизвестного члена ряда, основываясь на свойствах его соседа. Например, температура кипения
гексана 68,8 °С, гептана 98,4 °С. Разница в составе на одну группу СН
2
приводит к повышению температуры кипения на29,6 °С (гомологическая разность температур кипения). Для октана на основании этого можно рассчитать температуру кипения: 98,4 + 29,6 = 128 °С. Алканы с разветвленной цепью кипят при более низкой температуре, чем изомеры с нормальной цепью.
Плотность всех алканов меньше единицы. Они практически нерастворимы в воде, но раствораются в эфире и других неполярных растворителях. Метан и этан почти лишены запаха, углеводороды С3-C5 имеют запах бензина или керосина, высшие члены ряда лишены запаха из-за их малой летучести.
Способы получения
1.Алканы широко распространены в природе. Поэтому для их получения используют в основном природные источники– нефть, природный и попутные газы, каменный уголь, сланцы.
2.Алканы с небольшим числом углеродных атомов(С1-С11) получают фракционной перегонкой нефти, природного газа или смесей углеводородов, полученных гидрированием угля.
Деструктивное гидрирование угля – один из методов получения мно-
40
