
himorgsoedinenii
.pdf
Глава 5. Циклические углеводороды
НС º СН +О2 ¾¾®C+СО+2Н2О
Отдельные представители
Ацетилен при горении в кислороде дает высокотемпературное пламя (3000 °С), которым пользуются для сварки и резки металлов(автогенная сварка). С воздухом ацетилен образует опасную взрывчатую смесь.
ГЛАВА 5. ЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
К углеводородам циклического строения относят алициклические и
ароматические соединения. |
|
|
Алициклические |
соединения – углеводороды |
циклического |
строения, молекулы которых построены из углеродных атомов, связанных между собой σ-связями.
По химическим свойствам алициклические соединения схожи с соответствующими соединениями алифатического ряда. Поэтому они и получили название алициклические (алифатические циклические). Однако между алифатическими и алициклическими соединениями имеются существенные различия, которые объясняются циклической структурой
последних. Алициклические соединения содержат различные по размеру циклы – от трехчленного до многочленного. В составе молекул могут также находиться одновременно два цикла. В зависимости от характера связей в циклах различают предельные алициклические - со единения – циклоалканы (циклопарафины) и непредельные – циклоалкены (циклоолефины). В данном пособии рассматриваются циклоалканы.
§ 17. Циклоалканы
Циклоалканы, или цикланы, – алициклические углеводороды, в которых циклы построены из метиленовых групп, связанных между собой σ-связями. Общая формула циклоалканов Сn H2n , т. е. эти соединения изомерны этиленовым углеводородам. Такие соединения называют, добавляя приставку «цикло» к названию соответствующего алифатического углеводорода. Циклоалканы, содержащие пяти- и шестичленные циклы (циклопентан, циклогексан и их гомологи), составляют основную массу некоторых сортов нефти(например, бакинской), входят в состав эфирных масел и других природных соединений. Исследованием циклоалкановых углеводородов занимались русские химики – В.В. Марковников, Н.Д. Зелинский, Г.Г. Густавсон, Н.Я. Демьянов и другие.
61

Раздел 2. Углеводороды
Строение и изомерия
Для циклоалканов возможнаструктурная и пространственная изомерия. Структурная изомерия зависит:
1) от числа углеродных атомов в цикле:
Н2С |
СН3 |
Н2С |
|
|
СН2 |
||||||
|
|||||||||||
|
|
СН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||||
Н2С |
|
Н2С |
|
СН2 |
|||||||
|
|
||||||||||
метилциклопропан циклобутан
2) от положения заместителей в цикле:
|
|
СН3 |
|
СН3 |
|
|
|
|
СН3 |
||||
|
6 |
1 |
2 |
СН3 |
|
1 |
2 |
|
|
|
6 |
1 |
|
|
|
|
|
6 |
|
|
|
5 |
|
||||
|
5 |
|
3 |
|
|
5 |
3 |
|
Н3С |
|
4 3 |
2 |
|
|
4 |
|
|
4 |
СН3 |
|
|
|
|||||
1,2-диметилциклогексан |
1,3-диметилциклогексан |
1,4-диметилциклогексан |
|||||||||||
3) от числа углеродных атомов в заместителе:
|
5 |
6 |
1 |
|
СН3 |
|
|
5 |
6 |
1 |
|
С2Н5 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||
|
4 |
3 |
2 |
|
С3Н7 |
|
|
4 |
3 |
2 |
|
С2Н5 |
|
|
|
|
|||||||||
1-метил-2-пропилциклогексан |
1,2-диэтилциклогексан |
|||||||||||
Пространственная изомерия циклоалканов представлена геометрической (цис-, транс-изомерия) и конформационной изомерией:
Н3С |
СН3 |
Н3С |
СН3
цис-изомер транс-изомер
Физические свойства
По своим физическим свойствам циклоалканы несколько отличаются от соответствующих им алканов. Первые два члена гомологического ряда циклоалканов (циклопропан, циклобутан) – газы; соединения с числом углеродных атомов от 5 до 10 – жидкости; высшие циклоалканы – твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов(с тем же числом углеродных атомов).
Способы получения
Циклоалканы выделяют из нефти, некоторых природных веществ или получают синтетическим путем:
62
Глава 5. Циклические углеводороды
1. Действием цинковой пыли в спиртовом растворе на 1,3-дихлорпропан получают циклопропан:
СН2 Сl |
t |
|
|
СН2 |
Н2С |
+Zn ¾¾®Н2С |
|
+ ZnСl2 |
|
|
||||
СН2 Сl |
|
|
СН2 |
|
1,3-дихлорпропан |
циклопропан |
|||
2. В присутствии амальгамы лития 1,4-дибромбутан и 1,5-дибромпентан в диоксане (или тетрагидрофуране) образуют соответственно циклобутан и циклопентан (Коннер, Уилсон, 1967):
Br-(CH2 )4 -Br + 2LiHg ® C4 H8 + 2LiBr + Hg
цикло-
бутан
Br-(CH2 )5 -Br + 2LiHg ® C5 H10 + 2LiBr + Hg
цикло-
пентан
3. Циклогексан и его гомологи обычно получают из нефти или гидрированием бензола и его производных:
|
|
СН3 |
Н2 Ni |
|
|
|
СН3 |
|
|
|
|
||||
|
|
¾¾¾¾¾® |
|
|
|
|
|
|
|
150 |
0C;давл. |
|
|
|
|
|
|
|
|
|
|||
толуол |
метилциклогексан |
||||||
Химические свойства
В химическом отношении циклоалканы во многом напоминают алканы. Они сравнительно малоактивны и склонны к реакциям замещения. Но низшие алканы(циклопропан и циклобутан) могут проявлять свойства непредельных углеводородов – они вступают в реакции присоединения, которые связаны с разрывом кольца.
I. Реакции присоединения (реакции, протекающие с разрывом коль-
ца):
Н2Ni
¾¾¾® CH3-CH2 -CH3
80 0C
циклопропан пропан
Н2Ni
¾¾¾¾® CH3-CH2 -CH2 -CH3
120 0C
циклобутан |
бутан |
63
Раздел 2. Углеводороды
Циклы раскрываются также при действии на них галогенов, галогеноводородов и сильных минеральных кислот:
HCl  CH3 -CH2 -CH2 Сl
CH3 -CH2 -CH2 Сl
Br2
Br-CH2 -CH2 -CH2 Br
H2SO4
CH3 -CH2 -CH2 OSO3 H
II. Реакции замещения. Для циклоалканов с пятью атомами углерода и более в цикле характерны обычные реакции замещения:
+ Br2 ¾¾® |
+ HBr |
|
Br |
циклопентан бромциклопентан
В реакцию хлорирования вступает даже циклопропан, если эту реакцию проводить под действием света (фотохимическое хлорирование):
hν |
|
|
Cl + HCl |
|
|
||
+ Cl2 ¾¾® |
|
|
|
|
хлорциклопропан |
||
III. Реакции окисления. Циклоалканы сравнительно легко окисляются, образуя при этом двухосновные карбоновые кислоты с тем же числом углеродных атомов:
5О Н2С СН2 СООН
¾¾¾®
-Н2О Н2С СН2 СООН
циклогексан адипиновая кислота
IV. Реакции изомеризации. Циклоалканы способны изомеризоваться с расширением или сужением цикла (Н.Я. Демьянов, Н.М. Кижнер):
Н+ |
CH2ОН |
¾¾¾® |
циклопропилметанол
V. Дегидрогенизация циклоалканов (ароматизация). Циклогексан и его гомологи, называемые гидроароматическими углеводородами, при высокой температуре в присутствии катализаторов могут превращаться в ароматические соединения (Н.Д. Зелинский, 1911):
64
Глава 5. Циклические углеводороды
|
|
СН3 |
|
|
|
СН3 |
|
|
|
|
|
||
|
|
|
||||
|
|
Катализатор |
|
|
|
+3Н2 |
|
|
¾¾¾¾¾¾® |
|
|
|
|
|
|
150 0C;давл. |
толуол |
|||
метилциклогексан |
||||||
Отдельные представители
Циклопропан С3Н6 – в смеси с воздухом, кислородом или N20 взрывоопасен. Используется в качестве средства для наркоза.
Циклогексан С6Н12 применяют как растворитель, а также для получения циклогексанола, циклогексанона, адипиновой кислоты, ε-капролактама и др.
§ 18. Ароматические углеводороды
Ароматические соединения (арены) – органические соединения с плоской циклической структурой, в которой все углеродные атомы создают единую делокализованную π-электронную систему, содержащую (4n+2) π-электронов.
Ароматические соединения могут содержать в молекуле одно или несколько бензольных ядер(многоядерные ароматические соединения). К моноциклическим аренам относят все производные бензола с одним кольцом. Полициклические подразделяют на арены с изолированными циклами (ряд бифенилов и дифенилметанов) и конденсированные или аннелированные (ряд нафталина) арены.
Ряд бифенилов: С6Н5-С6Н5 (бифенил), С6Н5-С6Н4-С6Н5 (терфенил). Ряд дифенилметанов: С6Н5СН2С6Н5 (дифенилметан), (С6Н5)3СН
(трифенилметан).
Первым представителем полициклических конденсированных, или аннелированных, аренов является нафталин. Другие, наиболее распространенные соединения этого класса – антрацен и фенантрен:
нафталин |
антрацен |
фенанатрен |
В данном параграфе рассматриваются одноядерные арены.
Строение и изомерия
Бензол С6Н6 – простейший представитель ароматических углеводородов. Несмотря на кажущуюся простоту, установление истинного строения бензола заняло много десятилетий. Огромный вклад в выяснение это-
65
Раздел 2. Углеводороды
го вопроса внесли такие выдающиеся химики, как Э. Хюккель (Германия), Л. Полинг (США), Ф. Кекуле, И. Ингольд (Англия).
B настоящее время установлено, что структура бензола представляет собой правильный шестиугольник. Результаты рентгеноструктурного анализа бензола показывали, что все длины связей С-С в молекуле бензола одинаковы (0,14 нм). Такая длина является средней между значениями длин простой (0,154 нм) и двойной (0,134 нм) связей. Все атомы углерода и водорода лежат в одной плоскости.
Атомы углерода находятся в углах |
|
Н |
||||
|
|
|
||||
правильного |
шестиугольника, углы |
Н |
|
|
|
Н |
|
|
|
||||
между связями |
С-С равны120°. Углы |
Н |
|
|
|
0,14 нм |
между связями С-С и С-Н также равны |
|
|
|
|||
|
|
|
Н |
|||
|
|
|
||||
120°. Все расстояния С-Н в молекуле |
|
|
|
|||
|
Н |
|||||
бензола равны 0,11 нм (рис. 8). Все уг- Рис. 8. Геометрия молекулы бензола
леродные атомы в молекуле бензола
находятся в состоянии sp2-гибридизации. Эти данные привели к заключению, что выравнивание длин связей С-С в кольце бензола есть результат взаимного перекрыванияр-орбиталей с образованием единой циклической системы сопряжения. Исходя из этого строение бензола -изо изображают двумя следующими резонансными структурами или кольцом внутри шестиугольника, символизирующим р-р сопряжение между кратными связями:
или
В органической химии широко известно такое понятие, как ароматичность некоторых органических соединений. Термин «ароматичность» связан прежде всего с бензолом, его гомологами и многочисленными производными. Ароматичность – общий признак некоторых цикли-
ческих органических соединений, обладающих совокупностью особых свойств. Главной особенностью таких соединений является равномерное распределение π-электронной плотности в плоской циклической мо-
лекуле. Наличие единой замкнутой системы π-электронов в молекуле
– основной признак ароматичности. Ароматические соединения подчиняются правилу Хюккеля: плоские моноциклические соединения,
имеющие сопряженную систему π-электронов, могут быть ароматическими, если число этих электронов равно 4n + 2 (где n = 0,1,2,3, 4 и т. д., т. е. число π-электронов в молекуле может быть2, 6, 10, 14, 18
и т. д.).
66
Глава 5. Циклические углеводороды
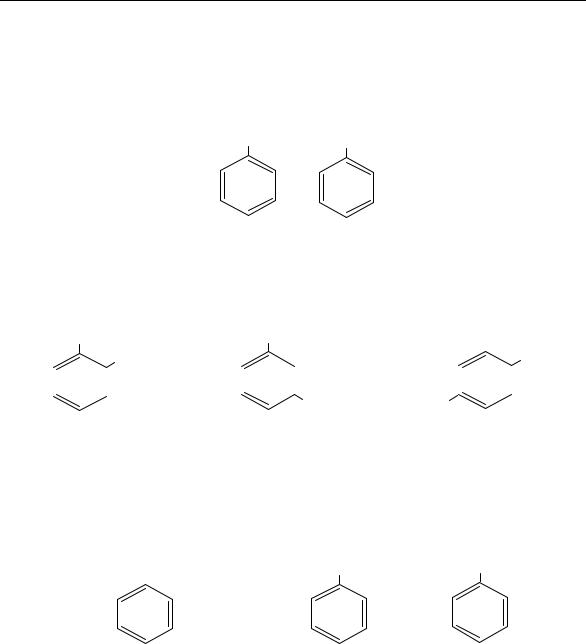
Общая формула гомологов бензола Сn H2n-6 . Все шесть атомов водорода в молекуле бензола одинаковы, и при замещении одного из них на один и тот же радикал образуется одно и то же соединение. Поэтому однозамещенный бензол изомеров не имеет. Например, существует только один метилбензол – толуол (I) или винилбензол – стирол (II):
СН3 СН=СН2
I |
II |
При замещении двух атомов водорода на метильные группы образуются три изомера – ксилолы, которые отличаются друг от друга расположением заместителей в кольце:
|
|
СН3 |
|
СН3 |
|
|
|
СН3 |
|||||
|
6 |
1 |
2 |
|
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
5 |
4 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
Н3С |
||||||
орто-диметилбензол, |
|
|
|
||||||||||
мета-диметилбензол, |
пара-диметилбензол, |
||||||||||||
или 1,2-диметилбензол |
или 1,3-диметилбензол |
или 1,4-диметилбензол |
|||||||||||
(о-ксилол ) |
|
(м-ксилол ) |
(п-ксилол ) |
||||||||||
Вместо буквенного обозначения (орто-, мета-, пара-, или сокращенно: о-, м-, п-) можно пользоваться цифровым: 1,2-, 1,3-, 1,4-.
Изомеры могут отличаться характером заместителей:
|
|
СН2 -СН2 -СН3 |
Н3С- |
СН-СН3 |
С2Н5 |
|
|||||
|
|
|
|
|
|
пропилбензол |
изопропилбензол этилбензол |
|
(кумол) |
Физические свойства
Низшие члены гомологического ряда бензола обычно жидкости с характерным запахом. С повышением молекулярной массы увеличивается температура их кипения, причем орто-изомеры чаще кипят при более высокой температуре, чем пара-изомеры. Углеводороды, в состав которых входит не более одного бензольного кольца, как правило, легче воды. Ароматические углеводороды нерастворимы в воде, но хорошо растворяются во многих органических растворителях.
67

Раздел 2. Углеводороды
Способы получения
1. Получение из природных источников. Основными природными источниками ароматических углеводородов являются каменный уголь и нефть. При сухой перегонке каменного угля(при 1000–1200 °С) образуются несколько продуктов: коксовый газ, кокс, аммиачная вода и каменноугольная смола (деготь). Из каменноугольной смолы можно выделить около 450 различных органических соединений. Среди них – фенол, нафталин, антрацен, пиридин, тиофен и многие другие. Другим источником получения ароматических углеводородов является нефть. Некоторые нефти (например, уральская) содержит значительные количества (до 60 %) ароматических углеводородов, которые выделяют простой перегонкой или пиролизом, а также каталитическим крекингом.
2. Синтез ароматических углеводородов. Для получения бензола и его гомологов используют следующие способы:
а) ароматизация предельных углеводородов:
|
СН3 |
|
|
|
|
СН3 |
|||||
Н2С |
СН |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||
|
|
СН3 |
Сr |
О |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
2 |
3 |
|
|
|
|
|
|
Н2С |
|
|
СН3 |
¾¾¾® |
|
|
|
|
|
|
|
|
|
-4Н2 |
|
|
|
|
|
|
|||
|
|
|
|||||||||
СН |
|
|
|
|
СН3 |
||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||
|
СН3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
б) реакция Вюрца – Фиттига:
|
|
|
Вr |
|
|
|
С2Н5 |
|
|
|
+2Na+Br-С2Н5 |
¾¾¾¾® |
|
|
|
бромбензол |
-2NaBr |
|
|
||||
этилбензол |
|||||||
в) каталитическое дегидрирование циклоалканов (стр. 64–65). г) синтез из ацетилена (стр. 60).
д) реакция Фриделя –Крафтса:
AlCl3
С6Н6 +С2Н5Сl ¾¾¾®С6Н5 -С2Н5 -HCl этилбензол
е) синтез из солей ароматических кислот:
t
С6Н5-СООNa+NaOH ¾¾®С6Н6 +Na2CO3
68
Глава 5. Циклические углеводороды
Химические свойства
Основными химическими реакциями, в которых участвует бензольное кольцо, являются присоединение, замещение и окисление.
I. Реакции присоединения. Эти реакции протекают с большим трудом. Только в особых условиях(высокая температура, облучение УФсветом, катализатор) бензол может проявлять слабо выраженный непредельный характер и присоединять водород или галогены:
|
|
|
|
|
|
|
|
|
|
Сl Н Сl Н |
|||||
|
+3Н |
|
Pt,150 0С |
|
|
|
|
+3Cl2 |
hν, 50 0С |
Н |
|
|
|
|
Сl |
|
|
|
|
|
|
|
|
|
|||||||
|
|
¾¾¾¾¾® |
|
|
|
|
¾¾¾¾® |
|
|
|
|
Н |
|||
|
|
2 |
давление |
|
|
|
|
|
|
Сl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
циклогексан |
|
|
Н |
|
|
Сl |
||||||
|
|
|
|
|
|
|
|
Сl Н |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
гексахлорциклогесан
II. Реакции электрофильного замещения (SE). К ним относятся реак-
ции галогенирования, нитрования, сульфирования, реакции алкилирования и ацилирования (реакции Фриделя-Крафтса).
1. Галогенирование проходит только в присутствии катализатора – галогенидов алюминия или железа:
|
Br |
|
Cl |
Cl |
|||||
FeBr3 ,t |
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|||
|
|
|
+HBr |
+ 6Сl2 |
AlCl ,t |
|
|
+6HCl |
|
+ Br2 ¾¾¾¾® |
|
|
|
¾¾¾¾® |
|
|
|||
|
|
|
|
|
|
3 |
|
|
|
Cl
 Cl Cl
Cl Cl
2. Нитрование проводится нитрующей смесью, состоящей из концентрированных азотной и серной кислот:
Н2SO4 +HNO3 ¬¾¾¾®NO2+ +НSO4 +H2 O
NO2

 + НОÅ2 ¾¾t ®
+ НОÅ2 ¾¾t ®
нитробензол
III. Реакции окисления. Бензол довольно устойчив к действию окислителей. Только сильные окислители (например, кислород воздуха при высокой температуре в присутствииV205) могут привести к разрыву бензольного кольца с образованиеммалеиновой кислоты или малеино-
вого ангидрида:
69
Раздел 2. Углеводороды
[О], t НС-СООН ¾¾¾®НС-СО |
О |
¾¾¾® НС-СООН -Н2О НС-СО |
Гомологи бензола окисляются легко. При этом окисляется связанная с бензольным ядром боковая цепь, которая превращается в карбоксильную группу:
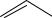
 СН3[О]
СН3[О] 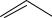 СООН
СООН
¾¾¾®
толуол |
бензойная кислота |
Окислением о-ксилола можно получить фталевый ангидрид:
СН3 |
О5 |
|
СО |
[О], V2 |
; t |
О |
|
¾¾¾¾¾® |
|||
СН3 |
|
|
СО |
На воздухе бензол горит коптящим пламенем:
2C6H6 +3O2 ®12C+6H2O
Отдельные представители
Бензол (бензен) С6Н6 служит сырьем для производства различных химических продуктов: нитробензола, хлорбензола, ε-капролактама, анилина, фенола, бензолсульфокислоты, стирола и др. Применяют для синтеза красителей, пестицидов, полимеров, ПАВ, взрывчатых веществ и фармацевтических препаратов. Служит добавкой к моторному топливу для повышения октанового числа.
Толуол (метилбензол) С6Н5-СН3 используют для производства красителей, взрывчатых веществ (тротил, тол) и лекарственных препаратов. Применяют в качестве исходного продукта для получения ПАВ, ε-капролактама, бензойной кислоты. Является хорошим растворителем для некоторых полимеров.
Ксилолы (диметилбензолы) С6Н4(СН3)2 применяют в качестве растворителя лакокрасочных материалов, высокооктановой добавки к авиационным бензинам.
Этилбензол С6Н5С2Н5 используют для получения стирола и в качестве добавки к моторному топливу для повышения октанового числа.
Изопропилбензол (кумол) С6Н5-СН(СН3)2 служит исходным продуктом для получения фенола и ацетона. Используется как растворитель для лакокрасочных материалов.
Винилбензол (стирол) С6Н5-СН=СН2 легко полимеризуется. Используют в основном для получения полимера– полистирола, бутадиенстирольного каучука и АБСпластиков.
70
