
himorgsoedinenii
.pdf
Глава 7. Органические кислородсодержащие соединения
ферменты
глюкоза С6Н12О6 ¾¾¾¾¾®С2Н5ОН+СО2
Одноатомные спирты в лаборатории получают:
1. Нуклеофильным замещением галогена на гидроксогруппу под действием водных растворов щелочей: СН3Вr+ОН- ® СН3ОН+Вr
2. Гидратацией алкенов:
Н+
Н3С-СН=СН2 +Н2О ¾¾¾®Н3С-СН-СН3
ОН
изопропиловый спирт
3. восстановлением карбонильных соединений(альдегидов и кетонов) водородом на катализаторе или комплексными гидридами металлов:
О |
|
ОН |
||
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н2 |
(3 атм), Рt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
¾¾¾¾¾¾® |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
комн. темп. |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
циклогексанол |
|
|
|||||||
циклогексанон |
|
|
||||||||||||||
Н2С=СН-(СН2 )2 -С |
О NaBH4 (боргидрид натрия) |
Н2С=СН-(СН2 )2 |
Н |
|||||||||||||
|
|
|||||||||||||||
¾¾¾¾¾¾¾¾¾¾® |
-С-ОН |
|||||||||||||||
Н |
Н2О |
|||||||||||||||
|
|
|||||||||||||||
4-пентен-аль-1 |
|
|
|
4-пентен-ол-1 Н |
||||||||||||
|
|
|
|
|
|
|||||||||||
|
О |
|
|
|
|
|
|
|
ОН |
|
|
|||||
|
|
|
|
|
|
1.LiAlH4 (алюмогидрид лития) |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||||
СН3СС2Н5 ¾¾¾¾¾¾¾¾¾¾¾®СН3СС2Н5 |
|
|
||||||||||||||
бутанон-2 |
2. Н2О |
|
|
|
|
|
|
|||||||||
|
Н |
|
|
|||||||||||||
(метилэтилкетон) |
|
|
|
|
бутанол-2 |
|
|
|||||||||
Многоатомные спирты в промышленности получают:
1. Этиленгликоль получают при гидратации этиленоксида, который, в свою очередь, образуется при окислении этилена:
Н |
Н Ag(катализатор) |
Н О Н Н |
О |
Н2С |
|
СН2 |
|||
|
|||||||||
|
|
|
|
|
2 |
|
|
|
|
С=С |
¾¾¾¾¾¾¾® |
С-С |
¾¾¾¾¾® |
|
|
||||
Н |
250 0С |
Н |
катализатор |
ОН ОН |
|||||
Н |
|
|
Н |
|
|
|
|
||
Также его можно получить гидролизом дигалогенопроизводных углеводородов водным раствором щелочи:
81

Раздел 3. Органические соединения с однородными функциями
Н |
С-СН |
2 |
2NaOH |
Н2С-СН2 |
2 |
|
¾¾¾¾® |
||
Сl Сl |
|
-2NaCl |
ОН ОН |
|
2. Глицерин получают при гидролизе жиров и из пропилена:
Н3С-СН=СН2 |
О2 |
|
О |
Н2 |
|
|
|
||||
¾¾¾® Н2С=СН-С |
|
¾¾¾® |
|||
|
|
-Н2О |
акролеин |
Н |
|
|
|
|
|
||
Н2 |
|
|
Н2О2 |
|
|
¾¾¾® |
Н2С=СН-СН2ОН ¾¾¾®Н2С-СН-СН2 |
||||
аллиловый спирт |
|
ОН ОН ОН |
|||
глицерин
Химические свойства
Химические реакции спиртов могут идти по водороду гидроксильной группы (с разрывом связи О-)Н или протекать с участием всей группы (с разрывом связи С-О).
I.Реакции одноатомных спиртов.
1.Реакции гидроксильного водорода.
А. Образование алкоголятов происходит при взаимодействии со щелочными металлами. В таких реакциях спирты проявляют кислотные свойства:
2С2Н5ОН+2Na ® С2 Н5 ОNa +Н2
этилат натрия
Алкоголяты щелочных металлов обладают более сильными основными свойствами, чем гидроксиды натрия или калия.
Б. Образование сложных эфиров(реакция этерификации). С
карбоновыми или минеральными кислотами спирты образуют сложные эфиры. Реакция обратима. Равновесие прямой реакции с карбоновыми кислотами может быть сдвинуто в сторону образования эфира добавлением какой-либо кислоты (кислотный катализ):
О |
¾¾¾® |
СН СН |
-О-С |
О |
|
||
+Н |
О |
||||||
СН3СН2ОН+НО-С |
¬¾¾ |
||||||
|
+ |
3 2 |
|
2 |
|
||
СН3 |
|
этилацетатСН3 |
|
||||
|
Н |
|
|
|
|
|
|
(этиловый эфир
уксусной кислоты)
82

Глава 7. Органические кислородсодержащие соединения
О |
О |
СН3ОН+НО-S-OH ¬¾¾¾¾®СН3 -О-S-ОН
О |
О |
|
метилсульфат |
2. Реакции гидроксила.
А. Замещение гидроксильной группы на галоген (образование гало-
генопроизводных): С2Н5ОН+НВr ® С2Н5Вr+Н2О .
Б. Дегидратация спиртов (отщепление воды) может быть внут-
римолекулярной, при этом образуются алкены:
Н ОН |
Аl2О3 , 350 |
0 |
С |
|
|
Н |
Н |
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
Н-С-С-Н |
¾¾¾¾¾¾¾¾® |
С=С |
|||||||
или Н2SO4 , 170 |
0 |
С |
|
||||||
|
|
|
|
||||||
Н Н |
|
Н |
Н |
||||||
|
|
|
|
|
|||||
и межмолекулярной, приводящей к образованию простых эфиров:
С2Н5 -О-Н |
® С2Н5 -О-С2Н5 +Н2О |
|
С2Н5 -О-Н |
||
диэтиловый эфир |
3. Окисление спиртов.
А. Полное окисление (горение): СхНyОН+О2 ® СО2 +Н2О
Б. Окисление спиртов может проводиться различнымиокислите-
лями:
· Хроматы ( СrO24- ) или кислород на катализаторе(Рt, Сu)
окисляют первичные спирты до альдегидов, а вторичные – до кетонов:
|
|
СН3 |
CrO2- |
|
СН3 О |
|||
СН |
-С-СН |
|
-С-С |
|
||||
4 |
|
|
||||||
ОН ¾¾¾¾®СН |
|
|||||||
3 |
|
|
2 |
Н2О, Н+ |
3 |
|
|
Н |
|
|
|
|
|||||
|
СН |
|
|
СН |
||||
|
3 |
нагревание |
|
|||||
|
|
|
|
|
|
3 |
||
О2
Сu
СН3-СН-СН2 -СН3 ¾¾¾®СН3 -С-СН2 -СН3
ОН |
О |
· Перманганат калия в кислом растворе окисляет первичные спирты до карбоновых кислот, а вторичные – до кетонов:
СН3СН2ОН+МnO4 +Н+ ® СН3СООН
|
|
|
|
МnO- |
|
|
|
СН -СН-СН ¾¾¾¾®СН -С-СН |
|||||||
3 |
|
|
3 |
4 |
3 |
|
3 |
|
|
Н+ |
|
||||
|
|
||||||
|
ОН |
|
О |
||||
83

Раздел 3. Органические соединения с однородными функциями
Третичные спирты окисляются гораздо труднее. В этом случае происходит разрыв углеродной цепи молекулы(обычно около атома углерода, связанного с гидроксильной группой) и образование смеси кислот и кетонов:
|
СН3 |
Сr О2- |
|||||
|
|
|
|
||||
СН -СН-СН СН ¾¾¾¾®СН -С-СН +СН СООН |
|||||||
|
|
|
|
2 |
7 |
|
|
3 |
|
|
2 3 |
Н+ |
3 |
|
3 3 |
|
|
||||||
|
ОН |
|
О |
||||
II.Реакции многоатомных спиртов.
1.Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами, при этом происходит последовательное замещение атомов водорода в гидроксильных группах. Образуются гликоляты:
|
СН2 -ОН |
Na |
|
СН2 |
-ОNа |
1 |
|
Na |
|
СН2 -ОNа |
|
1 |
|
|
|
|
|
|
|
|
|||||||||
СН2 -ОН |
¾¾¾® |
СН2 |
+ |
2 |
Н2 |
¾¾¾® |
|
+ |
2 |
Н2 |
|
|||
|
-ОН |
|
|
СН2 -ОNа |
|
|
|
|||||||
Гликоляты можно получить также при реакции многоатомного спирта со щелочью:
СН2 -ОН NaОH СН2 -ОNа
¾¾¾¾®
СН2 -ОН СН2 -ОNа
Многоатомные спирты взаимодействуют, в отличие от одноатомных, с
гидроксидом меди (II) с образованием комплексных гликолятов или глице-
ратов меди (II) с ярко-синей окраской:
|
|
|
|
|
Н2С |
|
|
О |
Н |
О |
|
|
|
|
СН2 |
||||
|
Н2С-СН-СН2 |
+Сu (ОН ) |
|
|
|
|
Сu |
|
|
|
|
||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2 |
|
¾¾® |
НС |
|
|
|
О |
О |
|
|
|
|
СН + 2Н2О |
||||||
|
|
|
|
|
|
|
|||||||||||||
|
ОН ОН ОН |
|
2 |
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Н2С |
|
|
ОН |
|
НО |
|
|
|
|
СН2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
глицерат меди (II)
Эта реакция используется как качественная для определения многоатомных спиртов.
2. Глицерин взаимодействует с азотной кислотой с образованиемнитроглицерина (сильное взрывчатое вещество):
Н2С-СН -СН2 ¾¾® Н2С О-NO2 + 3Н О
О-NO2 + 3Н О
ОН ОН ОН
+3HNO3 НС О-NO2 2
Н2С О-NO2
84
Глава 7. Органические кислородсодержащие соединения
Отдельные представители
Метиловый, или древесный, спирт (метанол) СН3ОН является одним из важнейших продуктов химической промышленности. Он используется в синтезе формальдегида, многих красителей, фармацевтических и биологических препаратов. Метиловый спирт – сильный яд. В малых количествах(около 5–10 мл) он вызывает слепоту, а при попадании в организм свыше 30 мл может наступить смерть.
Этиловый, или винный, спирт (этанол) С2Н5ОН используется в производстве синтетических каучуков, уксусной кислоты сложных эфиров. Также широко применяется в качестве растворителя лаков, красок, душистых веществ, медикаментов.
Этиленгликоль применяют при синтезе высокомолекулярных соединений, например, лавсана, а также в качестве антифриза(водные растворы различной концентрации).
Глицерин используют в текстильном, кожевенном и парфюмерном производстве при изготовлении смягчающих мазей, а также как сырье для производства нитроглицерина.
§22. Фенолы
Вэтом параграфе рассматриваются фенолы. Как уже отмечалось в
§21, к фенолам относят соединения, содержащие гидроксильную группу -ОН, непосредственно связанную с бензольным ядром. За фенолом сохранилось и старое название – карболовая кислота (карболка).
Фенолы с одной гидроксильной группой называются одноатомными, с двумя – двухатомными, с тремя – трехатомными:
ОН |
ОН |
|
ОН |
одноатомный |
ОН |
НО |
ОН |
двухатомный |
трехатомный |
||
По количеству бензольных ядер выделяютмоноядерные и много-
ядерные фенолы:
ОН |
ОН |
ОН |
ОН ОН |
|
ОН |
многоядерные фенолы |
|
моноядерные фенолы |
|
||
Строение и изомерия
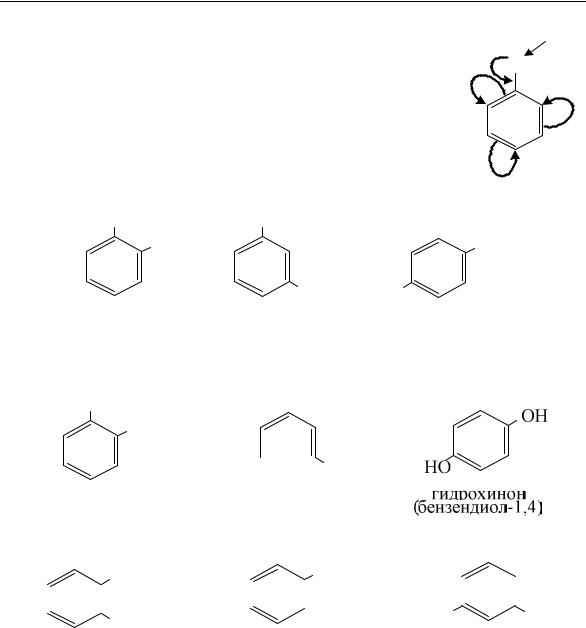
Строение фенола определяет его свойства. Пара электронов атома кислорода вступает в сопряжение с π-электронами бензольного ядра.
85
Раздел 3. Органические соединения с однородными функциями
Это вызывает дополнительное смещение электронной |
H+ |
||
плотности от атома водорода гидроксильной группы. |
|||
В результате атом водорода гидроксильной груп- |
:О |
||
пы приобретает более выраженные, чем у спиртов, ки- |
|
||
слотные свойства. Атомы же водорода бензольного яд- |
|
||
ра становятся более подвижными. |
|
|
|
Изомерия фенолов обусловлена положением гид- |
|
||
роксильной группы. Например, метильному гомологу |
|
||
фенолу – крезолу соответствует три изомера: |
|
|
|
ОН |
ОН |
|
|
|
СН3 |
|
ОН |
о-крезол |
СН3 |
Н3С |
|
м-крезол |
|
||
п-крезол |
|
||
Двухатомные (дигидроксибензолы) и трехатомные (тригидроксибензолы) фенолы также могут существовать в виде трех изомеров:
ОН |
ОН |
|
|
|
|
ОН
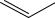 ОН
ОН
пирокатехин резорцин
(бензендиол-1,2) (бензендиол-1,3)
|
ОН |
|
|
ОН |
|
|
ОН |
|||||||
|
|
|
|
|
||||||||||
|
|
|
||||||||||||
|
|
|
|
ОН |
|
|
|
|
ОН |
НО |
|
|
|
ОН |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пирогаллол |
|
ОН |
флороглюцин |
|||||||||||
гидроксигидрохинон |
||||||||||||||
(бензентриол-1,2,3) |
(бензентриол-1,2,4) |
(бензентриол-1,3,5) |
||||||||||||
Физические свойства
Одноатомные фенолы – труднорастворимые в воде кристаллические вещества. Растворимость некоторых фенолов увеличивается с увеличением числа гидроксильных групп за счет образования между ними водородных связей. Фенолы являются более полярными веществами, чем соотвествующие предельные спирты.
Способы получения
1. Фенол и его метильные гомологи(крезолы) в значительных количе-
86

Глава 7. Органические кислородсодержащие соединения
ствах содержатся в каменноугольной смоле и выделяются из нее различными физическими способами.
2. Замещение хлора (или сульфогруппы) в ароматическом кольце на гидроксильную группу:
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
ОNa |
|
|
|
|
|
ОН |
||||||||||||
|
|
|
|
|
|
|
|
|
NaOH, 300 |
0С |
|
|
|
H+ |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
¾¾¾¾¾¾® |
|
|
|
¾¾¾® |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
давление |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
3. Кумольный способ: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Н3С |
СН3 |
|
|
|
|
|
|
|
|
СН3 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН |
|
|
|
|
|
|
|
|
|
ОН |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|
|
О |
|
|
||||||
|
|
|
|
|
Н2С=СН-СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
О2 |
, катализатор |
|
|
|
|
|
|
СН3 |
|
Н2SO4 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
¾¾¾¾¾¾® |
|
|
|
|
¾¾¾¾¾¾¾® |
|
|
|
|
|
|
|
|
|
¾¾¾¾® |
|||||||||||||
|
|
|
|
|
AlCl3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
ОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
Н2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
¾¾¾¾® |
|
|
|
|
|
|
+ CН3 -С-CН3 |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
фенол ацетон
Химические свойства
Химические свойства фенола обусловлены взаимным влиянием гидроксильной группы и бензольного ядра.
I.Реакции бензольного кольца.
1.В отличие от ароматических углеводородов, фенол легко окисляется кислородом воздуха, приобретая фиолетовую окраску.
2.Фенол без нагревания и катализаторов энергично вступает в реакции замещения атомов водорода бензольного ядра. При этом почти всегда образуются тризамещенные производные:
ОН |
|
|
ОН |
||||||
|
|
О |
N |
|
|
|
|
|
NО2 |
|
|
|
|||||||
|
|
HNО3 +H2SO4 2 |
|
|
|
|
|
|
|
|
|
¾¾¾¾¾¾® |
|
|
|
|
|
|
|
|
|
-3H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
NО2 |
||||
3. Взаимодействие фенола с бромной водой используют каккачественную реакцию на фенол. При этой реакции выпадает белый осадок трибромфенола:
87

Раздел 3. Органические соединения с однородными функциями
ОН ОН
Br |
Br |
3Br2 |
|
¾¾¾¾® |
|
-3HBr |
|
Br
II.Реакции гидроксильной группы.
1.Фенол, как и спирты, взаимодействует с активными металлами:
|
ОН |
ОNa |
2 |
+ 2Na ¾¾® 2 |
+ H2 |
2. Фенол взаимодействует со щелочами:
ОН |
¾¾® |
|
|
ОNa |
+ 2NaOH |
|
|
+ H2O |
|
¬¾¾ |
|
|
||
|
|
|
|
|
3. Феноляты вступают во взаимодействие с галогенозамещенными углеводородами с образованием простых эфиров:
ОNa |
|
|
ОСН3 |
t, катализатор |
|
|
+ NaI |
|
|
||
+ ICH3 ¾¾¾¾¾¾® |
|
|
|
|
|
|
|
4. Для определения фенола используют реакцию с хлоридом железа(Ш). При этом образуется комплексное соединение– фенолят железа, имеющее интенсивную фиолетовую окраску.
5. Фенол вступает в реакции ацилирования:
|
ОН |
O |
|
|
|
O |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
C |
|
CH3 |
|
||||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
О |
|
||||||||||
|
|
C |
|
|
CH3 |
|
O |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
+ O |
¾¾® |
|
|
|
|
|
C |
|
CH3 |
||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
C |
|
|
CH3 |
|
|
|
+ HO |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O
Отдельные представители
Фенол используют как антисептик в качестве дезинфицирующего средства, в производстве пластмасс, фотореактивов, в медицинской и лакокрасочной промышленности.
88

Глава 7. Органические кислородсодержащие соединения
§ 23. Альдегиды и кетоны
Альдегиды и кетоны – органические соединения, характеризующиеся наличием в молекуле карбонильной группы>С=0. В альдегидах
атом углерода карбонильной группы образует хотя бы одну С-Н связь, а в кетонах карбонильный углерод образует только С-С связи. Таким образом, общие структурные формулы альдегидов и кетонов имеют следующий вид:
|
R-C O |
|
R-C-R ' |
|
|
|
Н |
|
|
= |
|
|
|
|
|
O |
|
В зависимости от характера радикала альдегиды и кетоны могут |
|||||
быть предельными и непредельными. |
|
|
|
||
|
Строение и изомерия |
|
|||
Атом углерода карбонильной группы находится во втором валентном |
|||||
|
π |
состоянии – sp2 -гибридизации. Три |
|||
Rσ |
σ |
частично |
заполненные sp2 -гибриди- |
||
|
зованные орбитали углерода образу- |
||||
σ С 123О |
|||||
R(Н) |
0,122нм |
ют две С-С или С-Н σ-связи и одну σ- |
|||
|
π |
связь |
с |
частично |
заполненнойр- |
орбиталью атома кислорода. Негиб- Рис. 9.Строение карбонильной группы ридизованная р-орбиталь углерода, на
которой находится один электрон, образует π-связь со второй частично заполненной р-орбиталью атома кислорода. Т. е. в карбонильной группе присутствует двойная углерод-кислородная связь. Схематическое изображение строения карбонильной группы приведено на .рис9. Поскольку электроотрицательность кислорода выше, чем углерода, то карбонильная
|
δ+ |
δ- |
группа поляризована: |
С = |
О . |
Наличие в карбонильной группе π-связи и поляризации объясняет характерные физические и химические свойства альдегидов и кетонов. Поляризация в карбонильной группе является также причиной сравнительно высокой, по сравнению с алканами той же молекулярной массы, температуры кипения низших(т. е. с небольшими углеводородными радикалами R) альдегидов и кетонов. Полярность связи предполагает
δ+ δ-
большую легкость присоединения полярных частиц типаН -Х по сравнению с двойной углерод-углеродной связью.
Для альдегидов характерна структурная изомерия, связанная со строением углеродной цепи:
89

Раздел 3. Органические соединения с однородными функциями
Н3С-СН2 -СН2 -СН2 -СНО |
Н3С- |
СН-СН2 -СНО |
валериановый альдегид |
|
СН3 |
3-метилбутаналь |
||
|
изовалериановый альдегид |
|
Изомерия кетонов определяется не только строением углеродной цепи, но и положением в ней карбонильной группы:
Н3С-СО-СН2 -СН2 -СН3 |
Н |
С-СН |
-СО-СН -СН |
Н С-СО- |
СН-СН |
||
пентанон-2; |
3 |
2 |
2 |
3 |
3 |
|
3 |
|
пентанон-3; |
|
|
|
СН3 |
||
метилпропилкетон |
|
диэтилкетон |
|
3-метилбутанон-2; |
|||
метилизопропилкетон
Общая формула для предельных альдегидов и кетонов СnH2n O . Следовательно, альдегиды и кетоны с одним и тем же числом углеродных атомов являются изомерами.
Физические свойства
Формальдегид – газ, следующие гомологи альдегидов – жидкости, а высшие альдегиды – твердые вещества. Ацетон и ближайшие представители гомологического ряда кетонов– жидкости, а высшие кетоны – твердые соединения. Альдегиды с невысокой молекулярной массой обладают резким запахом более сильным, чем у кетонов. Альдегиды с С10
иС12 имеют приятный запах и используются в парфюмерии. Вкус и аромат хлеба, а также вина и других пищевых продуктов обязаны присутствием в них некоторых альдегидов и кетонов.
Температура кипения альдегидов и кетонов ниже температуры кипения соответствующих (с тем же числом атомов углерода) первичных
ивторичных спиртов. Кетоны кипят при более высоких температурах, чем альдегиды с тем же числом углеродных атомов.
Муравьиный и уксусный альдегиды, а также кетоны с невысокой молекулярной массой растворимы в воде. С увеличением молекулярной массы растворимость этих соединений уменьшается. Все альдегиды и кетоны хорошо растворимы в органических растворителях.
Способы получения
Альдегиды и кетоны можно получать следующими способами:
1.Окислением спиртов (стр. 83).
2.Дегидрированием спиртов:
90
